没食子鞣质和联合氟化钠对不同状态变链菌葡萄糖基转移酶活性的影响*
林 静 赵 今 朱 明 李新尚
龋病是人类口腔最常见的细菌感染性疾病。变形链球菌(Streptococcus mutans,简称变链菌)是公认的主要致龋菌群,其代谢过程中产生的葡萄糖基转移酶(glucosyltrans-ferases,GTFs)介导变链菌对牙面的粘附[1],在牙菌斑生物膜的形成和发展过程中起关键作用。抑制葡萄糖基转移酶的活性能抑制病理性牙菌斑生物膜的形成,从而预防龋病及其他生物膜相关性疾病。牙菌斑生物膜是一个复杂的生态环境,生物膜对宿主防御系统的抵抗力、耐受性强;对抗生素的敏感性降低;具有空间和环境的多样性;能表达不同于浮游细菌的表型。因此防龋药物的研究需从对浮游细菌和细菌生物膜两方面进行研究,才能从本质上阐明药物防龋的作用机制。
研究表明没食子鞣质(Aleppo Gall)可以抑制口腔细菌对羟基磷灰石的粘附[2],并且能够改变牙菌斑生物膜的形态结构,降低生物膜密度及调整生物膜内部死活菌的比例[3],对GTF活性的作用仍待验证。根据现有文献,没有系统的实验设计评估药物对不同状态变链菌葡萄糖基转移酶活性的影响,因此,本研究采用析因实验设计,比较没食子鞣质、氟化钠、没食子联合氟化钠对细菌浮游状态及生物膜状态下GTF酶活性的影响,探讨实验药物防龋的作用机制。
1.材料和方法
1.1 实验材料和仪器
1.1.1 试验药物:用含2%蔗糖的BHI液体培养基将没食子鞣制配制成4mg/ml的溶液,氟化钠配置为50mg/l的溶液。
1.1.2 实验菌株及菌悬液的制备:变形链球菌ATCC 25175购买于四川大学口腔生物医学工程教育部重点实验室。将复苏48h后的细菌接种于脑心浸液(brain-heart infusion,BHI)液体培养基中,37℃下厌氧培养24h,涂片检查为纯培养后,用无菌生理盐水调菌浓度在540nm波长处吸光度OD值为1.0的菌悬液(3×108CFU·ml-1)备用。
1.1.3 主要仪器及试剂:厌氧盒(日本三菱株式会社),恒温培养箱(上海精宏实验设备有限公司DNP-9162),厌氧指示剂(法国梅里埃OC466922-96118),厌氧发生剂(法国梅里埃REF-96124),标准6孔细胞培养皿,超滤离心管,标准96孔微量板,固体硫酸铵,考马斯蓝G-250,牛血清白蛋白(Sigma,美国),葡聚糖,磷酸盐缓冲液(0.01mol/L pH 6.0),葱酮试剂:200mg葱酮加入100ml浓硫酸中搅拌溶解。
1.2 方法
1.2.1 实验设计 根据研究目的采用三因素两水平(2×2×2)析因试验设计。三个因素分别为变形链球菌(A),实验药物没食子(B),对照药物氟化钠(C)。每一个因素有两个水平,变形链球菌有浮游(A1)和生物膜(A2)培养两个水平,药物没食子有干预(B1)和不干预(B2)两个水平,氟化钠也有干预(C1)和不干预(C2)两个水平,将三个因素的两个水平进行排列组合,交叉分组。
1.2.2 实验分组
根据实验设计分为8组:

每组7个平行样本(样本含量的计算根据析因实验把υe≥12作为实验精度的最低要求,计算得到每组7个平行样本,样本总数为56。)
1.2.3 不同状态细菌的培养
浮游状态组:将制备好的菌悬液1ml接种于5mlBHI液体培养基混匀,置于50ml灭菌离心管内(盖紧瓶盖)放入摇床,300rmp·h-1,37℃下培养24h增菌。
生物膜状态组:将8×8cm无菌盖玻片置于6孔细菌培养皿,加入菌悬液1ml和5mlBHI液体培养基混匀,放入厌氧盒37℃下培养24h形成生物膜。
1.2.4 药物对GTF活性的作用 依据实验分组分别向每组加入制备好的实验药液培养基,37℃下厌氧培养18h。粗酶提取液的制备:①生物膜组吸出六孔板内培养基放人离心管内,浮游组直接离心(3000r/min,20min),②上清液加固体硫酸铵达60%饱和度,置于4℃冰箱24h,③再次离心(12000r/min,30min),弃去上清液,将沉淀物用5mL磷酸盐缓冲液(0.01mol/L,pH6.0)溶解,④放入超滤离心管内离心(10000r/min,15min)2次,弃去管底水,⑤收集滤膜管内粗酶提取液进行酶活性测定。
酶活性测定:取GTF粗酶0.1ml,采用考马斯亮蓝法测定总蛋白含量,采用蒽酮法测定酶-底物反应液中的还原糖量。将数据导入Excel,用每个样本的还原糖量除以该样本的蛋白含量即得到该样本每毫克胞外GTF蛋白所还原的糖含量。GTF活力计算方法:酶活力=还原葡萄糖量×葡萄糖相对分子质量-1×60-1。实验药物对酶活性抑制率=(同水平不用药组-药物组)/同水平不用药组×100%
1.2.5 统计学方法:采用SPSS17.0软件包对葡萄糖基转移酶活性进行析因分析;实验药物对酶活性抑制率进行单因素方差分析。在α=0.05的情况下比较各组有无统计学意义。
2.结果
GTF酶活性测定见表1。析因分析结果,GTF酶活性在细菌不同培养状态下有统计学意义(P<0.05),浮游状态下GTF酶活性高于生物膜状态;没食子鞣质干预和氟化钠干预组间差异有统计学意义(P<0.05);B因素与C因素间有交互作用(P<0.05),即没食子鞣质联合氟化钠使用有效。
实验药物对GTF酶活性的抑制率见图2,没食子、氟化钠、没食子联合氟化钠对细菌不同状态下GTF酶活性的抑制率有差异(P<0.05),浮游状态下的葡萄糖基转移酶比生物膜状态对药物作用敏感,没食子的抑制作用最为显著,抑制率没食子>没食子联合氟化钠>氟化钠。
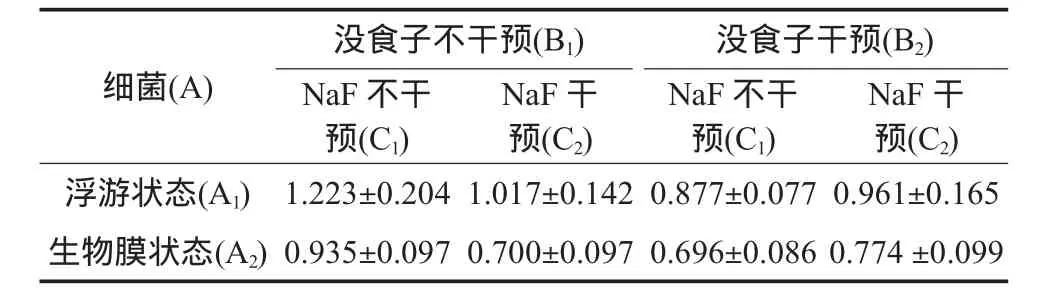
表1 实验药物对变链菌不同状态下GTF酶活性的影响(U)

3.讨论
龋病是人类最常见的口腔疾病,对龋病防治的研究一直是口腔领域艰巨而重要的课题。国内外学者进行了多种防龋措施的实验研究,如抗生素,氟化物,化学制剂,免疫防龋等。但这些方法存在诸多局限性及不足之处,因此寻找安全、有效、经济的防龋药物一直是龋病研究者们关注的热点,天然药物因其毒副作用小,取材方便和经济,在龋病防治中的作用日益受到重视。天然药材具有明显的地域性,没食子作为维吾尔医药防龋的代表性药物,在民间有悠久的应用历史,但缺乏系统的研究,课题组前期完成了没食子有效成分的分离、提取、鉴定;从没食子对口腔细菌的生长、代谢以及粘附等致龋毒力因子的作用进行实验,验证了实验药物的体外防龋效能,本实验将进一步研究没食子鞣质对变链菌GTF酶活性的作用,并探讨与氟制剂联合应用是否有协同作用,开拓龋病防治的新途径。
氟化物是目前公认有效的防龋制剂[4],但其使用具有明显的局限性。含氟制剂的使用需要众多专业人士指导和实施,耗资巨大,同本国国情极不相符,更不适合于我国西部地区龋病的群体防治。王敬[5]研究结果显示氟浓度为50mg/L的氟化钠制剂对变形链球菌GTF活性有较明显的抑制作用。长期应用氟化钠可致使慢性氟中毒,耐氟菌株的产生则可能进一步影响氟化物防龋的效果[6]。由于天然药物药效学差异大,本研究根据前期实验[1]得到的没食子鞣质最低抑菌浓度(MIC)4mg/l,以50mg/L氟化钠,以及二者联合使用,与未用药组对比,没食子、氟化钠、没食子联合氟化钠对两种状态培养下的GTF活性均有抑制作用,没食子对GTF活性的抑制率最高,联合用药组的抑制率低于没食子,高于氟化钠。GTF是一种需金属离子激活的酶,氟性质活泼,能通过与激活酶所需的金属离子优先结合,使酶构型发生变化,从而抑制酶的活性。没食子鞣质不具有与氟离子竞争GTF酶上结合位点的作用,相互之间不存在拮抗作用,目前两种药物联合作用的具体机制尚不清楚,实验结果显示没食子与氟化钠联和使用的药效的介于两种药物单独使用之间,不能说明二者具有协同作用。没食子鞣质可能作用于变形链球菌葡糖基转移酶催化活性区[7],从而影响葡糖基转移酶的活性。
在不用药物干预的情况下,浮游状态下培养的变链菌较生物膜状态培养的变链菌产生的葡萄糖基转移酶(glucosyltransferase,GTF)活性高。证实了细菌在浮游状态与生物膜状态中葡萄糖基转移酶的性质存在差异。可能是由于GTF能在不同状态下合成不同结构的葡聚糖[8],这种结构的差异由键的组成和排列的变化造成,从浮游状态到生物膜状态后,α-1,3葡萄糖苷键和α-1,6葡萄糖苷键的比例有所变化。目前,防龋药物的研制多以浮游细菌为研究对象,往往对浮游细菌非常有效的药物却难以对付生物膜,因为生理状态下,生物膜中的细菌比浮游细菌具有更强的毒性、耐药性和抵抗宿主免疫防御的能力。因此,对口腔微生物及酶的抑制研究需从浮游与生物膜两方面进行。
研究结果显示实验药物没食子、氟化钠、没食子联合氟化钠对浮游状态和生物膜状态下培养的变链菌葡萄糖基转移酶均有抑制作用。浮游状态下的葡萄糖基转移酶比生物膜状态下葡萄糖基转移酶对同一浓度的同种药物的作用敏感。黄冰冰研究发现[9,10]:从中药厚朴中提取抗变链活性成分MO2,能降低细胞表面疏水率,抑制葡糖基转移酶催化合成水不溶性葡聚糖。其质量浓度为1.25-5.0g/L时即可抑制所有GTF的活性,其中包括牙菌斑和悬浮液中的GTF;对悬浮液中的葡萄糖基转移酶的抑制比对吸附在获得性膜上的葡萄糖基转移酶强。其机制可能是非竞争性地抑制GTF的葡聚糖结合区,同时厚朴酚作用于蔗糖的分解和葡萄糖的转运过程,使厚朴有效抑制变链菌GTF酶活性。没食子鞣质对浮游状态及生物膜状态下的GTF酶活性抑制差异显著,目前对此差异的原因尚不清楚,可能是生物膜状态的细菌启动了一套与浮游状态不同的基因表达形式,从而gtfB、gtfC、gtfD基因的表达发生改变,与药物敏感性有直接关系[11]。KooH报道称[12]芹菜素可以抑制葡萄糖基转移酶的活性,并能显著降低gtfB和gtfC的表达,相反增加gtfD的表达。因此,我们还将在mRNA水平研究细菌生物膜状态和浮游状态下GTF基因表达的差异,探索没食子鞣制防龋的作用机制。
[1]张 鹰,文玲英,储冰峰.变形链球菌黏附相关分子及其针对性免疫防龋的研究进展[J].中华老年口腔医学杂志,2010,8(2):120-123
[2]赵 今,李 艳,孙玉亮等.没食子鞣质及有效提取物对致龋细菌粘附抑制作用[J].新疆医科大学学报,2009,32(1):6-8
[3]赵 今,哈木拉提·吾甫尔,林 静等.没食子鞣质及有效提取物对牙菌斑作用的实验研究[J].科技导报,2009,27(7):24-28
[4]Louis W,Ripa.A half-century of community water fluoridation in the united states:review and commentary[J].J Public Health Dent,1993,53(3):17-44
[5]王 敬.氟化微量元素防龋作用的实验研究[D].西安:第四军医大学口腔医学院,2004
[6]Loreren C,Simons YM,Soet JJ,et al.Acidogenesis in relation to fluoride resistance of Streptococcus mutans[J].Oral Microbiol Immunol,1991,6(5):288-291
[7]汪 林,储冰峰,王成龙等.IPTG诱导变形链球菌葡糖基转移酶可溶性表达及活性初步测定[J].中华老年口腔医学杂志,2010,8(2):94-97
[8]Schilling KM,Bowen WH.Infect Immun,Glucans synthesized in situ in experimental salivary pellicle function as specific binding sites for Streptococcus mutans[J].Infect Immun,Jan1992,60:284-295
[9]Huang BB,Fan MW,Han DX.Effect of Magnolia Off icinal is Extract on Cariogenic Activity of Mutans Streptococci.Journal of Oral Science Research,2010,26(3):362-365
[10]Huang BB,Fan MW,Wang SL,et al.An-glucosyltransferase meachanism of magnolol from Magnolia efficinalis.Areh Oral Biol,2006,51(10):899-905
[11]Koo H,Xiao J,Klein MI,et al.Exopolysaccharides Produced by Streptococcus mutans Glucosyltransferases Modulate the Establishment of Microcolonies within Multispecies Biofilms[J].Journal ofBacteriology, 2010, 192(12):3024-3032
[12]Koo H,Seils J,Abranches J,et al.Influence of apigenin on gtf gene expression in Streptococcus mutans UA159[J].Antimicrob Agents Chemother.2006,50(2):542-548

