颈动脉体瘤的综合影像诊断
戚跃勇 邹利光 周 宇 帅 杰 周 政 梅文铭
颈动脉体瘤(carotid body tum or,CBT)又称副神经节瘤(paraganglioma)或化学感受器瘤(chemodectoma),临床上较为少见[1-3]。影像学检查在其诊疗中起着重要的作用,本文收集24例经手术病理证实并经超声、CT、MRI、DSA等影像学综合检查的CBT作一回顾性分析,以分析其各自的诊断价值。
方 法
经手术病理证实的CBT患者24例,男9例,女15例,年龄 13~57岁,平均(37.5±5.6)岁,病程 2月~12年。右侧10例,左侧 11例,双侧3例。查体:肿块表面光滑,边界清,质较硬,水平方向均可推动。触及颈内外动脉分离征者12例,触及搏动者10例,闻及收缩期杂音6例。4例肿块可见缓慢增大,2例有局部胀痛感。外科手术前均行Matas试验,即压迫患侧颈总动脉以阻断其血流,从压迫数分钟渐增至30min未出现眩晕、晕厥等脑缺血症状为止,每日4~6次,坚持30~40d左右。
24例CBT患者均行超声、MSCT和DSA检查,其中18行MSCTA检查、16例行MRI和MRA检查。16例颈动脉体瘤(17个肿块)行常规FSE T1WI和T2WI和MRA检查,其中 12例行3D TOF MRA,8例行增强后3D CEMRA检查。所用设备主要有GE Light Speed 16层螺旋CT成像系统、GE Light Speed 64层容积CT成像系统、GE 1.5T Signa Horizontal磁共振成像系统、GE 3.0T Signa Twin Speed磁共振成像系统,岛津Digitexα2400型和GE Innova 3100平板DSA成像系统。所有影像资料均由两名有经验的放射学医师按双盲法观察,然后共同讨论,并对影像征象达成一致意见。
结 果
超声、MSCT、MRI和DSA检查均可显示肿瘤位置、大小及形态,所有CBT均位于颈动脉分叉处,21例为单侧,3例为双侧,共27个瘤体,平均直径(5.0±2.3)cm,其影像学特征为瘤体位于颈总动脉分叉处并与其紧密相连,呈单发肿块,瘤体血供丰富。瘤体使颈外动脉向前内移位、颈内动脉向后外移位,颈内外动脉分叉角度增大明显,MSCTA、MRA及DSA呈“金杯”征改变。按照Shamblin等[4]的CBT分型法,本组病例27个瘤体中,Ⅰ型(局限型)15个,Ⅱ型(部分包裹型)10个,Ⅲ型(包裹型)2个。
27个CBT超声表现为颈动脉分叉处边界清晰的中低回声团块,肿瘤上缘观察欠清。瘤体均位于颈动脉外膜与管腔之间,瘤体内血流丰富,为高速低阻血流信号,彩色多普勒显示瘤内网状血管15例。超声初步诊断为颈动脉体瘤者21例,3例误诊为神经鞘瘤,诊断准确率为87.5%(21/24)。
24例均行CT平扫加增强,CT平扫病变为密度均匀边缘清晰的软组织肿块,CT值30~50HU,动脉期为明显强化,CT值高达200HU以上,延迟扫描病变密度明显降低。CT增强表现为均匀强化者17例(瘤体密度与颈内、外动脉密度相当),不均匀强化者5例 (图1)。1例误诊为神经鞘瘤,CT诊断准确率为95.8%(23/24)。18例MSCTA显示20个瘤体均位于颈动脉分叉水平,其中8例包绕颈总动脉和颈内、颈外动脉,10例骑跨于颈动脉分叉处,压迫颈内动脉向后外推移、颈外动脉向前或前内推移。20个瘤体的MSCTA可显示颈动脉分叉夹角增大呈“金杯”者17个(图 2)。
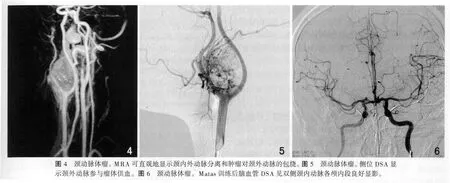
16例CBT患者的MRI显示肿瘤为信号欠均匀的纺锤形或不规则形,CBT内见流空的血管影像,12个(12/18)瘤体可见“盐和胡椒”征(图3)。17个肿块均有明显强化,1例可见显著坏死区。16例患者行MRA检查,可直观地显示颈内外动脉分离,肿瘤与颈内外动脉的方位关系 (图4)。MRI及MRA诊断符合率为100%(16/16)。

24例颈动脉体瘤均行DSA检查,能明确诊断。瘤体均位于颈总动脉分叉部上方。颈外动脉向内、向前移位,颈内动脉向外、向后移位。正位DSA见颈内、外动脉局部呈弧形左右分离构成环状,分叉角50°~80°,平均60°。侧位颈内外动脉分叉角度亦增大呈抱球状,分叉角 50°~85°,平均 65°。24例患者 27个瘤体中,供血动脉主要来源于颈外动脉分支或颈内外动脉起始处发出的异常小动脉(图5)。其中仅由颈外动脉发出的滋养动脉供血者17个(包括枕动脉分支供血6个)。颈内、外动脉同时供血者10个。供血动脉增粗迂曲呈细网状或丛状排列,瘤体明显染色,但分布不均,部分可见斑片状血池形成,且排空延迟。有4例出现静脉早显,6例能看到明显的引流静脉。12个Shamblin分型Ⅱ型及Ⅲ型者,被包裹的局部颈动脉管腔均不规则,管径变细。14个瘤体主要由颈外动脉发出的滋养动脉供血者,因瘤体的盗血现象出现患侧上颌动脉及其分支显影浅淡。M atas训练前,脑血管交叉试验造影见双侧颈内动脉各颅内段良好显影者8例。对10例对侧颅内血管不显影和6例显影不佳者,经M atas训练后再行脑血管交叉试验造影,均见双侧颈内动脉各颅内段良好显影(图6)。
讨 论
颈动脉体是位于颈总动脉分叉处外鞘内的化学感受器,当血液氧气、二氧化碳压力及H+浓度发生变化时,可反射性调节呼吸和循环系统。慢性缺氧等因素可导致体内血液成分改变,从而刺激颈动脉体,使其代偿增生,最终形成肿瘤[1-3]。因此,CBT是由颈动脉体增生衍变而来的,一旦发生,即可向任何方向生长,但因其下方有颈动脉鞘筋膜的限制,故向上生长较快。患者临床上多无症状,也较少出现生化实验室检查异常,因此,依据病史及体征难以准确诊断。术前活检亦较困难,因为CBT血管丰富,瘤组织结构复杂多样,活检极易出血,常不能获得满意的标本,目前多不主张行穿刺活检。Shamblin等[4]报道该病的误诊率达43%。
CBT的超声、CT、MRI及DSA的共同影像特点为颈内动脉受压移位,颈内外动脉夹角增大,分叉间距增宽。本组病例的诊断准确率中,MRI及DSA最高,均为100%,CT次之(95.8%),超声最低(87.5%),除了与其影像学检查自身特点有关外,可能与各自检查的先后顺序有关,CBT的影像检查易受影像设备的普及、检查费用、检查时间等因素的影响,本组病例的检查顺序均为超声、CT、MRI和DSA的先后顺序,后面的检查可以得到前面已检查结果的补充和印证,从而提高其诊断准确率。
超声检查具有普及、无创、安全、快速、易重复等特点,但其最大的缺点是空间分辨率较低,而彩色多普勒血流显像可实时立体地显示瘤体内细小血管的血流情况。典型的超声表现是高血流肿块伴颈动脉角的增大。尽管其诊断准确率相对较低(本组为87.5%),但其快速简捷、便于随访的特点,使得超声检查仍为目前CBT的首选筛查手段[5]。
随着CT检查的普及,尤其是近年来MSCT的扫描时间更快、采集层厚更薄、图像分辨率更高,使其迅速成为CBT的最佳检查方法。MSCT可准确地显示肿块的位置、形态、大小,MSCTA可准确测量颈动脉角,显示肿块与颈内外动脉及周围骨质结构的位置关系[6-8]。
作为无创的影像学检查方法,MR可提供比CT更多的软组织的信息。CBT的MR表现特点是T1WI和质子加权为低信号,T2WI高信号,瘤体内有较多流空的血管,典型表现为“盐-胡椒”征(在较大的瘤体中较易出现),“胡椒”为肿瘤内流空血管形成的散在无信号流空影,“盐”是病变内流速较慢的血流及出血呈点状高信号,在T2WI和增强图像上高信号的肿瘤。MRA较SE序列更容易显示瘤体内高速的血液征象和血流动力学改变。因此,典型的颈动脉分叉部位、颈内外动脉的移位及瘤体内丰富的血供三大特点即可获得准确的MRI诊断[9]。
目前,DSA仍是CBT诊断的金标准,通过分别进行颈内外动脉的超选择DSA造影,对准确判断瘤体的血供来源、分析颈部血管情况和确定手术方式等都有重要作用。但是,DSA必须结合超声、CT和MRI检查,以显示周围软组织和骨骼的情况。通过脑血管交叉试验DSA造影能准确地了解Matas训练的效果,且为手术治疗提供依据。
归纳CBT的影像学特点为:瘤体位于颈动脉分叉处,颈动脉分叉角度增大,颈内、外动脉移位;供血动脉以颈外动脉为主,呈网状、丛状分布,血供较丰富。当出现这些征象时多能诊断CBT。但仍需与如下疾病进行鉴别:①神经鞘瘤:多位于颈动脉分叉的后方,颈内外动脉分叉角不大,瘤体血供不如CBT丰富。②颈动脉分叉部假性动脉瘤:该病在临床上较难与颈动脉体瘤鉴别。但其DSA主要表现为对比剂滞留于瘤腔,漏口处可见对比剂的“喷射征”。③颈部淋巴结:颈部淋巴结如融合成团块且位于颈动脉分叉部则与颈动脉体瘤易混淆,但颈内外动脉分叉角不大,血供分布不均且不丰富。
总之,超声、CT、MRI及DSA在颈动脉体瘤的诊断中均具特点,临床上应根据其检查目的选择合适的检查方法。
1.Vogel TR,Mousa A Y,Dom brovskiy VY,et al.Carotid body tumor surgery:management and outcomes in the nation.Vascular&Endovascular Surgery,2009,43:457-461
2.Scanlon J,Lustgarten JJ,Stewart B,et al.Successful devascularization of carotid body tumors by covered stent placement in the external carotid artery.Journal of Vascular Surgery,2008,48:1322-1324
3.Gupta AK,Purkayastha S,Bodhey NK,et al.Preoperative embolization of hypervascular head and neck tum ours.Australasian Radiology,2007,51:446-452
4.Sham blin WR,Re Mine WH,Sheps SG,et al.Carotid body tumor(chemodectoma).Clinicopathologic analysis of ninety cases.Am JSurg,1971,122:732-739
5.Giannoni MF,Irace L,Vicenzini E,et al.Carotid body tum ors:advantages of contrast ultrasound investigation.Journal of Neuroimaging,2009,19:388-390
6.钱 雯,宋济昌,包 兵.头颈部副神经节瘤的影像学诊断.中国医学计算机成像杂志,2004,3:155-159
7.Fillinger M.Carotid body tumor:three-dimensional imaging.J Vasc Surg,2003,37:913
8.Iannaccone R,Catalano C,Laghi A,et al.Bilateral carotid body tumor evaluated by three-dimensional multislice computed tomography angiography.Circulation,2004,109:e64
9.Arya S,Raob V,Juvekar S,et al.Carotid body tumors:objective criteria to predict the shamblin group on MR imaging.American Journal of Neuroradiology,2008,29:1349-1354

