不同外源激素及培养方式对甘草试管苗生长的影响
余 斌,刘 娟,刘 昕,黄慧英,王 清
(1.甘肃农业大学农学院,甘肃兰州 730070;2.甘肃农业大学生命科学技术学院,甘肃兰州 730070;3.甘肃省作物遗传改良与种质创新重点实验室,甘肃兰州 730070)
甘草(Glycyrrhiza uralensis)为豆科甘草属多年生草本植物,根和根茎具有极高的药用价值[1],素有“国老”、“十方九草”之誉[2]。同时,甘草在食品、饮料、卷烟、化妆品等行业中都有广泛的应用[3]。近10年,人们破坏性地采挖野生甘草,使野生甘草种群面积迅速减小,种群质量不断下降,甘草资源面临严重危机[4,5]。为了保护甘草这一宝贵的种质资源,同时满足国内外市场对甘草日趋剧增的需求,迫切需要开展大面积人工栽培甘草。但由于野生甘草种子发芽率极低(5%~10%),而甘草的组织培养可以很好的解决这一问题。组织培养技术中试管苗培养体系对培养物的生长状态,增殖及分化方向有着较大的影响,是组织培养技术中的关键因素[6]。所以进行甘草试管苗培养体系的优化对,开展组织培养快速繁殖甘草苗就具有十分重要的意义。
1 材料和方法
1.1 试验材料
甘肃省广泛种植的乌拉尔甘草,由甘肃农业大学生命科学技术学院作物遗传育种教研室提供。
1.2 试验方法
1.2.1 材料的扩繁培养 挑选籽粒饱满的甘草种子,用70%的酒精浸泡2~3 min,然后15%的84消毒液浸泡15~20 min,再用无菌水漂洗3~4次。将消毒后的种子接种在经高压灭菌的MS固体培养基中(pH 5.8),每个三角瓶接15~20粒种子,待种子萌发并形成4~5片真叶的幼苗时作为试验的备用材料。
1.2.2 不同培养方式及不同外源激素下甘草试管苗的形成 将甘草幼苗剪切成两叶茎段,接种在固体、液体和固液双层培养基中培养。每种培养方式均设置5种培养基配方,分别为:
①MS+1.0 mg/L IBA+13.5 mg/L KH2PO4
②MS+13.5 mg/L KH2PO4
③MS+1.0 mg/L IAA+13.5 mg/L KH2PO4
④MS+1.0 mg/L IAA+1.5 mg/L 6-BA
⑤MS+1.0 mg/LIAA+13.5 mg/L KH2PO4+1.5 mg/L 6-BA
按照文献[7]固体、液体、固液双层培养方法,于每一种培养基配方下接种6瓶甘草试管苗,每瓶接入5个茎段。将试管苗置于25℃,2 000 lx光照条件下培养,40 d后测量植株全长、株高、根长、根直径以及称量试管苗的鲜重。采用精度为0.01 mm的游标卡尺测量根中部直径为根直径。其余指标按照常规方法测量或称量。
2 结果与分析
2.1 不同外源激素水平对甘草试管苗生长的影响
2.1.1 不同外源激素水平对固体培养基中甘草试管苗生长的影响 对固态培养基下甘草试管苗不同性状的方差分析表明,供试指标全长、株重、根直径、根长和根重均在①、②、③号培养基中表现较高。与④和⑤中各项生长指标相比,均达到极显著差异(表1)。说明①、②和③号培养基是甘草试管苗的适宜培养基。从叶片数看,①号培养基的甘草试管苗平均叶片数为8.88片/株,极显著的高于其他培养基上的叶片数。说明①号培养基最适合于甘草试管苗的生长。
2.1.2 不同外源激素水平对液体培养基下甘草试管苗生长的影响 通过对液态培养方式下试管苗的各项生理指标的方差分析,可得出以下结论,无论是叶片数、株重、根直径还是根长和根重,①、②、③培养基中表现较好,与④和⑤各项生长指标相比,均达到极显著差异(表2)。但就全长来说还是以①的值最高,且显著的高于其他激素配比。因此,在液态培养方式下,生长状态最好的激素配比仍然是①,在今后的研究中可作参照。
2.1.3 不同外源激素水平对固液双层培养基下甘草试管苗生长的影响 对固液双层培养方式下甘草试管苗不同性状的方差分析表明,试管苗的叶片数、根直径、根长和根重在①、②、③培养基中无显著差异。全长和株重在①和②培养基中表现更好。在①培养基中全长和株重的值分别为12.06 cm和0.15 g,在②中的值分别为12.08 cm和0.14 g。而各项生理指标与④和⑤相比,均达到极显著差异(表3)。由此说明,13.5 mg/L KH2PO4和在此基础上加有1.0 mg/L IBA的培养基更有利于甘草试管苗的生长及生根。

表1 不同外源激素水平在固态培养方式下对甘草试管苗各性状的影响Table Representations of licorice seedlings cultured in vitro with solid mediums

表2 不同外源激素水平在液态培养方式下对甘草试管苗各性状的影响Table 2 Representations of licorice seedlings cultured in vitro with liquid mediums

表3 不同外源激素水平在固液双层培养方式下对甘草试管苗各性状的影响Table 3 Representations of licorice seedlings cultured in vitro with combinations of liquid mediums and solid mediums
2.2 不同培养方式对甘草试管苗生长的影响
分别将3种培养方式下,在各个外源激素水平中获得的各项生理指标的平均值进行对比,分析不同培养方式对甘草试管苗生长的影响。
无论是全长还是根长均以固体培养基下生长的甘草试管苗最好(图1)。在固体培养基中试管苗全长和根长的平均值分别为10.03 cm和2.65 cm,比液体培养基下的相应指标分别高19.42%和92.97%;比固液双层下的高28.90%和48.88%。
另外,试管苗根的直径在固态培养方式下明显大于液态和固液双层培养下的甘草根直径(图2),其平均直径0.88 mm,比液体培养基中的值高90.59%,比固液双层中的值高13.86%。

图1 不同培养方式对甘草试管苗的全长及根长的影响Fig.1 The length of seedling and root of licorice cultivated in vitro with different culture manners

图2 不同培养方式对甘草试管苗的根直径的影响Fig.2 Root diameter of licorice seedling cultivated in vitro with different culture manners
根重和株重也以固态培养基下生长的甘草试管苗最好,其根重和株重的平均值为0.040 g和0.138 g,比液态培养基下的相应指标高71.7%和53.3%。另外,株重平均值比固液双层培养基下的相应指标高38.0%,但是,根重在固体及固液双层培养基中无差异(图 3)。
此外,甘草试管苗叶片数也以固体培养基中的最多,为5.93(片)。分别比液态培养基的多25.4%,比固液双层培养基的多高18.2%(图4)。

图3 不同培养方式对甘草试管苗的根重和株重的影响Fig.3 Fresh root weight and seedling weight of licorice cultivated in vitro with different culture manners
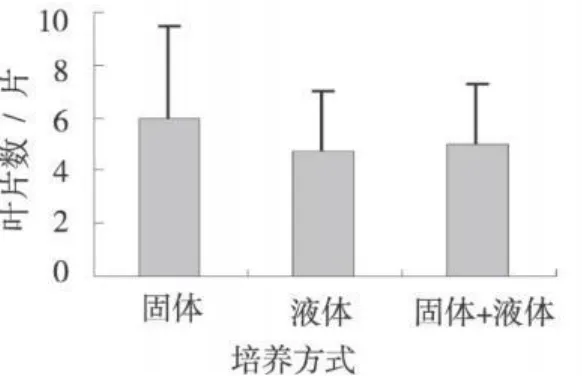
图4 不同培养方式对甘草试管苗的叶片数的影响Fig.4 The number of leaves of licorice seedling cultivated invitrowith different culture manners
3 讨论
通过比较3种不同培养方式下甘草试管苗的生长状态在固态培养方式下生根及生长状态最好,加之固体培养方式稳定性好,操作简便,应为甘草试管苗的最适培养方式,这也证实了Bteat T等[8,9]提出的固体培养方式在生产中是目前使用的甘草组织培养中最常用的培养方式。固液双层培养虽在根重方面与固态培养间无明显差别,但其操作繁琐,药品浪费较大,而且其余生理指标均不如固态培养方式,所以培养效果应次于固体培养方式。液体培养在3种不同培养方式中甘草试管苗生长状态最差,而且,其要求操作精细,如在操作过程中一个材料出现污染,将导致全瓶材料的共同污染,从而在以后的甘草试管苗培养方式中不适宜用液体培养。
试验得到了最适合于甘草试管苗生长的培养基配方(MS+1.0 mg/L IBA+13.5 mg/L KH2PO4)。还发现,培养基中凡加入了KH2PO4的甘草试管苗各指标性状均表现较好。可能因为P是核酸、细胞质、细胞膜的组成成分,并且在生物体新陈代谢中起着重要的作用。K对参与活体内各种反应的酶起着活化剂的作用,且能促进呼吸进程及核酸和蛋白质的形成[10]。KH2PO4在甘草培养基中增加P和K的含量,可使甘草茎段生根速度快而健壮,而且生根率、种苗移栽成活率均有提高。
试验中,培养基④、⑤中加入了6-BA的甘草试管苗生长状态均不佳,不仅没有形成根,而且在基部产生愈伤组织,并在后期出现褐化,这是由于甘草试管苗难以利用外源6-BA及其代谢中间物,对植株各项生理参数表现出恶化趋势,谢绍萍[11]在研究甜菊愈伤组织生长分化发现,适当浓度的6-BA能有效地诱导芽的发生,但高浓度则抑制芽的发生。但外源6-BA是如何负面影响植物生长,目前,文献存在不同的观点,其机理有待进一步研究。
[1] 杜茜.水分和肥料对甘草产量及品质的影响[J].草原与草坪,2007(5):62-64.
[2] 张继,姚健,丁兰,等.甘草的利用研究进展[J].草原与草坪,2000(2):12-17.
[3] 王照兰,杜建材,于林清,等.甘草的利用价值、研究现状与存在的问题[J].中国草地,2002,24(1):73-76.
[4] 杨之畅.内蒙古伊克昭盟甘草、麻黄资源的保护和利用问题[J].自然资源,1989(1):70-73.
[5] 杨戈,李银芳.麦盖提县的甘草资源及其保护和利用干早区研究[J].1994,11(3):35-38.
[6] 冯慧敏.遗传工程在牧草育种方面的研究现状及展望[J].草原与草坪,1994(2):8-9.
[7] 彭晓莉,王蒂,张金文,等.激素诱导下不同培养方式对马铃薯微型薯的诱导效应[J].甘肃农业大学学报,2006,41(1):16-19.
[8] Bteat T,Carle V.Development of an automated plant culture system[J].Plant Cell Tissus and Organ Culture,1985,5(2):107.
[9] Ecluardo H,Kitahhara,Linda S,et al.Shoot and root formation in cells cultures of Eucalyptus[J].Forest Sci,1975,(121):242-243.
[10] 于林清,何茂泰,王照兰等.甘草组织培养快速繁殖技术研究[J].中国草地,1999(1):12-14.
[11] 谢绍萍,欧阳学智,洪维廉,等.甜菊愈伤组织生长、分化与甜菊苷积累的关系[J].热带亚热带植物学报,1998,6(1):4-8.

