VEGF-C和VEGFR-3在鼻咽癌组织中的表达及其意义
骆梅青 李锡清
鼻咽癌是我国常见的恶性肿瘤之一,早期即可发生淋巴道转移。血管内皮生长因子C(vascular endothelial growth factor C,VEGF-C)和血管内皮生长因子受体 3(vascular endothelial growth factor receptor3,VEGFR-3)[1]是与淋巴管生成及肿瘤淋巴道转移有关的因子。本实验通过对61例鼻咽癌的 VEGF-C和VEGFR-3进行免疫组织化学染色,观察两者在人鼻咽癌组织中的表达及其在淋巴道转移中的作用,以探讨鼻咽癌的淋巴道转移机制。
1 材料与方法
1.1 标本来源
所有组织标本均取自我院病理科2003年6月至2006年6月鼻咽镜下活检的鼻咽癌标本61例。所有标本活检后均经生理盐水冲洗,多聚甲醛固定,常规石蜡包埋,制成4μm厚连续切片。所有标本结果均经过常规病理检查确诊。
1.2 实验试剂
兔抗人VEGF-C多克隆抗体、兔抗人VEGFR-3多克隆抗体和兔抗人D2-40单克隆抗体均购自武汉博士德生物工程有限公司,PV-9000二步法免疫组织化学试剂盒购自北京中杉生物技术有限公司。
1.3 组织化学染色方法
免疫组织化学染色方法均参照 PV-9000二步法试剂盒的说明书进行,4μm连续切片、脱蜡入水,3%甲醇过氧化氢阻断内源性过氧化物酶,滴加鼠抗人单克隆抗体 D2-40及兔抗人 VEGF-C 及 VEGFR-3多克隆抗体,4℃冰箱孵育盒内过夜。滴加聚合物辅助剂,37℃温箱孵育30 min,滴加辣根酶标记羊抗兔/小鼠IgG多聚体,37℃温箱孵育40 min,各步骤间均以PBS冲洗3次。DAB显色,蒸馏水及时终止。苏木精复染,脱水,中性树胶封片,光镜下观察。每次实验均以PBS代替一抗做阴性对照。
1.4 结果判定
免疫组化结果判定:VEGF-C、VEGFR-3阳性反应均为棕黄色颗粒,定位于细胞质和细胞膜。按细胞阳性着色程度,分弱阳性(+)为1分,中等阳性(++)为2分,强阳性(+++)为3分;依据阳性细胞数量分为弱阳性(+,阳性细胞数<25%)为1分,中等阳性(++,指阳性细胞数在25% ~49%)为2分,强阳性(+++,指阳性细胞数在50%以上)为3分。计算方法为两者相乘,<3分为阴性,3~6分为阳性,>6分为强阳性。HPF至少随机观察5~10个,取其平均值。微淋巴管计数方法参照 Weidner[2]计数标准,在低倍镜下,选取肿瘤淋巴管最丰富的区域,然后在200倍视野范围计算3个视野的微淋巴管的数目,取其平均值(均数±标准差)作为LVD。
1.5 统计学方法
采用SPSS13.0统计软件对所得数据进行统计学处理。统计方法采用χ2检验和Spearman相关分析。
2 结果
2.1 VEGF-C、VEGFR-3 免疫组化染色结果
VEGF-C主要表达于癌细胞的胞质,在肿瘤组织的间质中可见少量表达,另外在癌组织的血管和淋巴管内皮内也可见VEGF-C的阳性表达。
VEGFR-3主要表达于由单层内皮细胞构成、管壁较薄、外周无周细胞、无平滑肌的脉管,管腔内无红细胞,有的管腔内可见絮状物。少数阳性表达的脉管管壁较厚,可见肌层。另外在正常黏膜的间质内也可见少量表达。VEGFR-3标记的微淋巴管主要存在于鼻咽癌癌周间质和边缘组织中,而肿瘤内部一般较少微淋巴管,鼻咽癌组LVD明显高于鼻咽正常组。
2.2 鼻咽癌组织中的LVD
癌组织周边区淋巴管较为密集,而在肿瘤内部,淋巴管主要分布于黏膜下层内,淋巴管较为稀疏。61例鼻咽癌组织LVD均值为(8.12+2.44),肿瘤内部LVD均值为(6.32+1.62),肿瘤边缘区 LVD(10.40+3.06)明显高于肿瘤内部的 LVD,P <0.05。
2.3 VEGF-C、VEGFR-3 表达与 LVD 的关系
VEGF-C、VEGFR-3 的表达情况与 LVD 的表达存在相关性,VEGF-C或 VEGFR-3阳性,则 LVD的值较大,且经统计有显著性差异,见表1。
表1 VEGF-C、VEGFR-3表达和LVD的关系±s)
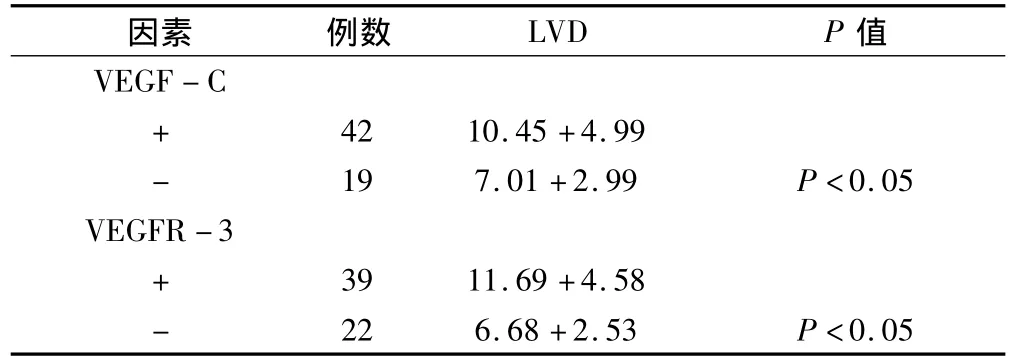
表1 VEGF-C、VEGFR-3表达和LVD的关系±s)
因素 例数 LVD P值VEGF-C+42 10.45+4.99-19 7.01+2.99 P <0.05 VEGFR-3+39 11.69+4.58-22 6.68+2.53 P<0.05
2.4 VEGF-C表达与临床病理参数的关系
VEGF-C的表达率与淋巴结转移有关,而与年龄、性别、T分期无关,见表2。

表2 VEGF-C表达与鼻咽癌临床病理参数的关系
3 讨论
3.1 鼻咽癌组织中VEGF-C和VEGFR-3的表达
血管内皮生长因子(VEGF)家族在最近几年的肿瘤血管和淋巴管研究中日益受到重视。其中 VEGF-C被认为是与癌的淋巴道转移有关的因子。VEGF-C的受体包括 VEGFR-2和 VEGFR-3。此前的研究表明,VEGF-C通过与VEGFR-2结合促进血管的生成,通过与 VEGFR-3 的结合促进淋巴管的生成[3~5]。VEGF-C在人体的多种组织中都有表达。李慧文等[6]对VEGFC和其受体VEGFR-3在舌癌组织中的表达以及与淋巴结的转移的关系方面进行了研究,结果证明VEGF-C在舌癌组织中的表达明显增高,与癌的淋巴道转移呈正相关,并且 VEGFR-3和VEGF-C的表达显著相关。杨艳等[7]报道VEGF、VEGF-C 表达与喉鳞癌淋巴结转移有关,而与患者年龄、性别、病变部位、T分期、病理分级无关,但对于VEGFR-3的表达未做研究。本实验对61例鼻咽癌组织进行了免疫组化染色,结果显示VEGF-C在鼻咽癌周边组织中的表达明显高于肿瘤组织内。VEGFR-3的免疫组化染色结果显示,VEGFR-3广泛表达于多种组织,但主要表达于淋巴管。国内相关研究的报道,证实VEGFR-3在口腔头颈肿瘤有表达,且这种表达与肿瘤的淋巴道转移以及预后有关[8]。本实验的研究显示,随着癌的发生以及癌的进展,VEGF-C和VEGFR-3的表达均逐渐增高,它们有可能共同对癌的侵袭和转移起到了促进作用。
3.2 鼻咽癌组织中的LVD
自从Folkman在1970年首次提出肿瘤生长的血管依赖性假说以来,癌的血道转移一直是肿瘤研究的热点问题[9],而在最近几年癌的淋巴道转移问题越来越受到人们的重视,但关于淋巴道转移的机制目前仍不清楚,特别是关于癌组织中淋巴管的数量、密度是否增加,是否存在淋巴管的新生等问题仍存在较大争议。
本实验通过对61例鼻咽癌的研究发现,在鼻咽癌周边组织中LVD明显高于肿瘤组织内,并且淋巴管密度的增加与VEGF-C的增加显著相关。分析VEGF-C和LVD与鼻咽癌病理参数之间的联系也发现,LVD与淋巴结转移相关,VEGF-C的表达与癌组织中的LVD显著相关,但VEGF-C的表达以及LVD均与患者的年龄、性别、T分期无关。这说明在癌组织中VEGF-C的增高是促进LVD增高的重要条件之一,而LVD的增高无疑将有利于癌的侵袭和转移。VEGF-C的这种作用可能是通过其受体 VEGFR-3来实现的,癌组织中VEGFR-3的表达也增高,这使得 VEGF-C的作用得到了更加充分的发挥。由癌细胞产生大量的VEGF-C与肿瘤周围间质内或存在于原有淋巴管内皮细胞上的VEGFR-3结合,诱导 VEGFR-3酪氨酸激酶磷酸化,进而促进了内皮细胞的增殖和迁移,使新的淋巴管生成以及原有淋巴管的分支和出芽,造成了淋巴管数量和密度的增加,使得癌细胞有更多的途径沿这些淋巴管向外播散和转移,这可能是癌细胞沿淋巴道转移的机制之一。
通过本实验的研究,我们认为癌组织中的淋巴管将有可能作为临床进行肿瘤治疗的靶点,这将可能为肿瘤的抗转移治疗提供新的方向。
[1] Kukk E,Lymboussaki A,Taira S,et al.VEGF-C receptor binding and pattern of expression with VEGFR-3 suggests a role in lymphatic vascular development〔J〕.Development,2006,122(12):3829.
[2] Weidner N,Folkman J,Pozza F,et al.Tumor angiogenesis:a new significant and independent prognostic indicator in early-stage breast carcinoma〔J〕.JNatl Cancer Inst,1992,84(24):1875.
[3] 张贺龙,王文亮.肿瘤淋巴管形成与肿瘤转移关系的研究进展〔J〕.临床与实验病理学杂志,2002,18(4):419.
[4] He Y,Kozaki K,Karpanen T,et al.Suppression of tumor lymphangiogenesis and lymph node metastasis by blocking vascular endothelial growth factor receptor 3 signaling〔J〕.J Natl Cancer Inst,2006,94(11):819.
[5] Taniguchi K,Kohno R,Ayada T,et al.Spreads are essential for embryonic lymphangiogenesis by regulating vascular endothelial growth factor receptor 3 signaling〔J〕.Mol Cell Biol,2007,27(12):4541.
[6] 李慧文,张秀清.VEGF-C和 VEGFR-3在舌癌组织中的表达及其和肿瘤淋巴转移的关系〔J〕.现代口腔医学杂志,2004,18(5):412.
[7] 杨 艳,葛荣明.VEGF和VEGF-C在喉癌中的表达及临床意义〔J〕.临床耳鼻咽喉科杂志,2006,16(12):650.
[8] 曲行舟,王丽珍,胡永杰,等.VEGFR-3在不同临床分期舌癌癌周淋巴管中的表达〔J〕.口腔颌面外科杂志,2007,17(2):123.
[9] Karpanen T,Wirzenius M,Mäkinen T,etal.Lymphangiogenic growth factor responsiveness is modulated by postnatal lymphatic vessel maturation〔J〕.Am J Pathol,2006,169(2):708.

