内皮素受体A在不同毛色羊驼皮肤中的分布
穆晓丽,孙乐天,耿建军,张 杰
(1.山西农业大学动物科技学院,山西太谷030801;2.太原动物园兽医院,山西太原030009)
羊驼(alpaca)作为一种毛用型特种经济动物,毛色是该物种最主要的经济性状[1]。内皮素(endothelin,ET)是 1988 年 Yanagisawa等[2]从猪主动脉内皮细胞培养液中分离到的一种血管活性多肽,是目前所知体内最强的缩血管物质。研究表明,动物体内有3种内皮素基因,分别编码3种ET异构肽:ET-1,ET-2和ET-3。哺乳动物体内的内皮素受体(Endothelin receptor)有 A,B这2种类型,均属于G蛋白偶联受体。其中,内皮素受体A(EDNRA)对ET-1,ET-2亲和力强,而受体 B(EDNRB)对 ET-1,ET-2,ET-3 的亲和力相同[3]。研究不同毛色羊驼皮肤中EDNRA的表达对羊驼毛色形成的影响,有助于深入了解内皮素系统参与毛色形成的机理。
本研究拟从蛋白水平探讨不同毛色中ED-NRA的表达差异,为研究EDNRA对羊驼皮肤黑色素生成及毛色形成的影响奠定理论基础。
1 材料和方法
1.1 实验样本
选用毛色为白色和棕色的3岁雄性羊驼各3只(由山西农业大学羊驼养殖基地提供),取每只羊驼体侧皮肤,剃毛刮净后再用取皮器取直径8mm羊驼皮肤组织各1块,放置于4%的中性甲醛溶液中固定,以进行免疫组织化学研究。
1.2 实验试剂、耗材及仪器
实验试剂为无水乙醇、二甲苯、苦味酸、甲醛、冰醋酸、APES黏片剂、0.01mol/LPBS缓冲液(pH 7.2~7.4)、丙酮、苏木精、伊红、中性树胶、EDNRA多克隆兔抗人一抗(Boster,武汉)、单克隆小鼠抗兔二抗SABC试剂盒、DAB显色液、5%BSA封闭液(Boster,武汉)等。
实验用耗材有石蜡块、载玻片、盖玻片、取皮器、纱布、切片刀等。
实验用仪器包括KD-BM生物组织包埋机、YD-335电脑切片机(浙江金华益迪医疗设备厂)、YD-A生物组织摊片机(浙江金华益迪医疗设备厂)、HPP-9160电热恒温培养箱、HH-6数显恒温水浴锅、DMLB型显微镜(LeiCa,德国)等。
1.3 实验方法
(1)将皮肤组织固定于Bouin氏固定液(饱和苦味酸水溶液75mL,40%甲醛25mL,冰醋酸5mL),固定24 h后,于70%酒精中充分冲洗。(2)组织块浸入80%酒精2 h→85%酒精2 h→90%酒精1 h→95%酒精Ⅰ1 h→95%酒精Ⅱ1 h→无水酒精Ⅰ45min→无水酒精Ⅱ45min→无水酒精∶二甲苯(体积比为1∶1)20min→二甲苯Ⅰ30min→二甲苯Ⅱ30min→二甲苯Ⅲ30min;经二甲苯透明后浸蜡2.5 h,包埋(脱水透明及包埋在 4℃进行为宜)。(3)厚度 4~5μm,54~55℃摊片机展片,50℃烘片1 h。(4)二甲苯Ⅰ15min→二甲苯Ⅱ15min→无水酒精Ⅰ5min→无水酒精Ⅱ3min→95%酒精Ⅰ3min→95%酒精Ⅱ3min→90%酒精3 min→80%酒精2 min→70%酒精2 min→50%酒精2min→PBS缓冲液3min→3%双氧水10min→PBS缓冲液5min,重复3次。(5)滴加5%BSA封闭液,37℃反应30min,甩去多余液体,不洗。(6)滴加一抗工作液(1∶100),将切片置于湿盒,4℃反应过夜后继续在37℃反应 1 h。(7)PBS洗 20min,重复 2 次,滴加二抗IgG,37℃反应 30min。(8)PBS洗 5min,重复 3次,滴加 SABC,37 ℃ 30min,PBS洗 5min,重复3次。(9)取1mL蒸馏水,加入试剂盒中A,B,C试剂各1滴,混匀后加至切片。室温显色,镜下控制反应时间,蒸馏水洗涤。(10)Mayor苏木精复染,返蓝,脱水,中性树脂封片。(11)用PBS替代一抗作为阴性对照,用已知阳性切片作为阳性对照。染色阳性为细胞质中存在棕黄色颗粒。
1.4 图像分析及统计学方法
光镜下观察切片并采集图片,将图像输入Image-Pro Plus6.0软件中,对EDNRA在棕色和白色皮肤组织中的免疫组织化学结果进行光密度测定,每个样本取5张切片,每张切片取5个视野,得到阳性细胞的平均光密度值。
将所得数据用SPSS 13.0软件进行分析,数据符合正态分布。不同样本的细胞中光密度(OpticalDensity,OD)用One-way ANOVA单因素方差分析差异显著,经同质性检验不显著,用多重比较LSD检验进行两两比较,分析结果用平均值±标准误差表示。
2 结果与分析
2.1 免疫组织化学结果
观察免疫组织化学切片可见,内皮素受体A在白毛组和棕毛组中均有表达,且二者在2个对照组切片里的皮肤毛乳头细胞、毛根鞘细胞及表皮细胞层中均存在棕黄色阳性颗粒(图1)。
2.2 图像分析及统计结果
EDNRA在棕色毛和白色毛羊驼皮肤组织中的免疫组织化学结果经图像分析并进行统计学处理后显示,所测数据均呈正态分布。软件分析光密度值结果(表1)显示,EDNRA只在毛根鞘处的表达差异显著(P<0.05)。

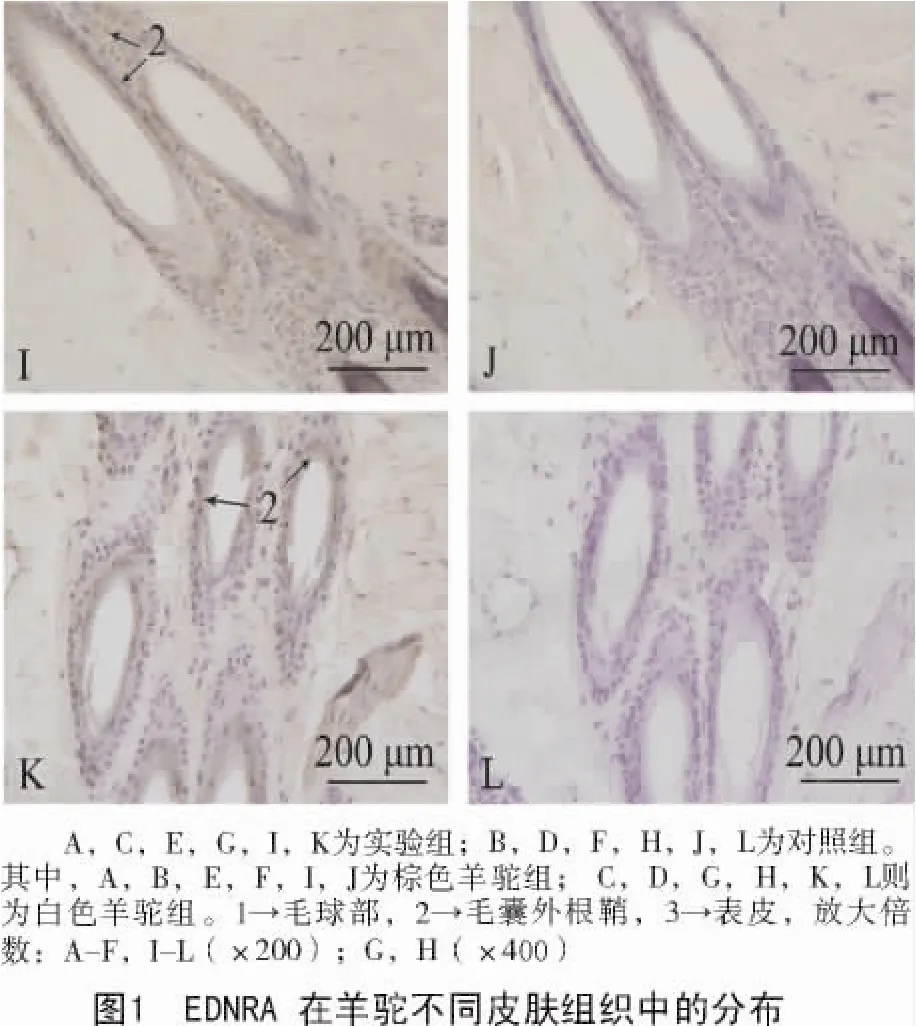

表1 EDNRA阳性表达组织的平均光密度(n=3)
3 讨论
在胚胎发育过程中,黑素细胞(Melanocyte,Mc)的发育依次经历3个阶段,即神经嵴细胞、黑素母细胞和黑素细胞。黑素细胞从神经嵴沿躯干侧向迁移,而其他神经嵴细胞则沿着躯干腹侧部迁移,其定向分化与MITF,FGF-2,内皮素以及诸多因子的作用相关[4-5]。内皮素在黑素细胞的生长过程中有2个方面的重要作用,即调节黑素细胞前体的数量并刺激黑素细胞前体向成熟黑素细胞分化[6]。在小鼠上,内皮素可刺激其神经嵴细胞表达早期的黑素母细胞的标记物——多巴色素互变异构酶,从而导致黑素母细胞的增殖和黑素生成[7]。当小鼠ET-1或者EDNRA缺乏时,均表现为头和心脏的神经嵴细胞亚型的缺乏[8-9]。
有研究表明,EDNRA受体主要存在于心脏、主动脉和脑血管的平滑肌细胞(VSMC)中,发挥缩血管、促进细胞增殖和组织纤维化等作用[10];在多种癌变组织中,EDNRA受体在原发肿瘤和转移灶中表达增加,提示EDNRA受体与这些肿瘤的生长和转移关系更为密切[11]。在本研究中,通过免疫组织化学实验研究发现,内皮素受体A在不同毛色皮肤中的毛乳头细胞、毛根鞘细胞以及表皮细胞中均有分布;但是受体A仅在棕毛组皮肤的毛根鞘处有较高量的表达,其他部位的表达状况与白毛组皮肤无异,这可能与该受体在正常动物体内的主要分布状况有关。
实验结果提示,EDNRA与羊驼毛色形成过程中黑素细胞的生成相关,但其在羊驼毛色形成调控过程中的作用还有待于进一步的研究。
[1] 刘一飞,范瑞文,董常生.羊驼皮肤KAP3.2基因3′端序列的cDNA克隆机序列分析 [J].山西农业科学,2010,38(7):108-111.
[2] Yanagisawa M,Kurihara H,Kimura S,et al.A novel potent vasoconstrictor peptide produced by vascular endothelial cells[J].Nature,1988,332:411-415.
[3] Williams D L Jr,Jones K L,Colton CD,etal.Identification of high affinity endothelin-1 recep tor subtypes in human tissies[J].Biochemical and Biophysical Research Communications,1991,180(2):475-480.
[4] Dupin E,Douarin NM Le.Developmentofmelanocyte precursors from the vertebrate neural crest[J].Oncogene,2003,22:3016-3023.
[5] Goding CR.Melanocytes:TheNew Black[J].Int JBiochem Cell Biol,2007,39(2):275.
[6] Reid K,Turnley AM,MaxwellGD,etal.Multiple roles for endothelin in melanocyte development:regulation of progenitor number and stimulation of differentiation[J].Development,1996,122:3911-3919.
[7] Lee JM,Shin M K.The endothelin receptor B is required for the migration of neural crest-derived melanocyte and enteric neuron precursors[J].Dev Biol,2003,259:162-175.
[8] Clouthier D E,Hosoda K,Richardson JA,et al.Cranial and cardiac neural crestdefects in endothelin-A receptor-deficient mice[J].Development,1998,125:813-824.
[9] Kurihara Y,Kurihara H,Oda H,et al.Aortic arch malformationsand ventricular septaldefectinmice deficientin endothelin-1[J].JClin Invest,1995,96:293-300.
[10] Honore JC,Fecteau M H,Brochu I,etal.Concomitantantagonism ofendothelialand vascularsmoothmusclecell-EDNRB receptors for endothelin induces hypertension in the hamster[J].American Journal of Physiology Heart and Circulatory Physiology,2005,289(3):1258-1264.
[11] Cohen A J,Gilman LB,Miller Y E,etal.Endothelin receptor expression in lung cancer cell lines and bronchial epithelial cell lines[J].FASEBJ,1997,11:3221.

