转Bt基因棉根系水浸液和分泌物化感效应
张美俊,杨武德
(山西农业大学农学院,山西太谷 030801)
植物的化感效应,是指植物通过向环境释放化学物质而产生对其他植物体或微生物等有益或有害的作用[1]。转基因作物的获得需经过较长时间的组织培养、再生过程以及选择基因试剂的筛选诱变,这样势必增加体细胞的无性系变异,同时TDNA的插入和插入位点的不同都会影响受体基因的活性和表达[2~4],导致作物内部生理生化代谢过程和表型的变化以及进而可能引起根系分泌物化学组成发生转变[5]。Escher等[6]研究发现,与相应非转基因亲本相比,转Bt基因玉米叶片的C/N和木质素含量下降,可溶性碳水化合物含量上升。聂呈荣[7]研究表明无论是幼苗期还是抽雄期,转Bt基因玉米根系分泌物中草酸和酒石酸的分泌量都比非转基因亲本显著减少,并且这种减少现象总是与其苹果酸分泌量的增加联系在一起。这些差异可能影响转Bt基因作物残体的腐解,如影响根茬在土壤中的腐解率和腐解物质的释放,也可能直接通过根系分泌物数量和组成的改变而影响与其间混套作作物甚至后茬作物的生长发育。
目前关于转Bt基因棉根系水浸液和根系分泌物化感效应的研究甚少,为此本研究采用根系水浸液和根系分泌物溶液培养试验,力图在排除土壤和微生物干扰条件下进行模拟研究转Bt基因棉对不同作物幼苗和苗期生长生理的化感效应,以期为制定合理的转Bt基因棉间混套轮作等耕作制度提供理论和实践依据。
1 材料与方法
1.1 供试材料
试验用转 Bt基因棉为“Bt冀668”,对照为常规棉“冀668”,“Bt冀668”是通过农杆菌介导技术将Bt基因(Cry1Ac)导入“冀668”而选育的转Bt基因棉品系。受体作物为常规棉“冀668”、绿豆“中绿1号”。
1.2 试验设计与方法
1.2.1 转Bt基因棉根系水浸液对受体作物幼苗生长的化感效应
将Bt冀668和冀668收获期的根系洗净、晾干,分别切成1 cm长的小段作为供试材料。称取40 g根段放入烧杯中,添加400 mL蒸馏水,恒温28℃置摇床上浸提48 h,过滤2次,即得到质量浓度为0.1 g◦mL-1的转Bt基因棉和常规棉根系水浸液。稀释为处理质量浓度 0.025、0.050、0.100 g◦mL-1,备用。
将硫酸脱绒后的冀668棉花种子和中绿1号种子用70%的酒精消毒5 min,用无菌水清洗3次,5%的双氧水浸泡2 h,再在30℃水中继续浸泡8 h。在铺有两层滤纸的直径为10 cm培养皿中,分别加入获得的Bt冀668和冀668根系水浸液7 mL。在滤纸上均匀播上处理过的冀668棉花种子和中绿1号种子。冀668种子每皿各20粒,中绿1号种子每皿40粒,每个处理5次重复,共20个培养皿。置于光照培养箱中27℃培养。每天补充水浸液2 mL,并更换滤纸。1周后测量苗长、根长、苗鲜重和根鲜重。
1.2.2 转Bt基因棉根系分泌物对受体作物苗期生长生理的化感效应
将Bt冀668和冀668棉花种子以及中绿1号种子用70%的酒精消毒5 min,用无菌水清洗3次,5%的双氧水浸泡2 h,再在30℃水中继续浸泡12 h后,播于CaSO4溶液浸泡过的石英砂小杯中,在室内光照充足处蒸馏水培养,当幼苗长出真叶时,小心取出生长一致的幼苗,用去离子水洗去石英砂,用脱脂棉固定在事先打有定植孔的泡沫塑料板上,置于1/2 Hoagland营养液中进行水培试验。水培容器采用30 cm×40 cm×40 cm长方体聚乙烯塑料盆,每盆装培养液6 L。水培试验设Bt冀668与冀668共培养(BtJi668-Ji668),对照为冀668与冀668共培养(Ji668-Ji668);Bt冀668与中绿1号共培养(BtJi668-Zhonglv 1),对照为冀668与中绿1号共培养(Ji668-Zhonglv 1)4种处理。每处理重复5次。每一水培盆定植2种作物各2株,定时通气,每周更换一次营养液,1周后换成完全营养液。室温20~25℃大棚内培养。培养30 d时取样调查冀668和中绿1号株高、根长、地上部鲜重和根鲜重以及根系活力、根系保护酶活性和MDA含量。
1.3 调查项目和测定方法
苗高、根长直尺法。鲜重用电子天平。根系活力用T TC法[8]。根系POD活性用愈创木酚比色法[9],SOD活性用核黄素法[9],MDA含量用硫代巴比妥酸法[9]。
2 结果与分析
2.1 转Bt基因棉根系水浸液对常规棉和绿豆幼苗生长的影响
由表1可以看出,与常规棉根系同浓度水浸液相比,转Bt基因棉根系水浸液对常规棉幼苗苗长、苗鲜重、根长、根鲜重均无显著影响。且转Bt基因棉不同浓度水浸液处理的常规棉幼苗苗长、苗鲜重、根长、根鲜重间均无显著差异,这表明在所测试的浓度范围内,转Bt基因棉根系水浸液不会对常规棉幼苗生长产生显著改变。
由表1还可以看出,转Bt基因棉根系水浸液对绿豆生长的影响与对常规棉的影响有所不同,表现为与常规棉根系同浓度水浸液相比,转Bt基因棉根系水浸液对绿豆幼苗苗长、苗鲜重无显著影响。在0.025和0.050 g◦mL-1浓度下,对绿豆根长和根鲜种也无显著影响,但在0.100 g◦mL-1浓度下,显著降低了绿豆根长和根鲜重,降低幅度分别为27.23%和27.27%,且同一转 Bt基因棉处理下,0.100 g◦mL-1浓度处理与0.025和0.050 g◦mL-1浓度处理绿豆苗鲜重、根长和根鲜重也有差异,表现0.100 g◦mL-1浓度处理显著降低了绿豆苗鲜重、根长和根鲜重,如与0.025 g◦mL-1浓度相比,0.100 g◦mL-1浓度处理显著降低,降幅分别为16.96%、28.09%和28.89%,以上分析结果表明,转Bt基因棉高浓度根系水浸液对绿豆幼苗生长有抑制作用,且对地下部生长影响大于地上部。
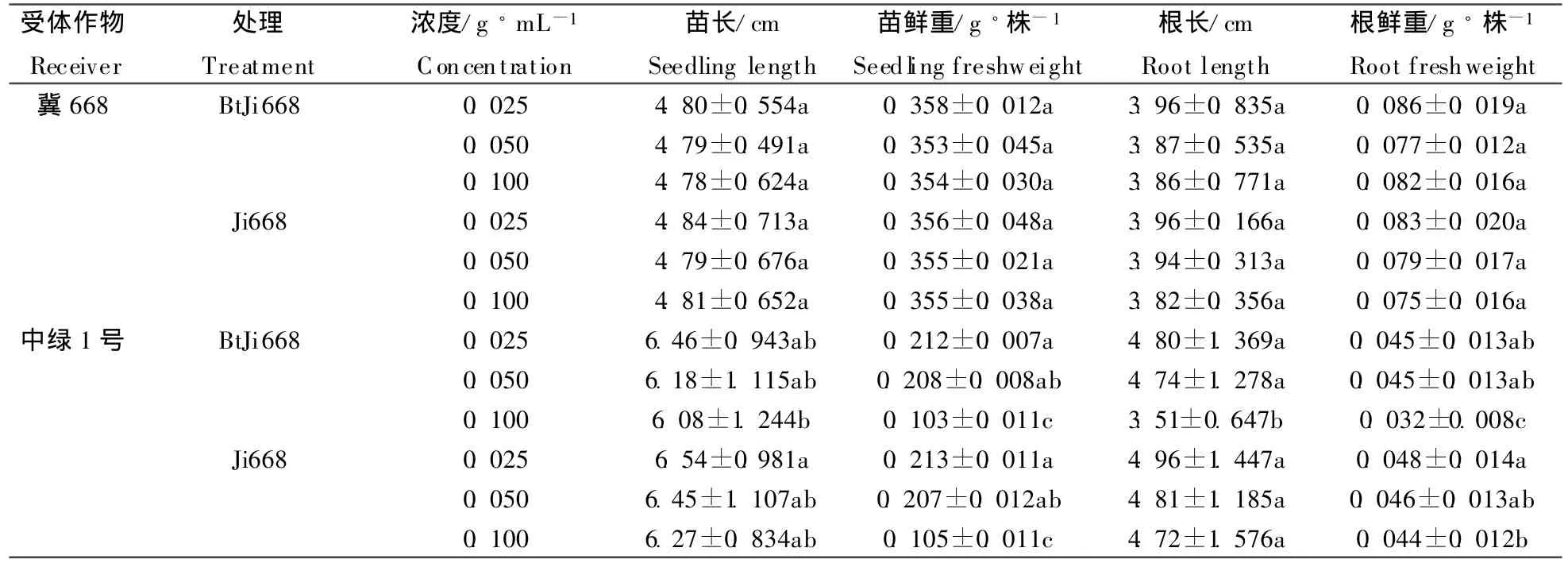
表1 转Bt基因棉根系水浸液对常规棉和绿豆幼苗生长的影响(M±SD)Table 1 Effect of transgenic Bt cotton root aqueous extracts on seedling growth of receiver crops
2.2 转Bt基因棉根系分泌物对常规棉和绿豆生长的影响
由表2可看出,水培30 d后,与常规棉处理相比,转Bt基因棉根系分泌物处理对常规棉和绿豆株高和地上部鲜重无明显改变,但显著提高了常规棉根长,提高幅度为21.30%,显著降低了绿豆根长,降低幅度为18.07%,同时转Bt基因棉根系分泌物处理还显著降低了绿豆地下部鲜重,降低幅度为31.11%。
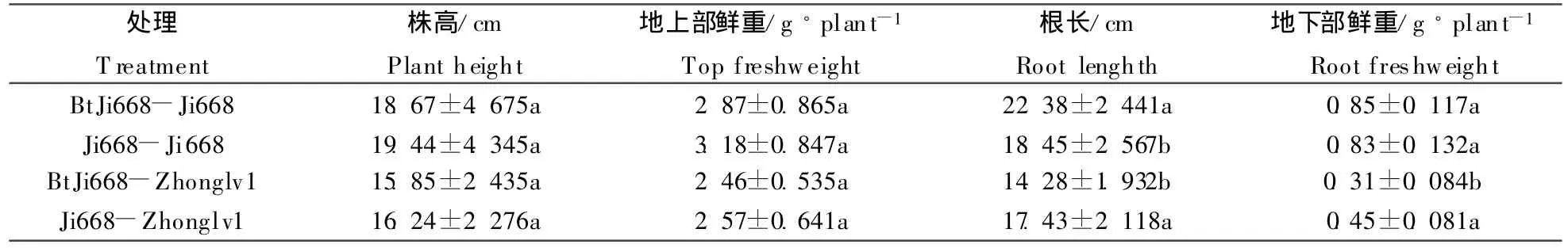
表2 转Bt基因棉根系分泌物对常规棉和绿豆生长的影响(M±SD)Table 2 Effect transgenic Bt cotton root exudates on plant growth of receiver crops
2.3 转Bt基因棉根系分泌物对常规棉和绿豆根系活力的影响
根系活力是指根系新陈代谢活动的强弱,是反映根系发育吸收功能的一项综合指标,根系活力受到抑制,作物根系生长缓慢,对养分吸收能力降低,生长发育就会受阻[10]。从图1看出,与常规棉处理相比,转Bt基因棉根系分泌物处理显著提高了常规棉根系活力,提高幅度为28.48%,但显著降低了绿豆根系活力,降低幅度为15.14%,这说明转Bt基因棉根系分泌物对不同作物根系活力影响不同。
2.4 转Bt基因棉根系分泌物对常规棉和绿豆根系SOD、POD活性和MDA含量的影响
SOD(超氧化物歧化酶)和POD(过氧化物酶)均为细胞膜脂过氧化作用中氧自由基清除酶系统中的关键酶,其作用是催化细胞膜脂过氧化作用中产生的超氧阴离子自由基,使之发生歧化反应,从而解除或减轻膜脂过氧化作用对细胞膜的损伤,其活性的高低是植物抗逆性强弱的重要指标。MDA(丙二醛)是生物系统内膜脂过氧化产物之一,反映植株体内膜脂过氧化的程度,MDA能强烈地与细胞内各种成分发生反应,因而引起酶和膜的严重损伤,膜电阻及膜的流动性降低,最后导致结构及生理完整性的破坏,MDA的增加对膜有毒害作用[10,11]。
由图2可见,与常规棉处理相比,转Bt基因棉处理共培养的常规棉根系SOD和POD活性以及MDA含量均有一定提高,但分析表明差异均没有达显著水平。说明转Bt基因根系分泌物对与其共培养的常规棉根系保护酶活性和MDA含量没有产生显著影响。
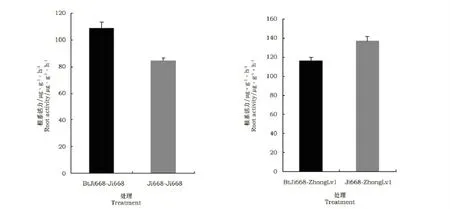
图1 转Bt基因棉根系分泌物对常规棉和绿豆根系活力影响Fig.1 Effect transgenic Bt cotton root exudates on root activity of receiver crops
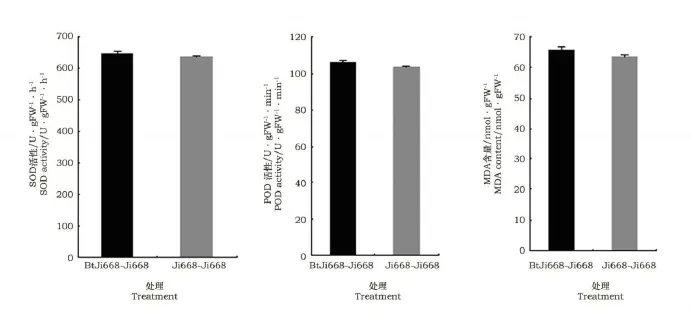
图2 转Bt基因棉根系分泌物对常规棉根系SOD,POD活力和MDA含量影响Fig.2 Effect transgenic Bt cotton root exudates on root SOD,POD activity and MDA content of general cotton
由图3可见,与常规棉处理相比,与转Bt基因棉共培养的绿豆根系SOD和POD活性以及MDA含量均显著地增加,提高的幅度分别为31.16%、17.49%、30.58%。SOD和POD活性的增加可以看作是绿豆根系对转Bt基因棉根系分泌物的一种应激表现,转Bt基因棉根系分泌物激活了SOD和POD活性,但最终MDA含量的增加,暗示与转Bt基因棉共培养的绿豆根系膜透性和膜结构受到了伤害。
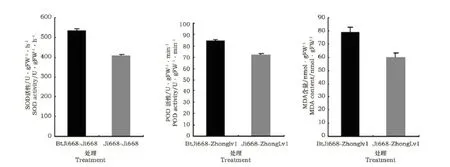
图3 转Bt基因棉根系分泌物对绿豆根系SOD,POD活力和MDA含量的影响Fig.3 Effect transgenic Bt cotton root exudates on root SOD,POD activity and MDA content of mung bean
3 结论与讨论
转Bt基因棉根系水浸液和根系分泌物对不同作物的化感效应不同,对常规棉幼苗和苗期生长生理表现无影响或促进作用,而对绿豆幼苗和苗期地下部生长生理却有抑制作用,随转Bt基因棉的长期种植,根茬腐解物和根系分泌物会不断积累,对其它作物生长生理的影响还需进一步深入研究。
本试验只是研究了转Bt基因棉根系水浸液和根系分泌物对常规棉和绿豆幼苗和苗期生长生理的影响,转Bt基因棉根系可表达Bt蛋白[12],根系也可分泌Bt蛋白,因此造成的影响是由于根系和根系分泌物中Bt蛋白引起的,还是转Bt基因棉根系生理生化特性以及根系分泌物组分发生变化引起的,亦或是二者互作效应的结果,也是今后研究工作的一项重点,这对明确和协调转Bt基因作物与环境之间的关系具有重要的理论和现实意义。
[1]Rice E L.Allelopathy(2nd ed)[M].New York:Academic Press Inc,1984:309-315.
[2]Stelly D M,Altman D W,Kohel R J,et al.Cytogenetic abnormalities of cotton somaclones from callus culture[J].Genome,1989(32):762-770.
[3]Altman D W,Benedict J H,Sachs E S,et al.Quantitative trait variation in phinotypically normal regenerants of cotton[J].In Vitro cell Dev Biol,1991(27):132-138.
[4]Zhang S,Warkentin D,Sun B,et al.Variation in the inheritance of expression among subclones for unselected and selected transgenes in maize(Zea mays L.)[J].Theor Appl Genet,1996,92:752-761.
[5]Devare M H,Jones C M,Thies J E.Effect of Cry3 Bt transgenic corn and thfluthrin on the soil Microbial community:Biomass,activity,and diversity[J].Environ Qual,2004,33:837-843.
[6]Escher N,Kach B,Nenting W.Decomposition of transgenic Bacillus thuringiensis maize by microorganisms and woodlice procellio scaber(Crustacea:Isopoda)[J].Basic Appl Ecol,2000(1):161-169.
[7]聂呈荣.转Bt基因玉米的生理生态特征变化研究[D].广东:华南农业大学,2003:89.
[8]阮维斌,刘默涵,黄斌,等.两种羟基苯乙酸对大豆萌发的化感效应研究[J].应用生态学报,2003,14(5):785-788.
[9]林植芳.水稻叶片的衰老与超氧化物歧化酶活性及脂质过氧化作用的关系[J].植物学报,1984,26(6):605-615.
[10]张永清,苗果园.高粱生育后期根系对渍水胁迫的生物学响应[J].山西农业大学学报:自然科学版,2005,25(3):193-195.
[11]孙伟,曹玉洪.转Bt基因抗虫棉Bt毒蛋白表达量的时空变化[J].安徽农业科学,2005,33(2):202-203.
[12]孙彩霞,陈利军,武志杰.Bt杀虫晶体蛋白的土壤残留及其对土壤磷酸酶活性的影响[J].土壤学报,2004,41(3):761-765.

