饲粮蛋白质来源与水平对生长猪空肠液组成的影响
胡光源 赵 峰 张宏福 钟永兴 刘震坤
(中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193)
长期以来,人们对猪饲料模拟消化方法的研究,大多以一定浓度的胰液素溶液来模拟猪小肠液,这种研究思路一方面使模拟小肠液缺乏生物学依据,另一方面也使得模拟的肠液难以标准化。因此,要实现对猪小肠液的有效模拟,首先需要了解肠道食糜所处的环境,即小肠液的组成成分。研究表明,饲粮能量来源(大麦、小麦、淀粉等)及纤维水平与组成对生长猪空肠食糜、胰腺组织的消化酶活性无显著影响[1-6]。在以家禽作为研究对象的试验中也表明饲粮能量水平对鸡、鸭肠液的组成影响较少,但饲粮蛋白质来源对肠液消化酶活性及部分离子浓度有一定的影响[7-9]。在猪的饲粮配制中,能量饲料的种类与数量相对固定,而蛋白质饲料变异较为广泛,不同饼粕类饲料的有效氨基酸组成、抗营养因子和毒素等可能对生长猪的胆汁、胰液及肠液的分泌有显著影响,从而影响小肠液的消化酶活性。为了使模拟猪肠液组成的基本参数不脱离一般生产条件下的变异范围,本试验设计了4种不同蛋白质来源与水平的饲粮,研究饲粮蛋白质来源与水平对生长猪空肠液组成的影响,为猪饲料养分生物学效价酶学评定方法中模拟肠液的设计提供参考。
1 材料与方法
1.1 试验设计及动物饲养管理
采用4×4拉丁方设计,在8头体重(22.77± 0.23)kg的杜×长×大三元杂交去势公猪体内安装空肠T型瘘管,术后按常规程序护理3周,期间饲喂基础饲粮。待试验猪恢复后,从荷术猪中挑选健康、体重(27.79±0.46)kg的4头试验猪进行试验。试验猪分期、分号分别饲喂4种试验饲粮,即玉米-豆粕型饲粮(饲粮1)、玉米-豆粕低蛋白质饲粮(饲粮2)、玉米-豆粕-棉籽粕-菜籽粕饲粮(饲粮3)和玉米-豆粕-棉籽粕-菜籽粕低蛋白质饲粮(饲粮4)。每期试验为15 d,其中预试期10 d,在试验期第11天、第13天和第15天每天的09:30、13:30和17:30采集食糜样品1 h。整个试验期间荷术猪自由饮水,每天08:00和16:00拌湿喂料,采食量控制为试验猪体重的4%。代谢室卫生管理按动物营养学国家重点实验室常规程序进行。
1.2试验饲粮
参照NRC(1998)生长猪营养需要量,将饲粮蛋白质含量设置为(20~50)kg和(51~80)kg猪蛋白质需要量的平均值,低蛋白质饲粮为该平均值的85%。预混料使用1%生长猪预混料。试验饲粮组成及营养水平见表1。
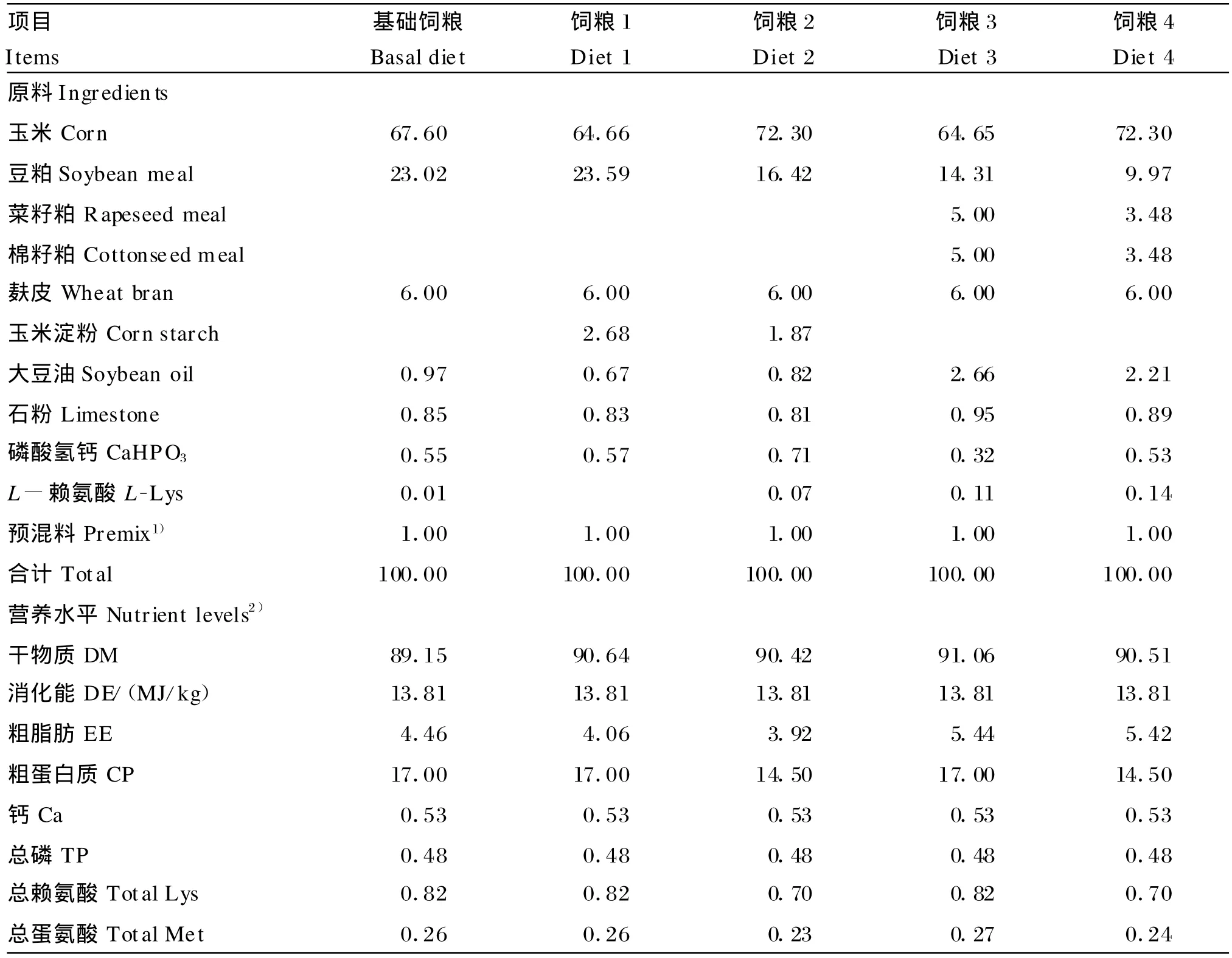
表1 试验饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels o f experimen tal diets(air-dry basis)%
1.3 空肠瘘管安装及术后护理
术前试验猪禁食24 h,期间自由饮水。手术室及手术器材消毒后,将试验猪右腹侧后半部剃毛、清洁。试验猪耳后注射麻醉剂进行全身麻醉。按瘘管安装常规操作,在腹中线上方约20 cm、最后肋骨后3~4 cm处,纵向做长6~8 cm的切口,于空肠前段(离幽门后170 cm)即空肠靠近肠系膜淋巴结末端的肠段上安装T型瘘管,并于皮肤切口距头侧约5 cm处做一切口,由此将漏管管体部引出,勿使肠管发生前后扭转,用硅胶螺母片固定瘘管管体部,按照常规进行腹腔及皮肤缝合并做消炎处理。术后将荷术猪转移至安静房间,待其完全清醒后转移至代谢笼内,禁饲禁水24 h,按常规护理程序护理并恢复3周,当试验猪恢复了正常的采食并且体况保持稳定后,开始试验期。
1.4 样品采集与制备
每期试验的第11天、第13天和第15天每天的09:30、13:30、和17:30通过有低温保鲜(0~4℃)效果的自制收集瓶,从瘘管口处采集50 m L空肠食糜样品,每次采样结束后立刻混匀取部分样品转入10 m L离心管中,4℃1 250 g离心10 min。取上清液旋涡混合后分装成8等份,储存于-70℃冰箱保存,待测酶活和离子浓度。
1.5 测定指标及方法
测定样品时,将第11天、第13天和第15天采样期样品按早、中、晚时间点于4℃冷水浴中解冻后充分混合,以缓冲液(消化酶测定)或去离子水(离子浓度测定)稀释至所需倍数。α-淀粉酶以可溶性淀粉为底物测定活性[10],淀粉酶活性单位定义为25℃、pH 6.90条件下每m in释放1μm ol麦芽糖所具有的活性;脂肪酶活性使用德国Diasys脂肪酶试剂盒测定,脂肪酶活性单位定义为37℃、pH 8.90条件下每min水解1 nm ol甘油三酯所具有的活性;胰蛋白酶活性测定以甲基叔戊基醚(TAME)为底物进行测定[11],胰蛋白酶活性单位定义为25℃、pH 8.10条件下每m in释放1μmol对-甲苯磺酞-L-精氨酸时所具有的活性。糜蛋白酶活性以N-苯甲酰-L-酪氨酰乙酯(BTEE)为底物测定,糜蛋白酶活性单位定义为在25℃、pH 7.80条件下每m in释放1μmol苯甲酞-L-酪氨酸所具有的活性。所有消化酶的活性单位均以U/m L肠液表示。吸光度用TU-1900可控温双光束紫外可见分光光度计测定。
空肠液中Na+、K+、Cl-浓度用M edica Corpo rction公司产Easyly te Plus型钠钾氯分析仪测定;Mg2+、Ca2+浓度的测定采用英国(Randox) CA 2390、MG531的检测试剂盒测定;pH用德国Sartorius PB-10酸度计在38℃水浴下测定。
1.6 统计分析
对3 d采样期早、中、晚空肠液酶活和离子浓度的均值做统计分析,为生长猪每期空肠液消化酶活性及离子浓度变异。
根据拉丁方设计,采用SAS 8.0的GLM模块进行方差分析,统计模型为:Y=μ+Ti+Pj+D k+εijkl,μ为总体均数,T为周期效应,P为猪效应,D为饲粮效应,ε为随机误差。
用Duncan氏法对均值进行多重比较;以SAS Contrast语句比较饲粮1与饲粮3间、饲粮2与饲粮4间及饲粮1+饲粮3与饲粮2+饲粮4间的差异,显著水平为P<0.05,对P<0.15的处理因素作趋势分析。
2 结 果
2.1 饲粮蛋白质来源与水平对生长猪空肠液中主要消化酶活性的影响
从4种饲粮对生长猪空肠液消化酶活性的影响(表2)可知,各饲粮组间空肠液中的胰蛋白酶、糜蛋白酶、脂肪酶、淀粉酶的活性无显著差异(P>0.05);通过SAS Contrast语句分别比较正常蛋白质水平(饲粮1对饲粮3)和低蛋白质水平(饲粮2对饲粮4)饲粮条件下,生长猪空肠液消化酶活性的差异发现,无论是正常蛋白质水平还是低蛋白质水平条件下,饲粮蛋白质来源对空肠液中的胰蛋白酶、糜蛋白酶、脂肪酶、淀粉酶的活性均无显著影响(P>0.05);通过SASContrast语句比较正常蛋白质水平(饲粮1+饲粮3)与低蛋白质水平(饲粮2+饲粮4)条件下,生长猪空肠液酶活的差异发现,饲粮低蛋白质水平有提高空肠液中的胰蛋白酶、糜蛋白酶、脂肪酶活性的趋势(P<0.15),而对淀粉酶的活性无显著影响(P>0.05)。此外,从拉丁方试验的试验期及试验猪个体间对猪空肠液消化酶活性变异的贡献看,猪的生长周期(试验期)对糜蛋白酶的活性有影响的趋势(P<0.15),试验猪个体间对淀粉酶活性上有显著差异(P<0.05)。
2.2 饲粮蛋白质来源与水平对生长猪空肠液中主要离子浓度的影响
从4种饲粮处理条件下生长猪空肠液中5种主要离子浓度及pH的差异(表3)看,饲粮因素对生长猪空肠液中5种主要离子的浓度及pH无显著影响(P>0.05);通过SAS Contrast语句分别比较正常蛋白质水平(饲粮1对饲粮3)和低蛋白质水平(饲粮2对饲粮4)条件下,生长猪空肠液中的离子浓度及pH的差异发现,无论是正常蛋白质水平还是低蛋白质水平条件下,饲粮蛋白质来源对空肠液中的5种主要离子的浓度及pH都无显著影响(P>0.05);通过SAS Contrast语句比较正常蛋白质水平(饲粮1+饲粮3)与低蛋白质水平(饲粮2+饲粮4)条件下,生长猪空肠液中离子的浓度及pH的差异发现,饲粮蛋白质水平对生长猪空肠液中5种主要离子的浓度及pH也无显著影响(P>0.05)。此外,从拉丁方试验的试验期及试验猪个体间对空肠液离子浓度变异的贡献看,猪的生长周期(试验期)对Mg2+浓度有显著的影响(P<0.05),对Na+浓度有影响趋势(P<0.15),试验猪个体间在Na+、K+、Cl-、Ca2+的浓度上有显著差异(P<0.05)。

表2 饲粮蛋白质来源与水平对生长猪空肠液消化酶活性的影响Tab le 2 Ef fects of dietary protein source and level on the digestive enzym e activities of je junal fluid in growing pigs U/m L
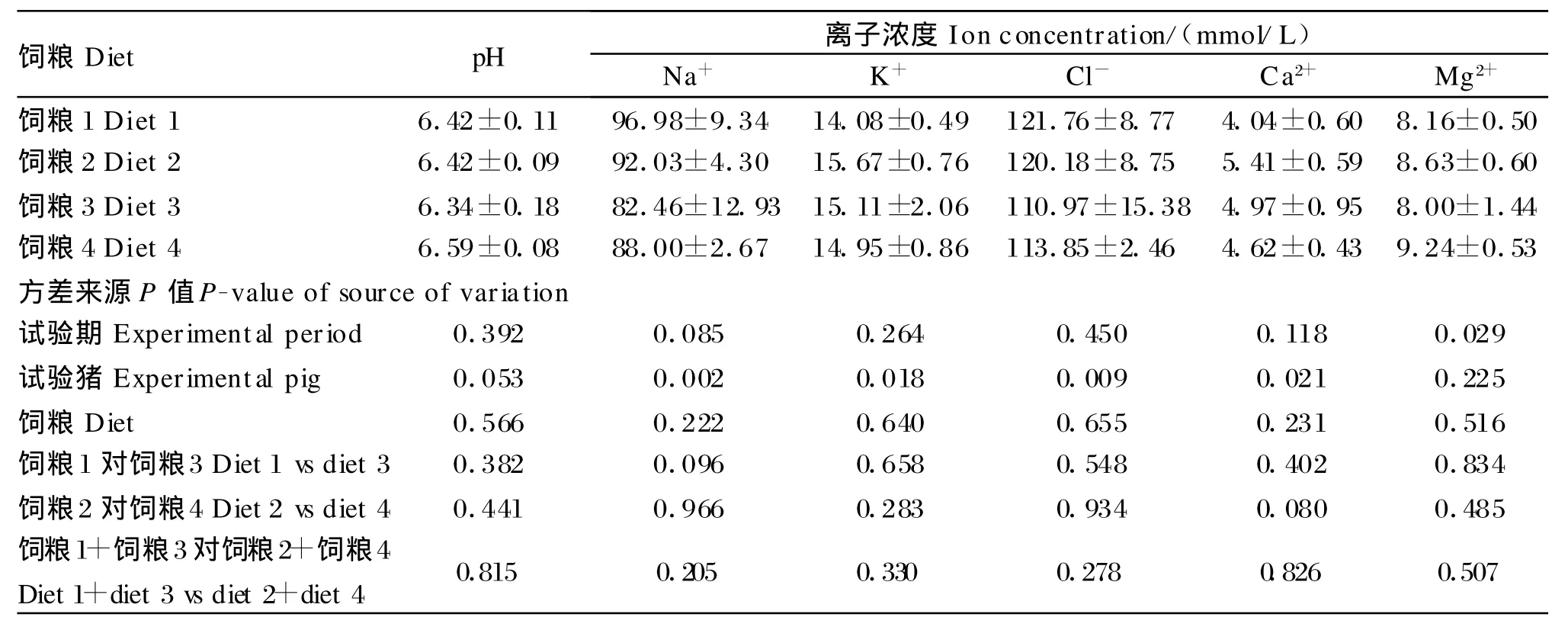
表3 饲粮蛋白质来源与水平对猪空肠液离子浓度和pH的影响Table 3 Effects o f dietary p rotein source and level on the ion concentration and pH o f jejunal fluid in grow ing pigs
3 讨 论
3.1 饲粮蛋白质来源及水平与生长猪空肠液组成的关系
胰腺与肠腺分泌的各种酶蛋白是小肠液中消化酶的主要来源。1头40 kg的生长猪1 d可分泌的消化液平均为2.51 L[6,13],足够将变异很大的饲粮完全消化[6,14]。由此可见,猪内源性消化酶相对于采食量而言是极其过量的。尽管猪肠道环境的变化(食糜、饮水等)可反馈调控消化液的分泌,但迷走神经在很大范围内可调节消化液总分泌量[15],本试验条件下,4种饲粮的能量饲料以玉米为主,蛋白质饲料分别为豆粕、棉籽粕和菜籽粕三者的组合。饲粮的蛋白质来源对生长猪空肠液4种主要消化酶活性无显著影响,这表明猪肠液中主要消化酶对饲料蛋白质的来源有较大范围的适应性,此结果与前期所报道的猪胰液与消化道酶活性对鱼粉、花生粕及酪蛋白等蛋白质来源不敏感的结果类似[1-2]。然而,本试验中,低蛋白质水平饲粮有提高猪空肠液中胰蛋白酶、糜蛋白酶和脂肪酶活性的趋势,这与前人报道中高蛋白质水平饲粮能提高猪胰腺中蛋白酶活性的结论[13]正好相反,这可能是由于在本试验中,空肠液来自空肠前段,此处肠液的组成受饮水及非饲粮来源的其他因素干扰较大,至于导致这一结果的原因仍需进一步研究。
猪肠道内电解质主要来源于胆汁、胰腺、肠腺的分泌及食糜和饮水。肠道电解质是维持机体酸碱平衡、渗透压平衡的关键因素。动物通过肾脏调节肠道电解质浓度以使电解质平衡,维持正常机体代谢[16]。本试验中,饲粮蛋白质来源与水平对生长猪空肠液中5种主要离子浓度都没有显著影响,这可能与肠道内的水和饲粮源性矿物盐能很快地被肠道吸收有关[17]。上述结果也与前人研究猪肠道离子浓度相对稳定相一致[3-4,15]。肠液pH是肠道酸碱平衡的综合反映,动物肠道通过阴阳离子交换有维持pH稳定的功能,以此保障肠道的正常消化功能[15]。本试验条件下,饲粮蛋白质来源及水平对生长猪肠道pH没有显著影响,这与肠液中存在大量的碳酸盐缓冲液有关[15],并且饲粮中养分(如蛋白质等)的降解产物也能被肠道快速有效地吸收[18-19]。因此,饲粮在肠道中的降解产物对肠液pH的影响很少,从而使得生长猪肠道能维持较稳定的pH。
3.2 其他因素与生长猪肠液组成的关系
本试验中发现猪的生长周期(试验期)对Mg2+浓度有显著影响,而且对糜蛋白酶的活性及Na+浓度有影响趋势。这表明猪在不同生长阶段其肠液的组成是有差异的。然而这种差异是否会导致消化功能的差异仍需要进一步研究。另外,从试验猪个体对空肠液组成的变异看,不同个体来源的肠液在淀粉酶活性,Na+、K+、Cl-、Ca2+的浓度上有显著的差异。这可能主要与试验猪个体在饮水、采食行为、生理状态等方面存在差异有关。试验过程中,我们也发现不同试验猪在饮水量、食糜流量上存在较大的差异。
4 结 论
①饲粮的蛋白质来源对生长猪空肠液中胰蛋白酶、糜蛋白酶、脂肪酶、淀粉酶活性及Na+、K+、Cl-、Ca2+、M g2+浓度及pH都没有显著影响。
②饲粮的蛋白质水平对生长猪空肠液中胰蛋白酶、糜蛋白酶、脂肪酶、淀粉酶活性及Na+、K+、Cl-、Ca2+、M g2+浓度及pH也无显著影响。
[1] LOW A G.Studies on digestion and absorption in the intestines o f grow ing pigs.6.Measurements of the flow o f am ino acids[J].British Journal of Nutrition,1979,41(1):147-156.
[2] LOW A G.The activity o f pepsin,chymotrypsin and trypsin during 24 h periods in the sm all intestine o f grow ing pigs[J].British Journal o f Nutrition, 1982,48(1):147-159.
[3] PARTRIDGE IG.Studies on digestion and absorption in the intestines o f grow ing pigs.3.Netmovements o fm ineral nutrients in the digestive tract[J]. British Journal of Nutrition,1978,39(3):527-537.
[4] PARTRIDGE IG,LOW A G,SAMBROOK I E, et al.The in fluence of diets on the exocrine pancreatic secretion o f growing pigs[J].British Journal of Nutrition,1982,48(1):137-145.
[5] ZEBROWSKA T,LOW A G,ZEBROWSKA H. Studies on gastric digestion of p rotein and carbohyd rate,gastric secretion and exocrine pancreatic secretion in the growing pig[J].British Journalof Nutrition,1983,49(3):401-410.
[6] ZEBROWSKA T,LOW A G.The in f luenceo f diets based on who le wheat,w heat flour and wheat bran on exocrine pancreatic secretion in pigs[J].The Journal o f Nutrition,1987,117(7):1212-1216.
[7] ZHAO F,HOU SS,ZHANG H F,etal.Effects of dietarymetabo lizab le energy and crude p rotein content on the activities of digestive enzymes in jejunum f luid of Peking ducks[J].Pou ltry Science,2007, 86:1690-1695.
[8] 赵峰,张宏福,张子仪,等.饲粮营养水平对鸭空肠液组成的影响[C]//中国畜牧兽医学会2008年学术年会第一届兽医临床大会论文集.广州:中国畜牧兽医学会,2008:89-93.
[9] 郑卫宽,赵峰,张宏福.饲粮类型及肠液储存条件对鸭空肠液组成与特性的影响[J].动物营养学报,2009, 21(5):652-658.
[10] DAHLQV IST A.A m ethod for the determ ination o f amylase in intestinal content[J].Scandinavian Journal of Clinical and Laboratory Investigation, 1962,14:145-151.
[11] W IRNT R.Trypsin,measurement w ith Nα-p-toluenesulfonyl-L-arginine methy l ester as substrate [M]//BERGMEYER H U.Methods of enzymatic analysis.W einheinm:Verlag chem ie,1974.
[12] W IRNT R.Chym otrypsin,measurements with N-benzoyl-L-tyrosin ethyl ester as substrate[M]// BERGM EYER H U.Methods of enzymatic analysis.W einheinm:Verlag chem ie,1974.
[13] CORRING T.The adaptation o f digestive enzymes to the diet:its physiologicalsignificance[J].Rep roduction Nutrition Development,1980,20:1217-1235.
[14] CORRING T,SAUCIER R.Pancreatic secretion by fistulated swine.Adaptation to protein content in the diet[J].Annales de Biologie Animale,Biochimie,Biophysique,1972,12:233-241.
[15] HICKSON JC D.The secretion of pancreatic juice in response to stimu lation of the vagus nerves in the pig[J].The Journal of Ph ysiology,1970,206(2): 275-297.
[16] 陈杰.家畜生理学[M].4版.北京:中国农业出版社, 2003.
[17] HENDRIX T R,BAYLESS T M.D igestion:intestinal secretion[J].Annual Review Physiology, 1970,32:139-164.
[18] FREEMAN C P,NOAKES D E,ANNISON E F, et al.Quantitative aspects of intestinal fat absorption in young pigs[J].British Journal o f Nutrition, 1968,22(4):739-749.
[19] BERGEIM O.Carbohydrates and calcium and phosphorus absorp tion[J].The Journal o f Bio logical Chem istry,1926,70:35-45.
*Correspond ing au thor,p rofessor,E-m ail:zhangh f6565@vip.sina.com
(编辑 田艳明)

