高效液相色谱法测定鸡组织中尼卡巴嗪标识残留物
谢守新,林海丹,姚仰勋,邵琳智,吴映璇
(1.广州出入境检验检疫局,广东 广州 510623;2.广东检验检疫技术中心食品实验室,广东 广州 510623)
高效液相色谱法测定鸡组织中尼卡巴嗪标识残留物
谢守新1,林海丹2,姚仰勋2,邵琳智2,吴映璇2
(1.广州出入境检验检疫局,广东 广州 510623;2.广东检验检疫技术中心食品实验室,广东 广州 510623)
应用高效液相色谱法测定鸡组织中尼卡巴嗪标识残留物——4,4'-二硝基均二苯脲。试样经乙腈-0.5g/mL氢氧化钾溶液提取,正己烷脱脂净化,用高效液相色谱仪(C18柱)分析,流动相为乙腈-体积分数1%乙酸溶液(53:47,V/V),流速1.0mL/min,紫外检测波长为350nm。对鸡肉、鸡肝和鸡蛋样品进行0.05~0.50mg/kg的药物添加回收实验,4,4'-二硝基均二苯脲的平均回收率为93.6%~102.0%(n=10),相对标准偏差为2.8%~10.4%,方法的定量限为0.05mg/kg。该法简便、准确,适用于鸡组织中尼卡巴嗪标识残留物4,4'-二硝基均二苯脲的检测。
鸡组织;尼卡巴嗪标识残留物;4,4'-二硝基均二苯脲;高效液相色谱法
尼卡巴嗪(nicarbazin)为4,4'-二硝基均二苯脲(DNC)与2-羟基-4,6-二甲基嘧啶(HDP)组成的复合物,是目前养禽业中最常使用的抗球虫药之一,对球虫又有抑制合杀灭作用。其广谱、低毒、安全,但在高用药水平下,也会发生细胞变异,肝脏肿胀,极少数鸡发生脾脏坏死和软骨病症。由于羟基二甲基嘧啶在动物给药后,其吸收及其代谢比4,4'-二硝基均二苯脲快得多,4,4'-二硝基均二苯脲成为研究尼卡巴嗪可能残留的关注标识物。我国及联合国粮农组织、新西兰、日本均以4,4'-二硝基均二苯脲单体作为尼卡巴嗪的残留标识物。
我国规定鸡组织中尼卡巴嗪标识残留物最大残留限量为0.2mg/kg,国际食品法典委员会规定鸡组织中为0.2mg/kg,加拿大规定鸡可食用组织为4.0mg/kg,日本肯定列表中规定鸡肉为0.2mg/kg。联合国粮农组织和新西兰规定禽肉中最大残留限量分别为0.2mg/kg和0.5mg/kg。建立鸡组织中4,4'-二硝基均二苯脲的检测方法对于加强畜牧业的卫生安全管理,以及进出口禽产品质量把关重大意义。
目前有关尼卡巴嗪残留标识物4,4'-二硝基均二苯脲的检测方法在国外文献中已有报道[1-6]。国内文献及国外早期文献和国内发布的标准方法主要研究了尼卡巴嗪原药的方法[7-12]。研究尼卡巴嗪残留标识物的文献仅有水产品中尼卡巴嗪残留标识物4,4'-二硝基均二苯脲的检测方法[13]以及鸡蛋和鸡肉中尼卡巴嗪残留标识物4,4'-二硝基均二苯脲的液相色谱-质谱法(LC-MS)[14]。未见有液相色谱法对尼卡巴嗪用药的主要使用对象鸡及其残留标识物检测的报道。本实验拟结合国外研究的成果,利用液液萃取净化的样品前处理技术,应用液相色谱分析鸡组织中的DNC,为鸡组织,包括鸡肉、鸡肝和蛋中的DNC的检测提供可行性方法。
1 材料与方法
1.1 材料与试剂
4,4'-二硝基均二苯脲标准品(纯度98.5%) 德国Witega公司;乙腈(色谱纯) 德国Meker公司;正己烷、乙酸、N,N-二甲基甲酰胺(DMF)、氢氧化钾、无水硫酸钠(均为分析纯) 广州分析试剂厂;超纯水(由Mill-Q纯水系统制得)。
1.2 仪器与设备
高效液相色谱系统(配有Waters515泵、717自动进样器、2487双通道紫外检测器、Empower 色谱工作站)美国Waters公司;匀浆机、涡旋振荡器 德国IKA公司;离心机 德国Sigma公司;减压旋转蒸发仪 德国Heidolph公司。
1.3 标准工作液的配制
准确称取适量双硝基均二苯脲标准物质,加N,N-二甲基甲酰胺5mL溶解,用乙腈配成质量浓度为100mg/L的标准贮备溶液。临用前用乙腈稀释成合适的标准工作溶液。
1.4 色谱条件
色谱柱:Discovery C18柱(250mm×4.6mm,5μm);流动相:乙腈-体积分数1%乙酸溶液(53:47,V/V);流速:1.0mL/min;柱温:35℃;进样量:20μL;检测波长:350nm。
1.5 样品前处理
称取5g试样于50mL离心管中,加入10mL乙腈、0.2mL 0.5g/mL氢氧化钾溶液和3g无水硫酸钠,均质30s,3500r/min离心5min,上清液转移到25mL容量瓶中,残渣加入10mL乙腈和0.2mL 质量浓度0.5g/mL的氢氧化钾溶液,涡旋振荡提取2min,3500r/min离心5min,合并上清液,用乙腈定容至刻度,待净化。
移取2.0mL上述提取液于25mL浓缩瓶中,加入3mL乙腈饱和正己烷,涡旋振荡,静置分层,弃去上层。再加入3mL乙腈饱和正己烷,重复操作。下层提取液于40℃条件下旋转蒸发至近干,用乙腈溶解残渣,定容至2.0mL,过0.20μm滤膜,供液相色谱测定。
2 结果与分析
2.1 提取溶液的选择
动物组织中4,4'-二硝基均二苯脲残留的检测,国内外文献报道的提取溶剂有乙腈和DMF。本实验比较了多种不同提取溶剂的提取效率,鸡肉样品添加1mg/ kg,以0.1g/mL DMF乙腈溶液和碱性乙腈溶液提取,回收率均大于80%。结果表明DMF乙腈混合溶液和碱性乙腈溶液效果都较理想。最终采用碱性乙腈,即10mL乙腈-200μL 0.5g/mL氢氧化钾溶液作为提取溶液。
2.2 净化条件的选择
样品用乙腈提取,可能提取出大量杂质,因此提取后需除去杂质而净化。采用正己烷对提取液进行液液分配脱脂。由于尼卡巴嗪的最大吸收波长是350nm,在此吸收波长处干扰物质少,单纯的液液萃取脱脂后样液已满足净化效果,而且回收率理想、重现性好。乙腈和正己烷有些互溶性,导致下层乙腈层体积不准确,故脱脂后采用旋干下层再重新定容,以保证定量的准确性。
2.3 色谱条件的优化
采用乙腈-体积分数1.0%乙酸溶液。选用Discovery C18色谱柱,流速为1.0mL/min,4,4'-二硝基均二苯脲在比例为53:47(V/V)的情况下达到很好的分离,分析物保留时间附近无干扰峰(图1)。
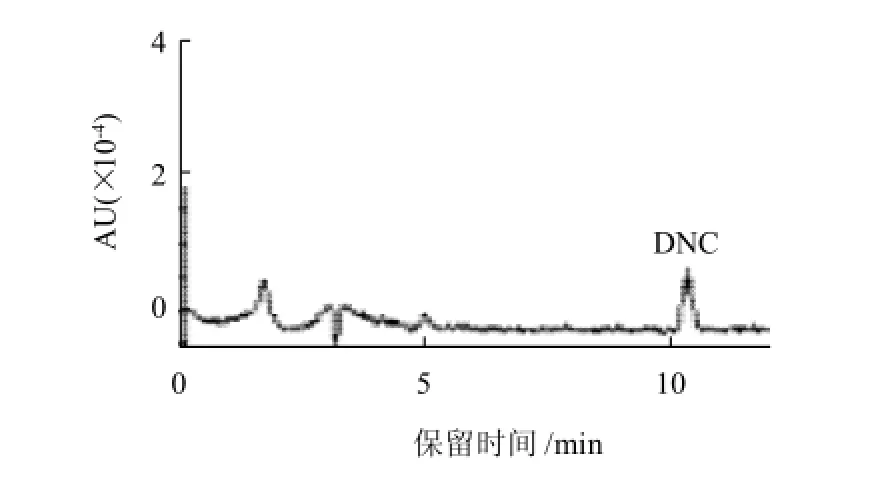
图1 4,4'-二硝基均二苯脲标准品(0.01mg/L)液相色谱图Fig.1 HPLC chromatogram of DNC standard at 0.1 mg/L level
2.4 方法学验证
2.4.1 方法的线性范围和定量限
液相色谱测定4,4'-二硝基均二苯脲,用乙腈配成0.01、0.05、0.10、0.20、0.50、1.00mg/L的标准工作液,质量浓度由低到高进样检测,以峰面积-质量浓度作图,得到标准曲线回归方程为Y=1.46×105X-2.99×
102,相关系数为0.995。实验测得测定鸡组织(鸡肉、鸡脏及鸡蛋)中4,4'-二硝基均二苯脲残留量的定量限均为0.050mg/kg。
2.4.2 方法的回收率与精密度
分别用不含4,4'-二硝基均二苯脲的鸡肉、鸡肝、鸡蛋进行添加回收率和精密度实验,结果见表1。
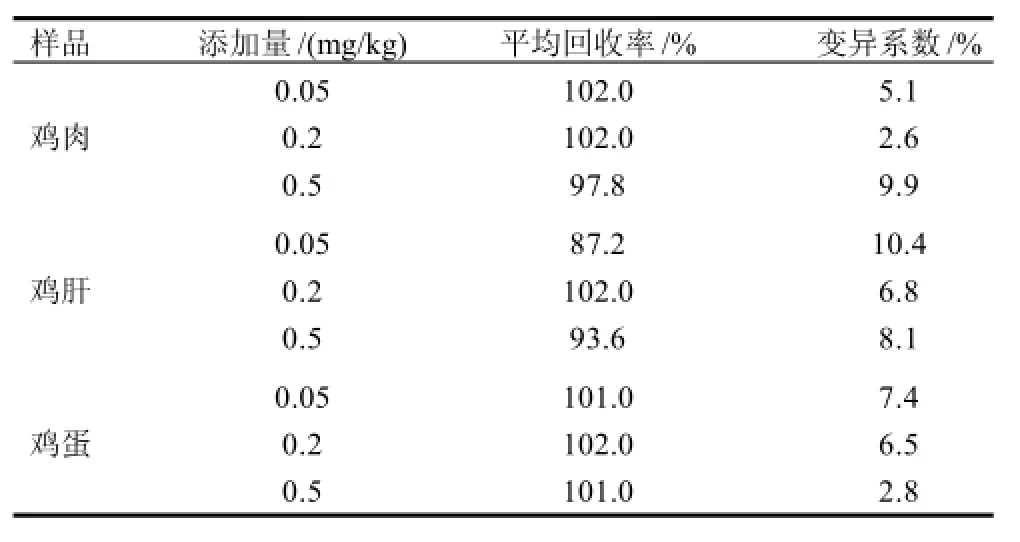
表1 样品中添加4,4'-二硝基均二苯脲的回收率和相对标准偏差(n=10)Table 1 Average recoveries of 10 replicates for DNC in chicken meat, liver and eggs spiked at different levels (n=10)
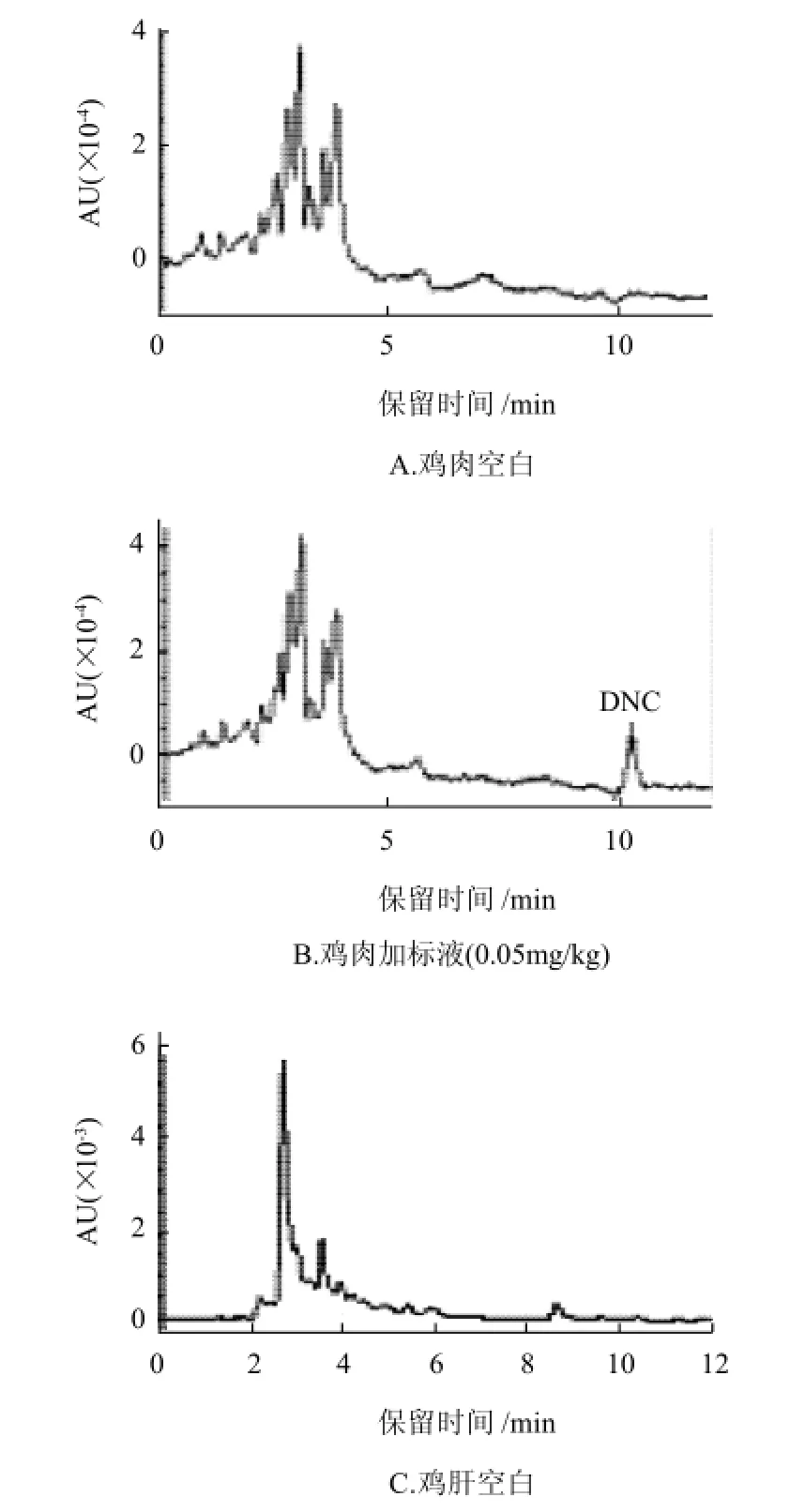

图2 鸡组织空白和加标样品的液相色谱图Fig.2 HPLC chromatograms of blank and spiked chicken tissue samples
各样品空白和添加定量限水平的液相色谱图见图2。由图可见,在药物的出峰时间,样品无干扰峰。该法的提取条件和色谱条件有效可行。
3 结 论
结果表明,在添加0.05~0.50mg/kg标准品的范围内,回收率在80%~110%之间,相对标准偏差小于10%。本方法的回收率和精密度符合SN/T 0001—1995《出口商品中农药、兽药残留量及生物毒素检验方法标准编写的基本规定》[15]对回收率和精密度的要求。本方法准确、实用、适合鸡组织中尼卡巴嗪的检测。
[1]STAHL R S, JOHNSTON J J. High-performance liquid chromatography-based determination of nicarbazin excretion in waterfowl[J]. Journal of Chromatography B, 2002, 775: 103-108.
[2]CAPURRO E, DANAHER M, ANASTASIO A, et al. Effcient HPLC
method for the determination of nicarbazin as dinitrocarbanilide in broiler liver[J]. Journal of Chromatography B, 2005, 822: 154-159.
[3]MORTIER L, DAESLEIRE E, DELAHAUT P. Simultaneous detection of five coccidiostats in eggs by liquid chromatography-tandem mass spectrometry[J]. Analytica Chimica Acta, 2003, 483: 27-37.
[4]MORTIER L, DAESLEIRE E, van PETEGHEM C. Liquid chromatographic tandem mass spectrometric determination of five coccidiostats in poultry eggs and feed[J]. Journal of Chromatography B, 2005, 820: 261-270.
[5]DUBOIS M, PIERRET G, DELAHAUT P. Efficient and sensitive detection of residues of nien coccidiostats in egg and muscle by liquid chromatography-eletrosprqy tandem mass spectrometry[J]. Journal of Chromatography B, 2004, 813: 181-189.
[6]STAHL R S, VERCANTERER K, TERESA L. Determination of 4,4'-dinitrocarbanilide (DNC) a component of nicarbazin in canada goose (Branta canadensis) eggshells using high-performance liquid chromatogryphy[J]. Agricultural and Food Chemistry, 2003, 51: 1130-1135.
[7]DHARMENDR K, MATABUDUL, CROSBY N T. A new rapid method for the dtermination of nicarbazin residues in poultry feed, eggs and muscle tissue using supercritical fluid extraction and high performance liquid chromatography[J]. The Analyst, 1999, 124: 499-502.
[8]章虎, 吴俐勤, 杨彩梅, 等. 尼卡巴嗪残留量测定和安全性分析[J].现代科学仪器, 2005(1): 68-70.
[9]陈家华. 鸡肉中尼卡巴嗪残留的快速测定方法[J]. 现代商检科技, 1993, 3(6): 45-46.
[10]邵庆均, 张金枝, 宣士荣, 等. 反相液相色谱法测定饲料中尼卡巴嗪含量[J]. 分析化学, 2003, 31(11): 1376-1378.
[11]GB/T 19423—2003 饲料中尼卡巴嗪的测定: 高效液相色谱法[S].
[12]SN 0216—1993 出口禽肉中尼卡巴嗪残留量检验方法[S].
[13]于慧娟, 姜朝军, 惠芸华, 等. 高效液相色谱法测定水产品中4,4'-二硝基均二苯脲[J]. 分析试验室, 2008, 27(12): 119-121.
[14]孙雷, 张骊, 刘智宏, 等. 鸡蛋和鸡肉中尼卡巴嗪残留量检测: 高效液相色谱-串联质谱法研究[J]. 中国兽药杂志, 2008, 42(5): 1-4.
[15]SN/T 0001—1995 出口商品中农药、兽药残留量及生物毒素检验方法标准编写的基本规定[S].
HPLC Determination of Nicarbazin Residue in Chicken Tissues
XIE Shou-xin1,LIN Hai-dan2,YAO Yang-xun2,SHAO Lin-zhi2,WU Ying-xuan2
(1. Guangzhou Entry-Exit Inspection and Quarantine Bureau, Guangzhou 510623, China;2. Food Testing Laboratory, Guangdong Inspection and Quarantine Technology Center, Guangzhou 510623, China)
A high performance liquid chromatographic (HPLC) assay with UV detection of 4,4'- dinitrocarbanilide (DNC), the marker residue for nicarbazin, was developed for the determination of nicarbazin residue in chicken tissues. Samples were extracted with a 50% aqueous potassium hydroxide solution containing acetonitrile, and the resulting extract was then treated with n-hexane for the removal of lipids prior to HPLC analysis using a mobile phase composed of a mixture of acetonitrile and an 1% aqueous acetic acid solution at a flow rate of 1.0 mL/min with UV detection at the 350-nm wavelength. Average recoveries of 10 replicates for DNC in chicken meat, liver and eggs spiked at 3 levels (0.05, 0.20 mg/kg and 0.50 mg/kg) were within the range of 93.6%-102.0%, with a RSD ranging from 2.8% to 10.4%. The method detection limit was 0.05 mg/kg. This method, thanks its simplicity and high accuracy, is most suitable for the determination of nicrabazin residue 4,4'- dinitrocarbanilide in chicken tissues.
chicken tissues;nicarbazin residue;4,4'- dinitrocarbanilide;high performance liquid chromatography (HPLC)
O657.72
A
1002-6630(2010)10-0275-04
2009-08-31
谢守新(1972—),男,高级工程师,硕士,主要从事食品中兽药残留和食品添加剂残留检测研究。E-mail:linhaidangz@yahoo.com.cn

