以吡柔比星为主的新辅助化疗治疗乳腺癌38例临床观察
张玲 李发强
(焦作煤业集团中央医院 河南 焦作 454000)
以吡柔比星为主的新辅助化疗治疗乳腺癌38例临床观察
张玲 李发强
(焦作煤业集团中央医院 河南 焦作 454000)
目的 探讨以吡柔比星为主的新辅助化疗治疗乳腺癌的近期疗效。方法 选择2006年1月至2009年12月收治的38例Ⅱ~Ⅲ期女性乳腺癌患者,行3周期FTC方案和AT方案新辅助化疗,化疗结束后评价疗效和毒副作用。结果 38例行3周期新辅助化疗后,FTC方案组有效率为60%(12/20),AT方案组有效率为83.3% (15/18),2组比较差异有统计学意义(P<0.05)。2组患者常见化疗毒副反应为骨髓抑制。结论 以吡柔比星为主的新辅助化疗疗效确切,毒副反应可以耐受,其中吡柔比星联合多西他赛方案近期疗效显著,值得临床推广应用。
乳腺癌 新辅助化疗 吡柔比星
新辅助化疗作为乳腺癌的重要治疗手段之一,由于疗效确切,在临床得到越来越广泛的应用和。2006年1月至2009年12月我科对38例Ⅱ、Ⅲ期乳腺癌患者行FTC和AT方案新辅助化疗,比较2组化疗方案的疗效,报道如下。
1 资料与方法
1.1 一般资料
2006年1月至2009年12月收治的38例女性乳腺癌患者,年龄27~64岁,平均44.5岁,分为2组,术前进行不同方案吡柔比星联合化疗;FTC方案组20例,其中Ⅱb期8例、Ⅲa期9例、Ⅲb期3例;AT方案组8例,其中Ⅱb期7例、Ⅲa期7例、Ⅲb期4例。所有病例乳腺肿瘤均行乳腺钼靶立体定位空芯针活检,病理诊断为浸润性乳腺癌,经检查无远处转移,并且患者心电图、血液分析、肝、肾功能检查均无明显异常,Karnofsy评分>80分,既往未进行过任何治疗。
1.2 治疗方法
FTC方案组:吡柔比星(THP)40mg/m2,第1天静脉注射;5-氟尿嘧啶(5-Fu)500mg/m2,第1、8天持续4h静脉滴注;环磷酰胺(CTX)600mg/m2,第1天静脉注射;21d为1个周期,共3周期。AT方案组:THP40mg/m2,第1天静脉注射;多西他赛(TXT)75mg/m2,第1天持续1h静脉滴注,化疗前1d口服地塞米松10mg,每日2次,连用3~5d,静滴时用心电监护仪监测血压、心率、血氧等;2组化疗前30min均静脉注射地塞米松10mg、昂丹斯琼8mg,预防胃肠道副反应及过敏反应;出现Ⅱ级以上血液学毒性时使用粒细胞集落刺激因子(G-CSF)。
1.3 疗效评价方法
所有病例新辅助化疗前后,均通过体检、彩超分别测量肿瘤最大径,临床疗效按照WHO标准评价:完全缓解(CR),病灶完全消失;部分缓解(PR),病灶缩小≥50%;无变化(NC),病灶缩小<50%;进展(PD),病灶增大≥50%。CR可分为临床完全缓解(CPR)和病理完全缓解(PCR)。总有效率(RR)=CR+PR。毒性评价按WHO标准分为0、Ⅰ、Ⅱ、Ⅲ、Ⅳ度。
1.4 统计学处理
应用SPSS 10.0版软件进行统计学处理,率的差异显著性采用χ2检验。
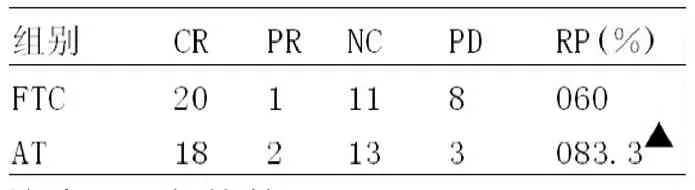
表1 2组患者行3周期新辅助化疗后疗效比较(例)
2 结果
38例患者行3周期新辅助化疗后,FTC方案组临床完全缓解1例,无病理完全缓解,部分缓解11例,有效率为60%(12/20)。AT方案组临床完全缓解2例,部分缓解13例,有效率为83.3%(31/36)。2组比较差异有统计学意义(P<0.05),见表1。
2组患者毒副反应多表现为白细胞计数减少、恶心、呕吐,偶有肝功能轻度损害,经对症治疗均可耐受。
3 讨论
从20世纪70年代开始使用新辅助化疗以来,其有效性得到了广泛的认可,尤其在乳腺癌综合治疗中的应用获得良好的肯定。吡柔比星是半合成的、化学结构与阿霉素相近的一种新型蒽环类抗肿瘤药物,主要用于乳腺癌等恶性肿瘤的治疗。田海梅等[2]用吡柔比星对乳腺癌细胞系MCF-7研究表明吡柔比星对乳腺癌起效迅速,细胞凋亡比例高,具有较好的抑瘤效果。国内学者对吡柔比星和阿霉素进行广泛的临床对照研究[3],均认为吡柔比星疗效好,毒副作用较阿霉素低,尤其是其心脏毒性、脱发等毒副作用明显低于阿霉素,患者更易耐受。多西他赛是新一代半合成紫杉类抗癌药物,也是目前乳腺癌化疗中最有效的药物之一,其作用靶点是微管,可促进细胞内微管聚合,使微管稳定,肿瘤细胞分裂受,达到抗肿瘤的目的。本治疗组38例患者行3周期新辅助化疗后,FTC方案组有效率RR为60%(12/20)。AT方案组临床完全缓解2例,部分缓解13例,有效率为83.3%(31/36),2组比较差异有统计学意义(P<0.05),说明AT方案新辅助化疗疗效明显优于FTC方案。2组患者常见化疗毒副反应为骨髓抑制,以白细胞减少最多,经用GCSF支持后,均能完成化疗,2组均未出现严重肝功能和心脏损害。含吡柔比星新辅助化疗疗效确切,其中吡柔比星联合多西他赛方案近期疗效显著,毒副反应经预防后患者可以耐受,值得临床推广运用。
[1]田海梅,傅军,王燕,等.3种药物对人乳腺癌细胞体外杀伤作用比较[J].中国肿瘤临床,2004,31(19):1113.
R711
A
1674-0742(2010)09(a)-0108-01
2010-05-14

