溶血性链球菌LAMP检测方法的建立
尹 欢,李 琦,陈江源,马寅众,李 睿,刘志国*
(武汉工业学院生物与制药工程学院,湖北 武汉 430023)
溶血性链球菌LAMP检测方法的建立
尹 欢,李 琦,陈江源,马寅众,李 睿,刘志国*
(武汉工业学院生物与制药工程学院,湖北 武汉 430023)
目的:研究溶血性链球菌的环介导等温扩增(loop-mediated isothermal amplification,LAMP)检测方法,实现对溶血性链球菌的快速检测。方法:针对溶血性链球菌的scpA基因设计4条特异性LAMP内外引物进行LAMP扩增;优化扩增反应条件;采用包括溶血性链球菌在内的6种不同菌株进行LAMP的特异性检测,并酶切鉴定;对溶血性链球菌菌液以无菌水进行10倍系列梯度稀释后,进行LAMP扩增检测其灵敏度;将菌掺入牛奶样本并进行LAMP检测。结果:本法可快速灵敏地检测出溶血性链球菌,反应特异性高,检出限为16.7CFU/mL,而牛奶样本的检出限则达10CFU/mL。结论:LAMP法可用于食品溶血性链球菌的快速检测。
溶血性链球菌;环介导等温扩增(LAMP);检测;检出限
溶血性链球菌(Streptococcus hemolyticus)是一种常见的病原微生物,可引起食物中毒与临床感染,感染人体可导致新生儿败血症、脑膜炎、肺炎等多种严重感染性疾病,甚至死亡[1-3]。根据溶血性链球菌族特异性抗原的不同,可将其分为18个族,其中A、B、C、D、F、G族对人类有致病能力。
传统的溶血性链球菌分离鉴定法通常需要24~48h才能报告结果,且影响因素多,不适合体检及大规模的诊断、筛查。随着分子生物学的发展,现在已建立了以PCR为基础的多项检测技术如免疫PCR、实时定量PCR、多重PCR,及以抗原检测为主的免疫学检测法[4-8]。这些检测方法快捷、灵敏,准确度较高。但是,这些针对单一族溶血性链球菌的现代检测方法均需一定的设备和技术要求,且试剂费用较贵,难以推广普及。因此,建立溶血性链球菌特别是致病性菌株的准确快速检测对于控制该类细菌引起的食物中毒具有重要意义。
研究表明,溶血性链球菌感染人类宿主与scp基因编码的C5a-肽酶有关[9-10],这一基因在不同的致病性溶血性链球菌中有很高的一致性,但不存在于其他菌株中。因此针对溶血性链球菌scp基因建立快速检测方法具有重要价值。近年来,环介导恒温扩增(loop-mediated isothermal amplification,LAMP)方法在微生物检测中的作用受到关注。该方法由Notomi[11]等于2000年提出,它利用链置换DNA聚合酶在恒温条件下自循环几十分钟,完成核酸扩增反应。LAMP法具有高特异性、高灵敏性、简便、快速、低成本的特点,已在诸多
领域广泛应用[12-13]。本实验旨在建立溶血性链球菌的特异LAMP法,以便实现食品中溶血性链球菌的快速检测。
1 材料与方法
1.1 材料与试剂
溶血性链球菌(Streptococcus hemolyticus CICC 10373)、福氏志贺氏菌(Shigella flexneri)、肠炎沙门氏菌(Salmonella enteritidis) 中国工业微生物菌种保藏中心;金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(E.coli DH5α)、枯草芽孢杆菌(Bacillus subtilis)为本实验室保藏菌株。
Bst DNA聚合酶 纽英伦生物技术有限公司;dNTP美国Promega公司;冻干脱纤维羊血 友康基业生物科技有限公司。
1.2 仪器与设备
电热恒温水浴箱 武汉市琴台医疗器械厂;YJ-1450超净工作台 江苏苏州净化设备公司;UNO Ⅱ聚合酶链式反应仪 德国Whatman Biometra公司;核酸电泳仪 北京六一厂;UV-2000 GIS紫外分析仪 日本Hitachi公司。
1.3 方法
1.3.1 DNA模板的制备
煮沸法[14-15]制备靶DNA:挑取溶血性链球菌单菌落溶于100μL 无菌水混匀后,于100℃水浴10min裂解,冰浴2min,然后4℃、12000r/min离心5min,含DNA模板的上清液备用。
1.3.2 引物设计与合成
根据Genbank公布的溶血性链球菌 scpA 基因序列,设计LAMP特异引物,包括两条外引物F3、B3和两条内引物FIP、BIP。引物由上海生工生物工程技术服务有限公司合成。引物序列见表1。

表1 扩增scpA基因的LAMP引物序列Table1 Design of LAMP primers for amplifying the scp A of Streptococcus hemolyticus
1.3.3 LAMP反应体系及条件优化
LAMP反应体系为25μL,包括内引物、外引物、Bst DNA聚合酶、dNTPs、1×ThermoPol buffer以及适量的DNA模板;LAMP产物进行1%琼脂糖凝胶电泳分析。
选择不同浓度比例的内外引物,改变反应时间和温度进行LAMP反应,电泳观察扩增效果,确定最佳反应条件。
1.3.4 LAMP特异性检测
分别对包括溶血性链球菌在内的6种不同菌株进行LAMP扩增,检测LAMP引物的特异性。由于扩增目标片段含有限制性内切酶Ta qⅠ的酶切位点,将模板DNA与酶混合,37℃酶切过夜,然后进行LAMP反应,验证序列的特异性扩增。
1.3.5 LAMP灵敏度检测
将培养2d的溶血性链球菌挑取单菌落,溶于1mL液体血培养基中,混匀后,以无菌水10倍梯度逐步稀释菌液,分别取各稀释菌液100μL进行平板计数,并煮沸制备DNA,取1μL含模板DNA的上清液进行LAMP扩增。
1.3.6 牛奶样本中掺入的溶血性链球菌后的LAMP检测
以滤过除菌的市售牛奶作为溶血性链球菌的稀释液,10倍梯度逐步稀释菌液,并取样进行菌落培养计数,制备DNA模板,进行LAMP扩增。
2 结果与分析
2.1 LAMP方法的建立与反应条件优化
LAMP特异引物使溶血性链球菌基因组DNA扩增出阳性梯状条带,而无模板的无菌水的阴性对照没有条带出现。优化条件结果显示:在其他反应条件不变且内引物与外引物的浓度比为3:1时扩增效果佳(图1A);当反应进行到50min时即出现梯状条带,60min反应最佳,此时扩增稳定(图1B);当反应温度达55℃有阶梯状条带,60℃为最佳扩增(图1C)。
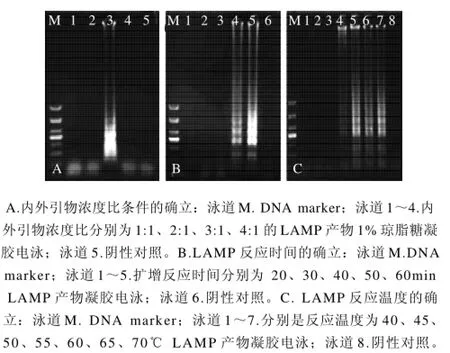
图1 LAMP反应条件优化结果Fig.1 Optimal reaction conditions for LAMP method
2.2 LAMP的特异性
如图2所示,仅溶血性链球菌出现阳性的梯状条
带,其他5株非溶血性链球菌均未呈阴性(图2A);溶血性链球菌DNA模板被TaqⅠ酶切后,无LAMP扩增(图2B),表明LAMP引物只针对溶血性链球菌特异基因序列。
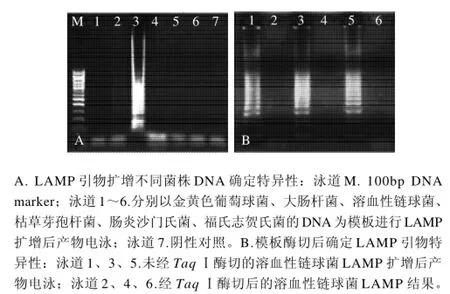
图2 LAMP的特异性检测结果Fig.2 Specificity of LAMP for the detection of Streptococcus hemolyticus
2.3 LAMP的灵敏度
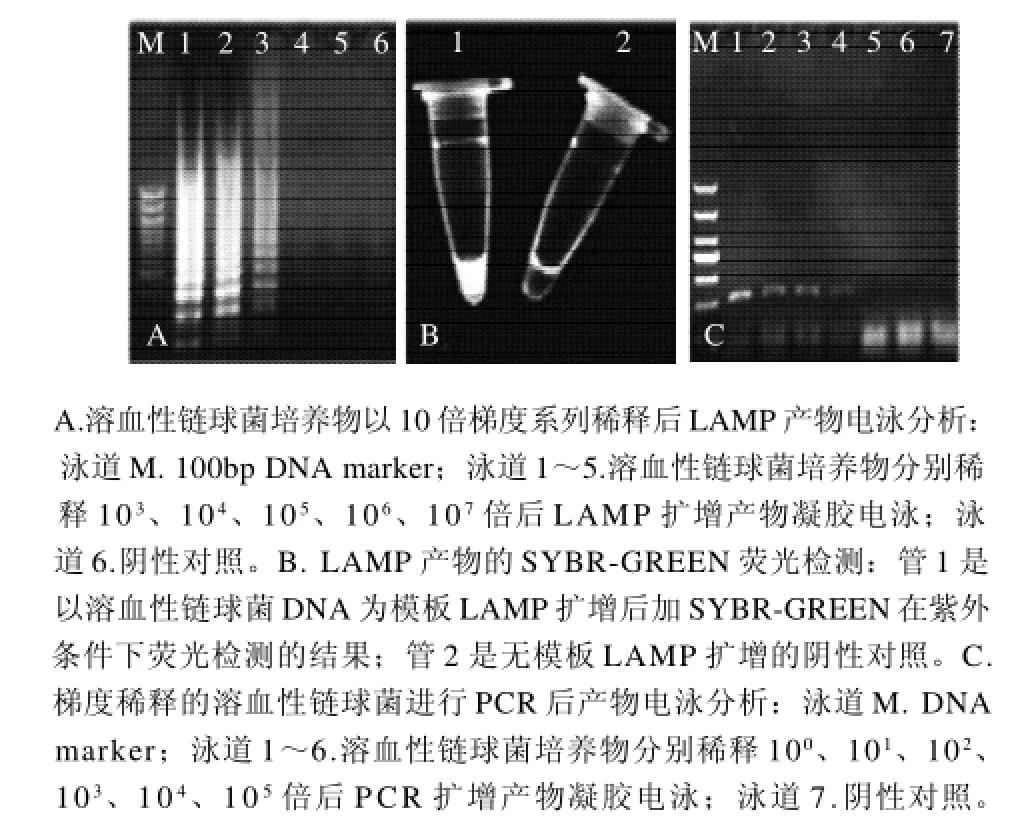
图3 LAMP的灵敏度检测结果Fig.3 Sensitivity of LAMP for the detection of Streptococcus hemolyticus
以无菌水将溶血性链球菌系列稀释后,分别取样LAMP 检测(图3A),并通过平板培养菌落计数,结果检出限为16.7CFU/mL。扩增产物中加入0.1μL SYBRGREEN 在紫外光条件下可见荧光(图3B)。将各稀释的溶血性链球菌进行PCR检测,结果显示PCR法的检出限为1.21×103CFU/mL(图3C)。可见针对溶血性链球菌scpA基因扩增的LAMP法比PCR法更灵敏。
2.4 LAMP法检测牛奶中的溶血性链球菌
牛奶样本中掺入溶血性链球菌并进行系列梯度稀释后进行LAMP反应,并平板计数,结果牛奶中溶血性链球菌的LAMP检出限为1.0×101CFU/mL(图4)。市售牛奶样本未检出溶血性链球菌。
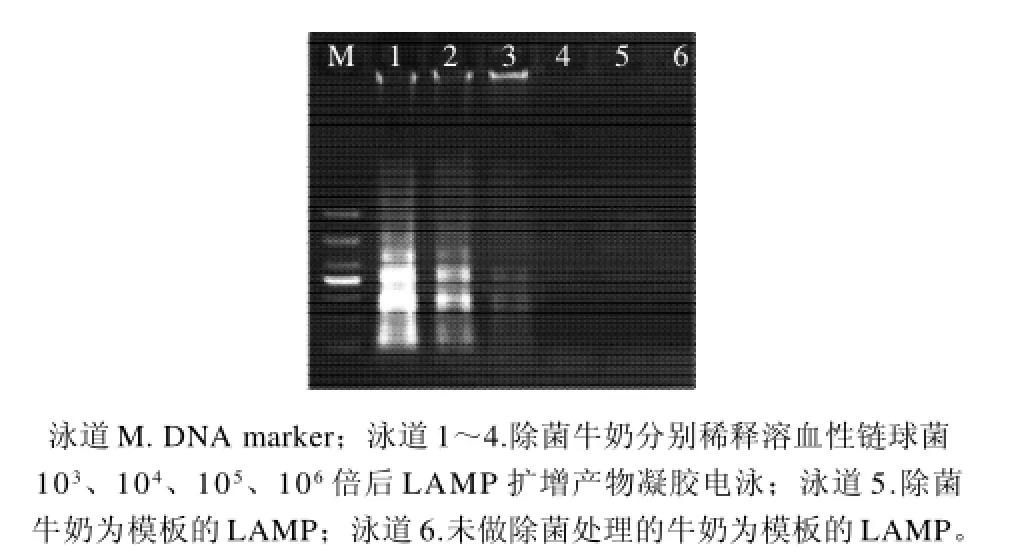
图4 牛奶样本的溶血性链球菌LAMP检测Fig.4 LAMP detection of Streptococcus hemolyticus in milk samples
3 讨 论
采用溶血性链球菌的scpA基因序列中的一段特异序列作为LAMP扩增的靶序列,针对6个不同区域,设计内外两对引物,保证了LAMP反应的特异性扩增,并成功检测出溶血性链球菌菌株,而其他菌的基因不能扩增出来,表明该引物针对溶血性链球菌的scpA基因特异序列有很高的特异性。
鉴于溶血性链球菌菌群中对食品危害最大的是带有C5a-肽酶的致病菌株,因此检出该类致病菌十分重要,针对溶血性链球菌scpA基因设计特异性LAMP扩增引物,进行等温扩增,能有效地检出致病性溶血性链球菌。LAMP检测方法的灵敏度非常高[16-17]。本实验中针对这一特异性基因设计的LAMP引物可检出1.67× 101CFU/mL(相当于每个反应管最低检测限为1.67CFU),而PCR法的检出限为1.21×103CFU/mL,实验表明LAMP法检测溶血性链球菌的灵敏度更高。LAMP法产物的检测多样化[18-19],可通过肉眼观察、添加荧光染料、琼脂糖凝胶电泳检测反应是否发生。
在市售牛奶样本中未检测到溶血性链球菌污染,通过将溶血性链球菌掺入到牛奶中检测,LAMP法检出限为10CFU/mL。可能牛奶比无菌水更适宜于菌的生长,提菌DNA前菌有少量增长,更易检出。
综上所述,本实验建立的溶血性链球菌LAMP检测方法具有特异性强、灵敏度高,方便快捷、成本低等优点,为溶血性链球菌的检测提供了新的方法,可广泛用于食品中致病性溶血性链球菌的快速检测。
[1]陈木林. 快速检测咽拭子中A群β溶血性链球菌结果的分析[J]. 现
代保健: 医学创新研究, 2007, 35(4): 7.
[2]梁云梅, 杨永弘. A族β溶血性链球菌与猩红热的相关研究[J]. 微生物学杂志, 2009, 29(4): 89-92.
[3]张一举. A组β型溶血性链球菌性咽炎的研究进展[J]. 新医学, 2006, 37(12): 830-831.
[4]GRARUP C, GLEESEN A S, DARGIS R, et al. Infections with betahaemolytic streptococci: detection by a universal PCR for bacterial DNA and DNA sequencing[J]. Scand J Infect Dis, 2008, 40(6/7): 547-550.
[5]LIANG H, CORDOVA S E, KIEFT T L, et al. A highly sensitive immuno-PCR assay for detecting Group A Streptococcus[J]. J Immunol Methods, 2003, 279(1/2): 101-110.
[6]LEE J H, UHL J R, COCKERILL F R, et al. Real-time PCR vs standard culture detection of group A beta-hemolytic streptococci at various anatomic sites in tonsillectomy patients[J]. Arch Otolaryngol Head Neck Surg, 2008, 134(11): 1177-1181.
[7]FUKUSHIMA K Y, YANAGIHARA K, HIRAKATA Y, et al. Rapid identification of penicillin and macrolide resistance genes and simultaneous quantification of Streptococcus pneumoniae in purulent sputum samples by use of a novel real-time multiplex PCR assay[J]. J Clin Microbiol, 2008, 46(7): 2384-2388.
[8]LEUNG A K, NEWMAN R, KUMAR A, et al. Rapid antigen detection testing in diagnosing group A beta-hemolytic streptococcal pharyngitis [J]. Expert Rev Mol Diagn, 2006, 6(5): 761-766.
[9]FRANKEN C, HAASE G, BRANDT C, et al. Horizontal gene transfer and host speci city of beta-haemolytic streptococci: the role of a putative composite transposon containing scpB and lmb[J]. Molecular Microbiology, 2001, 41(4): 925-935.
[10]DMITRIEV A, SUVOROV A, SHEN A, et al. Clinical diagnosis of group B streptococci by scpB gene based PCR[J]. Indian J Med Res, 2004, 119(Suppl): 233-236.
[11]NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28 (12): 63-69.
[12]李志强. LAMP 技术在微生物检测中的应用[J]. 生命科学仪器, 2009 (7): 7-10.
[13]曾冰冰, 肖凯军, 石磊, 等. LAMP方法在食品微生物检测中的应用[J]. 现代食品与药品杂志, 2007, 17(1): 22-25.
[14]DRAGO L, LOMBARDI A, VECCHI E D, et al. Real-time PCR assay for rapid detection of Bacillus anthracis spores in clinical samples[J]. Clinical Microbiology, 2002, 40(11): 4399.
[15]MAKINO S, CHEUN H. Application of the real-time PCR for the detection of airborne microbial pathogens in reference to the anthrax spores[J]. Microbiological Methods, 2003, 53(12): 141-147.
[16]QIAO Yanmei, GUO Yongchao, ZHANG Xianen, et al. Loop-mediated isothermal amplification for rapid detection of Bacillus anthracis spores [J]. Biotechnol Lett, 2007, 29(12): 1939-1946.
[17]KUROSAKI Y, SAKUMA T, FUKUMA A, et al. A simple and sensitive method for detection of Bacillus anthracis by loop-mediated isothermal amplification[J]. J Appl Microbiol, 2009, 107(6): 1947-1956.
[18]RIGANO L A, MARANO M R, CASTAGNARO A P, et al. Rapid and sensitive detection of Citrus Bacterial Canker by loop-mediated isothermal amplification combined with simple visual evaluation methods[J]. BMC Microbiol, 2010, 10(1): 176-183.
[19]ZHANG Xingjuan, SUN Yuan, LIU Lihong, et al. Validation of a loopmediated isothermal amplification assay for visualised detection of wildtype classical swine fever virus[J]. J Virol Methods, 2010, 167(1): 74-78.
Establishment of Loop-mediated Isothermal Amplification for the Detection of Streptococcus hemolyticus
YIN Huan,LI Qi,CHEN Jiang-yuan,MA Yin-zhong,LI Rui,LIU Zhi-guo*
(College of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
Objective: To develop a loop-mediated isothermal amplification (LAMP) method for the rapid detection of Streptococcus hemolyticus. Methods: According to the scpA gene of Streptococcus hemolyticus, 4 specific primers were designed for LAMP amplification. Six different Streptococcus hemolyticus strains were validated by LAMP and identified by enzymatic digestion. The sensitivity of LAMP method was evaluated by serial gradient dilution of Streptococcus hemolyticus solution. Results: LAMP could be used for the rapid and sensitive detection of Streptococcus hemolyticus with a high sensitivity and a detection limit of 16.7 CFU/mL. Moreover, the detection limit was 10 CFU/mL in milk samples. Conclusion: LAMP method is a simple, rapid and feasible method for the detection of Streptococcus hemolyticus.
Streptococcus hemolyticus;loop-mediated isothermal amplification;detection;detection limit
Q93.3
A
1002-6630(2010)22-0311-04
2010-06-27
武汉市科技局对外科技合作与交流计划项目(201070934341);武汉工业学院研究生创新基金重点项目(09cx002)
尹欢(1987—),女,硕士研究生,主要从事食品微生与食品安全研究。E-mail:huanyin1011@126.com
*通信作者:刘志国(1963—),男,教授,博士,主要从事生物技术与食品安全研究。E-mail:zhiguo_1@126.com

