乳铁蛋白对Th1/Th2细胞平衡的影响研究进展
张 浩,胡志和
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
乳铁蛋白对Th1/Th2细胞平衡的影响研究进展
张 浩,胡志和
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
乳铁蛋白是一种具有多种特殊生理功能的天然铁结合蛋白。本文阐述了Th1/Th2细胞平衡对机体免疫功能的重要性及乳铁蛋白对Th1和Th2细胞平衡影响的最新研究进展,并对其应用前景进行了展望。
乳铁蛋白;Th细胞;Th1/Th2细胞平衡
乳铁蛋白(lactoferrin,LF)又称乳转铁蛋白,是一种具有多种生理活性功能的天然活性铁结合蛋白,由689个氨基酸组成,是一条分子质量约为80kD的铁结合性蛋白,其多肽链上结合有二条糖链,碳水化合物含量为7%左右,组成包括半乳糖、甘露糖、N-乙酰半乳糖胺、岩藻糖以及唾液酸等。广泛存在于哺乳动物的乳汁以及动物的唾液、眼泪、精液、胆汁等外分泌液或中性粒细胞、血浆中。目前,各国科学家就乳铁蛋白构效关系、配体与受体、调节细胞增殖分化、免疫调节、药理与临床、乳铁蛋白及衍生肽抗菌活性、分子设计与表达、重组和转基因乳铁蛋白等方面进行了研究。研究表明,乳铁蛋白具有很多的生理和生物学功能,其功能包括:1)离子传递功能[1];2)抑菌和杀菌作用[2];3)抗病毒活性[3];4)其水解获得的乳铁素增加的抗微生物活性[4];5)毒素结合活性[5];6)促进某些动物细胞生长的活性[6];7)血小板结合活性[7];8)免疫调节活性,与免疫球蛋白和其他保护性因子相协调参与局部分泌免疫,减少损伤和损伤愈合作用[8-9];9)消炎作用[10];10)抗肿瘤作用[11];11)多种酶活性[12];12)DNA结合和转录调节活性[13];13)强化和调节骨骼肌生长作用等[14]。本文就Th1和Th2细胞平衡对机体健康作用及乳铁蛋白对Th1和Th2细胞平衡影响的最新研究进行综述。
1 Th1和Th2细胞平衡
大量研究证明,胃肠黏膜系统在食品消化和吸收过程中,不仅可以获得各种营养物质,同时也通过作用于分部在肠黏膜系统的网状树突细胞(dendritic cell,DC)和抗原呈递细胞(antigen presenting cells,APC)传递信息给免疫细胞,从而作用于由多种炎症和抗炎细胞因子所组成的复杂细胞因子网络,而DC 是专职和最有效的APC,在T辅助淋巴细胞(T helper cell,即Th细胞)的调节中有着重要作用。造血干细胞培养生产的DC分为DC1和DC2两类,DC1活化后能够大量分泌Th1细胞启动因子IL-12,促进Th1细胞分泌IFN-γ,增强细胞毒T细胞(CTL)的功能;DC2则允许Th细胞向Th2细胞分化,诱导Th2免疫反应。
Mosmann等[15]首次发现CD4+T细胞(Th)具有两种功能不同的亚群,即Th1和Th2细胞,而这两种细胞又都来自一个共同的前体细胞Th0细胞。Maggie等[16]发现人的Th细胞与鼠的相似,也可以分为Th1和Th2细胞两种类型。Th1细胞主要分泌IL-2、IFN-γ、INF-α、LT、IL-12、IL-17、GM-CSF等,它主要介导细胞免
疫应答,在抗感染、急性排斥反应、器官移植排斥反应和自身免疫病的诱导过程中起重要作用。Th2细胞主要分泌IL-4、IL-5、IL-6、IL-9、IL-10、IL-13和GMCSF等,它主要介导体液免疫应答,辅助抗体生成,在过敏反应中起主导作用,使抗原特异的B细胞分泌IgG1和IgE抗体。此外,IL-18在IL-12存在下能够诱导T、B、NK细胞对IFN-γ的产生以及促进Th1细胞的分化;而IL-18在没有IL-12存在下,便会诱导T细胞、NK细胞和嗜碱性细胞产生IL-13和IL-4等Th2相关细胞因子,促进Th2细胞的分化。另外IFN-γ和IL-4可以分别代表Th1/Th2免疫应答的水平,目前研究中也多采用IFN-γ/IL-4的比值动态来代表Th1/Th2免疫平衡的状况。
Th1和Th2细胞除分泌不同的细胞因子进而发挥不同的免疫调节作用外,它们各自细胞的表面受体也是不同的。一方面,不同的表面受体可以作为分离Th1/Th2细胞的表面标志物(表1);另一方面,这种差异又直接影响Th1和Th2细胞对一些细胞因子的反应性,从而调控着Th1和Th2细胞的分化与功能(表2)[17]。
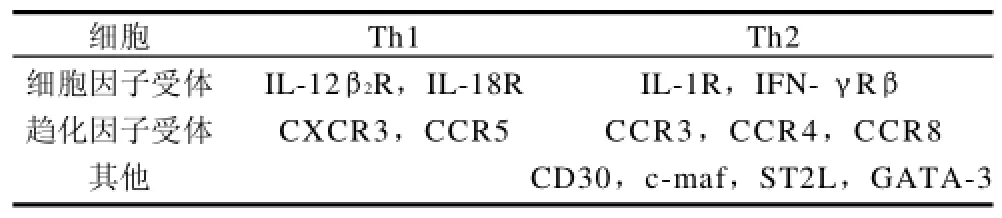
表1 Th1/Th2细胞表面标志Table 1 Surface markers of Th1/Th2 cells

表2 T细胞亚群的特征Table 2 Features of T-cell subpopulations
Th1和Th2细胞功能的正常和相互间保持平衡,是维持正常免疫功能和身体健康的基础,而Th1和Th2细胞功能的异常或失衡,常表现出平衡偏向其中一方,即发生“Th1/Th2平衡漂移”,这是引起多种免疫性疾病的根源。当Th1细胞占优势时,机体可产生细胞免疫亢进相关性疾病,当Th2细胞占优势时,机体可发生体液免疫亢进相关性疾病。其相关性疾病[18]有:1)与妊娠相关,Th1型细胞因子可直接或间接损伤胎儿胎盘组织,进而导致妊娠失败;Th2型细胞因子有利于正常妊娠;2)与过敏性疾病相关;3)与感染性疾病相关,Th1应答利于抗寄生虫感染疾病,Th2应答可加重寄生虫感染的疾病;4)与自身免疫性疾病相关,Th1优势应答多导致克隆氏病、胰岛素依赖性糖尿病和自身免疫性甲状腺炎等,Th2优势应答多见于系统性红斑狼疮、自身免疫性心脏病和Omenn综合症等。由此可见Th1和Th2细胞具有重要的免疫调节作用。此外Th1和Th2细胞所诱导的免疫反应可以相互调节或产生交叉调节作用。
2 乳铁蛋白对Th1和Th2细胞平衡影响的研究现状
人类免疫应答是一个高度复杂的调节系统和控制因子网络,病原体的入侵或机体衰老、损伤或压力作用会促使一系列的炎症细胞因子合成与分泌。诱发炎症的细胞因子与抗炎症的细胞因子之间的动态的和不断的相互作用和平衡是人类免疫系统的重要组成部分[19]。由此可知,乳铁蛋白对Th细胞影响的直接结果就是影响Th1和Th2细胞对细胞因子的分泌,从而对机体的免疫起作用。
2.1 乳铁蛋白对细胞因子影响的生理实验
Lee等[20]对无菌状态下生长的小猪喂食乳铁蛋白,随后对其静脉注射大肠杆菌脂多糖(LPS),结果表明:未喂食乳铁蛋白的对照组小猪死亡率高达73.7%,而喂食乳铁蛋白的小猪死亡率仅16.7%,由此证明喂食乳铁蛋白可以大大降低因内毒素而导致的致死性休克。另外,发现小鼠肠上皮细胞的CD4+、CD8+和肠上皮细胞内的IL-18均有所增多,而体表血液和脾中的CD4+、CD8+、唾液酸基GM1+细胞及其抵御结肠癌的细胞毒素的活性也均有所增加。
Haversen等[21]在正常雌鼠的膀胱中注射大肠杆菌,待30min后对其喂食人乳铁蛋白(hLF),结果发现雌鼠在感染病菌2h后尿道IL-6有所减少,24h后体系中的IL-6有所下降,这就表明人乳铁蛋白在此实验中增强了Th2型免疫功能,具有明显抗炎作用。
Togawa等[22]对由葡聚糖硫酸钠(DSS)诱导而患肠炎的小鼠进行生理实验,从喂食DSS的前3d直到最后死亡,这期间持续喂食乳铁蛋白,结果测得口服乳铁蛋白后,血液中的炎症前体细胞素、肿瘤坏死因子α和IL-1、IL-6明显下降,而抗炎症细胞素和白细胞介素IL-4、IL-10明显增加。也就是说此时的乳铁蛋白减弱了Th1型细胞功能,而增强了Th2型细胞的体液免疫功能,即对Th1和Th2细胞的平衡起到了改善作用。
Elass等[23]提出了一种抗炎症机制的假设,乳铁蛋白可能是通过作用于IL-18的产生来发挥抗炎症作用。
Artym等[24]对健康的小鼠先给予亚致死剂量的环磷酰胺使其体液免疫低下,再口服含0.5%牛乳铁蛋白的饮用水5周,结果发现调控小鼠体液免疫的Th2型细胞得到了部分修复。
Iigo等[25]对小鼠分别喂食牛乳铁蛋白、牛乳铁蛋白水解产物或转铁蛋白1~3h后,在小肠中发现IL-18的含量、半胱氨酸蛋白酶-1活性及IFN-γ的含量明显提升。然而,如果同样方法持续一周的喂食乳铁蛋白及其水解产物后,IL-18含量也明显增加,但对于转铁蛋白其作用很微小。此外实验还证明,在乳铁蛋白及其水解产物作用下,半胱氨酸蛋白酶-1活性的提高对于体内IL-18的含量有重要作用,同时也提高了T细胞和NK细胞对肿瘤细胞的杀伤作用。由此可知,在乳铁蛋白的作用下使得Th1型细胞的细胞免疫应答有所提高。
Takakura等[26]对健康的小鼠持续口服3d的牛乳铁蛋白或牛血清白蛋白后,取小鼠空肠和回肠中的肠上皮内淋巴细胞(IEL)及肠系膜淋巴结细胞(MLN),分别在有抗T细胞受体和无抗T细胞受体的环境中进行培养,然后取培养基上清液检测细胞因子。结果发现口服乳铁蛋白并不影响IEL和MLN中T细胞亚群的比例,但是LF却增强了刺激性的和非刺激性的IEL、MLN对IFN-γ及IL-10的含量。而MLN中IFN-γ的含量水平是和IL-10是有关的,这也就表明了口服乳铁蛋白可以影响健康小鼠中Th1和Th2对细胞因子的产生。
Zuccotti等[27]对患有先天感染人类免疫缺陷病毒(HIV)患儿抗逆转录病毒治疗的期间,让其口服乳铁蛋白,结果发现免疫细胞的吞噬作用、杀伤作用、Toll样受体表达及其IL-10、IL-12的比率均有所提高,促进了机体向Th2型细胞免疫功能的增强。
由以上的生理实验可以看出,当机体出现炎症或其他免疫力低下时,机体内的Th1/Th2细胞的平衡遭到了破坏,即很有可能发生了Th1/Th2平衡漂移,从而造成Th1细胞或Th2细胞所分泌的细胞因子数量偏多或偏少。而当给予适量的乳铁蛋白作用后,促进了Th1/Th2细胞的平衡,并使机体的免疫力低下得到了部分的改善。
2.2 乳铁蛋白的作用机理
近些年来对于乳铁蛋白的生物学功能研究有很多的报道,然而在食用乳铁蛋白后其免疫调节的作用机理方面,目前国内外对其作用途径推演主要有三方面:其一可能是肠上皮内存在有乳铁蛋白受体;其二可能是乳铁蛋白直接作用于肠上皮内的淋巴细胞;其三可能是通过作用于抗原呈递细胞(APC)后,诱导T细胞的分化来发挥作用。
Kuwata等[28]研究发现,作为免疫作用的食品,食用乳铁蛋白后,在胃肠道中并未完全水解,同时存在包括乳铁素(LfcinB)在内的肽类。然而乳铁蛋白及其水解产物能否进入血液循环发挥作用,根据Wakabayashi等[29]的研究结果表明,摄入的乳铁蛋白一般不会直接进入血液。而Fisher等[30]研究表明,乳铁蛋白摄入后,可以完整分子的形式通过小肠被转运到外周血,并在口服10~20min后停留在肝脏、肾脏、胆囊、脾脏等器官。但它又是如何作用于肠道免疫系统影响其宿主防御呢?根据Tomita等[9]对口服乳铁蛋白作用机理推演(图1),乳铁蛋白摄入后,部分被胃肠道中的蛋白酶水解成乳铁素等肽类,乳铁蛋白及其水解产物与内皮细胞和肠上皮内的免疫细胞(包括树突细胞和淋巴细胞)上的受体结合,被上述细胞吞噬,并激活细胞内的信使核糖核酸的形成基因,通过细胞因子和体液因子及免疫细胞的迁移使肠道免疫系统作用于病灶。
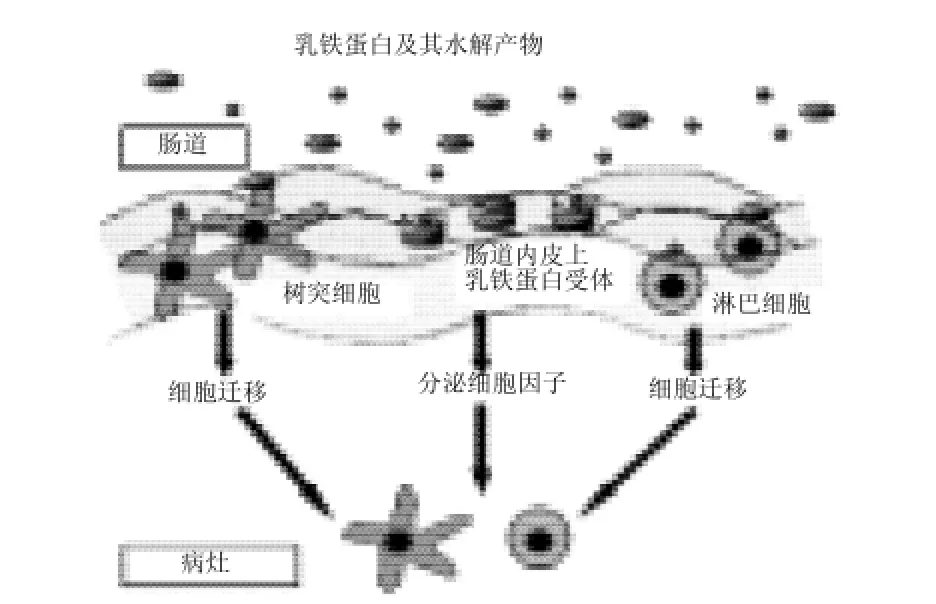
图1 乳铁蛋白及水解产物在肠道中发挥的免疫作用Fig.1 Immune function of lactoferrin and its hydrolysis in intestinal
Artym等[24]对体液免疫低下的小鼠口服乳铁蛋白后免疫有所提升,进一步研究发现,CD3+T淋巴细胞、CD4+T淋巴细胞、B淋巴细胞及小鼠腹膜巨噬细胞的数量和功能得到了重建修复,其作用可能是LF有效诱导IL-6和IL-10以外的细胞因子生成的结果。此外实验表明,如果对小鼠静脉注射乳铁蛋白,血液循环中则出现相当水平的IL-1,而该细胞因子的产生则是B细胞分化的重要因素。由此结合图1可以推测出,正是由于在乳铁蛋白的作用下促使原本失衡的Th1/Th2细胞分泌某些细胞因子,作用于病灶,使其Th1/Th2细胞的平衡有所改善,从而恢复了小鼠部分的免疫功能。
3 展 望
乳铁蛋白被公认为是一种天然的安全物质,服用后无任何不良作用,加之其具有许多特殊的生理功能,因此吸引了国内外众多的学者研究并得到了广泛的应用,尤其是在食品领域。例如乳铁蛋白作为保存剂、抗氧化剂、营养强化剂、免疫强化剂、免疫调节剂及助消剂等广泛应用于婴幼儿奶粉、发酵奶、口香糖、碳酸饮料和肉类保藏等食品工业。此外,乳铁蛋白也可以作为防腐剂应用于化妆品行业,作为抗菌剂、抗溃疡药、抗氧化剂和抗真菌剂在临床上应用,作为添加剂应用于饲料行业。
目前,国外乳铁蛋白已经实现了工业化的生产,而我国还是相对比较落后,对乳铁蛋白的生产还处于研究阶段。虽然国内外对于乳铁蛋白在食品行业中有所应用,但由于其LF在人体中作用机理的研究不是很清楚,所以,在食品行业中的应用还是存在着很大的市场潜力的,一旦对LF的免疫作用机理研究的比较透彻后,就能得到很好的利用并能为人类健康更好的服务。
[1] NAGASAKO Y, SAITO H, TAMURA Y, et al. Iron binding properties of bovine lactoferrin in iron rich solution[J]. J Dairy Sci, 1993, 76:1876-1881.
[2] ARNOLD R R, COLE M F, MCGHEE J R, et al. A bactericidal effect for human lactoferrin[J]. Science,1977, 197: 263-265.
[3] PIETRANTONI A, TINARI A, MARCHETTI M, et al. Bovine lactoferrin inhibits adenovirus infection by interacting with viral structural poly peptides[J]. Antimicrobial Agents and Chemotherapy, 2003, 47: 2688-2691.
[4] SHIN Y, TERAGUCHI H, TOMITA O, et al. Antibacterial activity of bovine lactoferrin and its peptides against enterohaemorrhagic Escherichia coli O157: H7[J]. Letters in Applied Microbiology, 1998, 26: 407-411.
[5] MATTSBY-BALTZER I, ROSEANU A, MOTAS C, et al. Lactoferrin or a fragment thereof inhibits the endotoxin induced interleukin-6 response in human monocytic cells[J]. Ped Res, 1996, 40: 257-262.
[6] BURRIND G, WANG H, HEATH J, et al. Orally administered lactoferrin increases hepatic protein synthesis in formula for new-bornpigs[J]. Paediatric Res, 1996, 40(1): 72-76.
[7] QIAN Zuyuan, JOLLES P, MIGLIORE-SAMOUR D, et al. Isolation and characterization of sheep lactoferrin, an inhibitor of platelet aggregation and comparison with human lactoferrin[J]. Biochim Biophys Acta, 1995, 1243: 25-32.
[8] PUDDU P, VALENTI P, GESSANI S. Immunomodulatory effects of lactoferrin on antigen presenting cells[J]. Biochimie, 2009, 91: 11-18.
[9] TOMITA M, WAKABAYASHI H, SHIN K, et al. Twenty-five years of research on bovine lactoferrin applications[J]. Biochimie, 2009, 91: 52-57.
[10] BAVEYE S, ELASS E, MAZURIER J, et al. Lactoferrin: a multifuctional glycoprotein involved in the modulation of the inflammatory process[J]. Clinical Chem Lab Med, 1999, 37: 281-286.
[11] RODRIGUES L, TEIXEIRA J, SCHMITT F, et al. Lactoferrin and cancer disease prevention[J]. Crit Rev Food Sci Nutr, 2009, 49(3): 203-17.
[12] KANYSHKOVA T G, BABINA S E, SEMENOV D V, et al. Multiple enzymic activities of human milk lactoferrin[J]. Eur J Biochem, 2003, 270: 3353-3361.
[13] HE J, FURMANSKI P. Sequence specificity and transcriptional activation in the binding of lactoferrin to DNA[J]. Nature, 1995, 373: 721-724.
[14] YAGI M, SUZUKI N, TAKAYAMA T, et al. Effects of lactoferrin on the differentiation of pluripotent mesenchymal cells[J]. Cell Biol Int, 2009, 33(3): 283-289.
[15] MOSMANN T R, CHERWINSKI H, BOND M W.Two types of murine helper T cell clone I definition according to profiles of lymohokine activities and secreted proteins[J]. J Immunol, 1986, 136: 2348-2357.
[16] MAGGIE E, BISWAR R, PNETE G D, et al. Accumulation of Th2 like helper T cells in the conjunctiva of patients with vernal conjunctivitis[J]. J Immunol, 1991, 146: 1169-1174.
[17] 吴亚娣. Th1/Th2细胞的表面受体及其功能调节[J]. 上海免疫学杂志, 2000, 20(5): 318-320.
[18] 顾国浩, 彭群新. Th1/Th2细胞的免疫功能变化及其意义[J]. 国外医学: 临床生物化学与检测学分册, 2003, 24(6): 333-334.
[19] 庞广昌. 食品免疫论[M]. 北京: 科学出版社, 2008.
[20] LEE W J, FAMER J L, HILTY M, et al. The protective effects of lactoferrin freeding against endotoxin lethal shock in gem free piglets[J]. Infect Immun, 1998, 66(4): 1421-1426.
[21] HAVERSEN L A, ENGHERG I, BALTZER L, et al. Human lactoferrin and peptides derived from a surface-exposed helical region reduce experiment Escherichia coli urinary tract infection in mice[J]. Infect Immun, 2000, 68(10): 16-23.
[22] TOGAWA J, NAGASE H, TANAKA K, et al. Oral administration of lactoferrin reduces colitis in rats via modulation of the immune system and correction of cytokine imbalance[J]. J Gastroenterol Hepatol, 2002, 17(12): 1291-1298.
[23] ELASS E, MASSON M, MAZURIER J, et al. Lactoferrin inhibits the lipopolysaccharide-induced expresssion and proteoglycanbinding ability of interleukin-8 in human endothelial cells[J]. Infect mmun, 2002, 70: 1860-1866.
[24] ARTYM J, ZIMECKI M, PAPROEKA M, et al. Orally administered lactoferrin restores humoral immune response in inmmunocompromised mice[J]. Immunol Leu, 2003, 89(1): 9-15.
[25] IIGO M, SHIMAMURA M, MATSUDA E, et al. Orally administered bovine lactoferrin induces caspase-1 and interleukin-18 in the mouse intestinal mucosa: a possible explanation for inhibition of carcinogenesis and metastasia[J]. Cytokine, 2004, 25: 36-44.
[26] TAKAKURA N, WAKABAYASHI H, YAMAUCHI K, et al. Influences of orally administered lactoferrin on Ifn-γ and IL-10 production by intestinal intraepithelial lymphocytes and mesenteric lymph-node cells [J].Biochem Cell Biol, 2006, 84: 363-368.
[27] ZUCCOTTI G V, VIGANO A, BORELLI M, et al. Modulation of innate and adaptive immunity by lactoferrin in human immuno-deficiency virus(HIV)-infected, antiretroviral therapy nate children[J]. Int J Antimicrob Agents, 2007, 29(3): 353-355.
[28] KUWATA H, YAMAUCHI K, TERAGUCHI S, et al. Functional fragments of ingested lactoferrin are resinstant to proteolytic degradation in the gastrointestinal tract of adult rats[J]. J Nutr, 2001, 131: 2121-2127.
[29] WAKABAYASHI H, KUWATA H, YAMUCHIN K, et al. No detectable transfer of dietary lactoferrin or its functional fragments to portal blood in healthy adult rats[J].Biosci Biotechnol Biochem, 2004, 68: 853-860.
[30] FISHER R, DEBBABI H, BLAIS A, et al. Uptake of ingested bovine lactoferrin and its accumulation in adult mouse tissues[J]. International Immunopharmacology, 2007, 7(10): 1387-1393.
Recent Research Progress in the Effect of Lactoferrin on the Balance of Th1/Th2 Cells
ZHANG Hao,HU Zhi-he
(Tianjin Key Laboratory of Food and Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Latoferrin is a kind of natural iron-bonding protein with a variety of specific physiological functions. This paper describes the importance of Th1/Th2 balance for immune function and summarizes recent advances in the effect of lactoferrin on Th1/Th2 balance. Meanwhile, application perspectives of lactoferrin are also put forward in this paper.
lactoferrin;T helper cell;Th1/Th2 balance
Q816
A
1002-6630(2010)17-0448-04
2010-06-27
张浩(1985—),男,硕士研究生,研究方向为食品生物技术。E-mail:zhanghao_dengdai@163.com

