半干型荔枝干玻璃化转变研究
蔡长河,陈玉旭,曾庆孝
(1.华南理工大学轻工与食品学院,广东 广州 510640;2.广东省农业科学院果树研究所,广东 广州 510640)
半干型荔枝干玻璃化转变研究
蔡长河1,2,陈玉旭1,曾庆孝1
(1.华南理工大学轻工与食品学院,广东 广州 510640;2.广东省农业科学院果树研究所,广东 广州 510640)
目的:确定冷冻干燥荔枝干的吸湿等温线,研究半干型荔枝干的玻璃化转变温度。方法:采用差示扫描量热法(DSC)。结果:半干型荔枝干的吸湿等温线与GAB模型拟合程度好,呈现出“J”形。半干型荔枝干的玻璃化转变温度为-77.35℃,经过退火处理后,玻璃化转变温度提高约10℃,基本消除反玻璃化峰。经冷冻干燥处理后的半干型荔枝干的玻璃化转变温度比半干型荔枝干产品的高约7℃。
荔枝;半干型荔枝干;玻璃化转变温度;保藏
中国是世界荔枝的主产区,占世界荔枝产量的3/5左右。在荔枝成熟的高峰季节,由于运输距离、不完善的冷冻设施和荔枝自身的特性,荔枝相当一部分的质量受到损失。通过干燥脱水制作荔枝干就成了低成本、可选择的保藏方式。随着消费者对脱水食品保持原果特性要求的增加,荔枝干等脱水食品的质量保藏显得尤为重要。量化由玻璃化转变引起的流动性变化有助于阐述加工和产品质量之间的联系。
本实验通过建立半干型荔枝干模型溶液体系及通过添加不同分子质量有机物质,研究半干型荔枝干的玻璃化转变,为半干型荔枝干的保藏提供指导。
1 材料与方法
1.1 材料、试剂与仪器
新鲜糯米磁荔枝采自广东从化荔枝园。
氯化锂、醋酸钾、氯化镁、碳酸钾、硝酸镁、氯化锶、氯化钠、溴化钾、氯化钾、氯化钡、硝酸钾均为国产分析纯;葡萄糖、果糖、蔗糖、三梨糖醇、麦芽糊精(DE=11~14)为食品级试剂。
TA1003 电子天平 上海精科天秤有限公司;Q200DSC 美国TA公司;U410立式超低温冰箱 美国Premium公司;New Brunswick Scientic冷冻干燥器 美国Thermo Electron公司;水分活度仪 美国Aqua Lab公司; JC101型电热鼓风干燥箱 上海成顺仪器仪表有限公司。
1.2 方法
1.2.1 平衡吸湿荔枝干样品的制备
选果肉饱满、无病虫害、成熟新鲜糯米磁荔枝,于采摘当日在实验室内按照蔡长河等[1]方法进行干燥脱水加工成半干型荔枝干。
取半干型荔枝干样品在-60℃完全冷冻,然后在10Pa、-20℃干燥20h,然后再在常压下20℃干燥5h。样品粉碎,放入盛有P2O5的干燥器中1~3周,得到绝干样品。
为获得水分活度为0.11~0.924的样品,将粉碎冷冻干燥后的样品置于称量皿中并于恒定水分活度的饱和盐溶液中平衡1~3周,湿度(干基)通过样品平衡前后的质量差计算。各标准饱和溶液在25℃时对应的水分活度值如表1所示。
将半干型荔枝干样品和经平衡吸湿后的样品切碎,取样品(15~20mg)进行DSC测定。
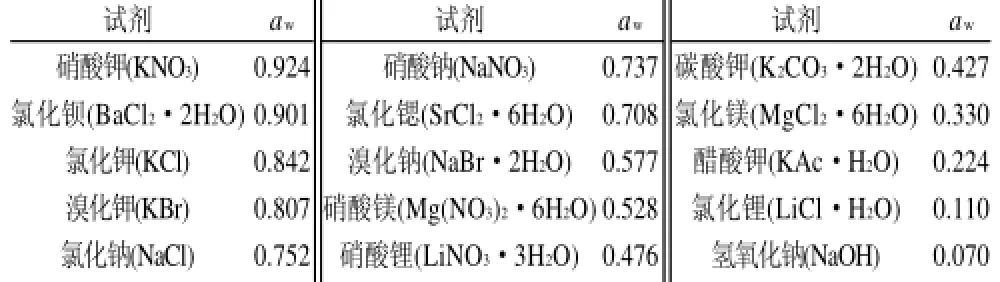
表1 标准饱和盐溶液的aw值(25℃)Table 1 Water activity of standard saturated salt solutions
1.2.2 半干型荔枝干玻璃化转变模型溶液的制备
测得半干型荔枝干中主要糖类物质葡萄糖、果糖、蔗糖的质量分数分别为23.49%、19.17%和10.97%,根据其质量比2.141:1.746:1配制水分质量分数为25%的三者混合糖溶液,分别配制水分质量分数为25%的葡萄糖溶液、果糖溶液、蔗糖溶液,模拟半干型荔枝干组成体系,作为研究半干型荔枝干玻璃化转变的模型溶液。
1.2.3 不同分子质量物质溶液浸泡半干型荔枝干样品的制备
将去皮去核的半干型荔枝干置于渗透液中进行处理。渗透液分别为质量分数20%的蔗糖、山梨糖醇、麦芽糊精(DE=11~14)溶液,料液比为1:2(m/V),在25℃浸泡2h,以蒸馏水为对照。渗透后的荔枝干放于蒸馏水中漂洗一下,在不锈钢网上沥干表面水分,然后在热风干燥箱中干燥到水分含量为28%左右时停止干燥,取出样品切碎。称取样品15~20mg进行DSC分析,其余样品进行aw的测定。
1.2.4 水分活度aw的测定
取在各饱和盐溶液环境中平衡后的荔枝干样品(2.00± 0.05)g,铺满水分活度仪样品盘,用水分活度仪进行测定。
1.2.5 玻璃化转变温度Tg的测定
取样品(15±0.1)mg置于小铝盘(2mm×5mm×7mm,质量10~12mg)中,使样品均匀铺满铝盘底部,密封。以高纯氮气(99.999%)为载气,以空铝盘作对照,采用以下扫描程序:

退火处理的扫描程序:在从-20℃以5℃/min的速率降温到-33℃后,保温30min,以5℃/min的速率降温到-90℃,其余扫描程序与不经退火处理的相同。
DSC曲线经Universal Analysis 2000 (TA 公司) 软件处理得到各样品玻璃化转变温度Tg(本实验取第一条切线和第二条切线的交点作为Tg)、反玻璃化峰温度Td和冰融化起始温度Tm及冰的融化焓ΔHm。进行3次平行样品测定。
1.2.6 数据处理
测定和分析结果采用SPSS15.0 for Windows 和Excel 2003进行数据处理,结果采用“平均值±标准差”表示。
2 结果与分析
2.1 吸湿等温线
在准备样品的热分析过程中,测定冷冻干燥荔枝干的样品在25℃下的吸湿等温线。冷冻干燥荔枝干的吸湿等温线呈现出典型高糖含量食品的形状,在低水分活度时,样品吸附水量较少;高水分活度时,吸附水量则迅速增加。由于荔枝是含果糖较多而聚合物较少的水果,其吸附等温线呈现出“J”形,很多关于热带水果的报道与此结果相似,如番石榴、芒果、菠萝、葡萄皮浆和柿子皮浆等[2-4]。采用GAB 模型(公式(1))对实验数据进行拟合,结果如图1所示。

式中:Xws为水分含量(干基);aw为水分活度;Xm为单分子层水分含量;C、K为GAB模型中分别与单分子层和多分子层相关的模型参数。通过线性回归分析得出Xm=8.91(干基),C=0.053,K=0.865,r=0.9926。

图1 冷冻干燥荔枝干在25℃下的吸湿等温线Fig.1 Moisture sorption isotherm of freeze-dried litchi at 25℃
2.2 半干型荔枝干及冷冻干燥吸湿平衡样品玻璃化转变
2.2.1 未经退火处理的半干型荔枝干玻璃化转变
如图2 所示,半干型荔枝干玻璃化转变温度Tg=-77.35℃。在-25℃处曲线有明显的一个吸热峰。由于样品中未冻
结水放热结晶,在Td=(-33±0.5)℃处有一个明显的反玻璃化峰。国内外较多文献报道[5],未经退火处理的DSC曲线都有明显的反玻璃化峰的出现。

图2 半干型荔枝干未经退火处理的DSC曲线Fig.2 Typical DSC thermogram of semi-dried litchi without annealing treatment

图3 半干型荔枝干经退火处理的DSC曲线Fig.3 Typical DSC thermogram of semi-dried litchi with annealing treatment
如图3 所示,在Td=-33℃,退火30min,经退火处理的半干型荔枝干玻璃化转变温度Tg=-66.94℃。较之未经退火处理的半干型荔枝干样品,其玻璃化转变温度提高了约10℃,吸热峰和反玻璃化峰消失。有文献报道[6-7],经退火处理后样品的玻璃化转变温度会有所提高,也有助于消除反玻璃化峰。本实验发现,在Td处退火处理30min,即可达到目的。
2.2.3 未经退火处理的冷冻干燥半干型荔枝干玻璃化转变

图4 半干型荔枝干冷冻干燥后未经退火处理的DSC曲线Fig.4 Typical DSC thermogram of freezing-dried semi-dried litchi without annealing treatment
半干型荔枝干经冷冻干燥后在aw=0.752的氯化钠饱和溶液中平衡吸湿10d,其aw=0.621,Xw=0.2168g/g,未经退火处理,其DSC曲线如图4所示。
由图4可知,冷冻干燥半干型荔枝干玻璃化转变温度Tg=-70.90℃,比半干型荔枝干玻璃化转变温度提高约7℃。由于冷冻干燥处理样品水分含量降低,水的增塑作用降低,使玻璃化转变温度提高。值得注意的是此样品虽未经退火处理,在-22~-33℃之间出现的反玻璃化峰却不明显,也没有出现明显吸热峰,这可能是经冷冻干燥处理平衡吸湿后的样品含未冻结水较少的缘故。
2.3 半干型荔枝干模型溶液的玻璃化转变

图5 水分质量分数为25%糖溶液DSC曲线Fig.5 DSC thermogram of sugar solutions with water content of 25%
如图5所示,葡萄糖的玻璃化转变温度Tg=-46.14℃,在-20℃处有一个明显的吸热峰;果糖的玻璃化转变特征不如葡萄糖明显,玻璃化转变温度Tg=-30.57℃,没有明显的吸热峰,仅在-73℃附近有一个小吸热峰;蔗糖的玻璃化转变特征也不如葡萄糖明显,玻璃化转变温度Tg=-51.41℃,与刘宝林等[8]报道的-46~-32℃较
为接近。在-15℃附近有一个明显的吸热峰,与果糖类似,在-75℃附近有一个小吸热峰。
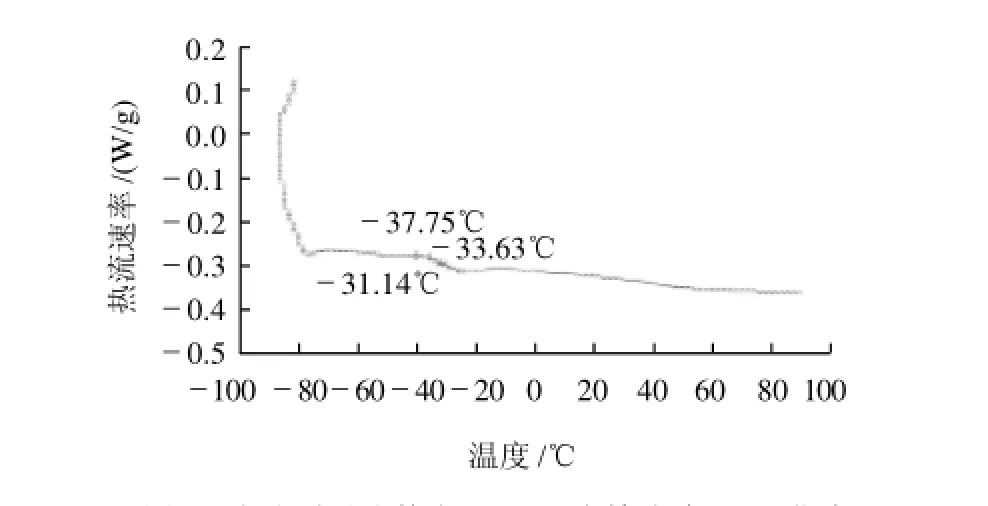
图6 水分质量分数为25%混合糖溶液DSC曲线Fig.6 DSC thermogram of mixed sugar solution with water content of 25%
如图6所示,混合糖溶液的玻璃化转变温度Tg=-37.75℃,介于相同水分含量的单一组分葡萄糖和果糖溶液的玻璃化转变温度-46.14~-30.57℃之间,远低于相同水分含量的蔗糖溶液玻璃化转变温度-51.41℃。在-75℃附近有一个小吸热峰,这与单一果糖和蔗糖溶液的DSC曲线相似。
Slade 等[9]指出尽管糖类的Tg和分子质量有普遍的相关性,但也要注意到在一系列的化合物中,即使是相同的分子质量,由于化学结构不同,Tg也明显不同。本实验表明,利用与半干型荔枝干水分含量相同的葡萄糖、果糖和蔗糖溶液的玻璃化转变参数不能准确地预测半干型荔枝干的玻璃化转变温度。可能是体系的不同对玻璃化转变温度的影响很大。
Sopade 等[10]对5种澳大利亚糖蜜的玻璃化转变现象研究发现,无定形葡萄糖、果糖和蔗糖玻璃化转变参数不能精确地预测糖蜜的玻璃化转变。Shirke等[11]采用磷光强度衰减法研究了分散于无定形葡萄糖、麦芽糖和麦芽三糖的分子流动性和玻璃化转变发现,基质分子流动性的平均比率和基质流动性比率的分散宽度在玻璃化转变附近,在这同系列的糖中随着分子质量的增大而增加。
2.4 添加不同分子质量物质对半干型荔枝干玻璃化转变的影响

图7 半干型荔枝干经质量分数20%蔗糖溶液浸泡后的DSC曲线Fig.7 Typical DSC thermogram of semi-dried litchi after immersion with 20% sucrose solution
Seo等[12]采用Gordon-Taylor公式分析研究了单糖、双糖和三糖混合物的玻璃化转变温度,指出糖类的大小和形态对于混合物的玻璃化转变起着非常重要的作用。Rizzolo 等[13]在研究不同分子质量添加物对冷冻草莓汁玻璃化转变温度的影响时发现,添加20%麦芽糖能将玻璃化转变温度提高约8℃,而山梨糖醇、葡萄糖和果糖混合物对提高冷冻草莓汁的玻璃化转变温度作用不大。
半干型荔枝干经过质量分数20%蔗糖溶液浸泡处理后,再干燥到水分含量为25%,其DSC曲线如图7所示。其玻璃化转变温度Tg=-69.13℃,比半干型荔枝干玻璃化转变温度(图2)提高约10℃。在-18~-24℃之间有一个不明显的反玻璃化峰,Tg=-19.68℃。
图8是用山梨糖醇溶液经过与蔗糖溶液相同处理后的半干型荔枝干DSC曲线。其玻璃化转变温度Tg=-53.53℃,比半干型荔枝干玻璃化转变温度(图2)提高约25℃。没有明显的反玻璃化峰。D-山梨糖醇被用作抗冻剂以提高玻璃化转变温度和降低融熔点。Rubinson等[14]、焦岩等[15]指出未冻结水的状态对冷冻食品贮藏质量和贮藏寿命有很大影响。
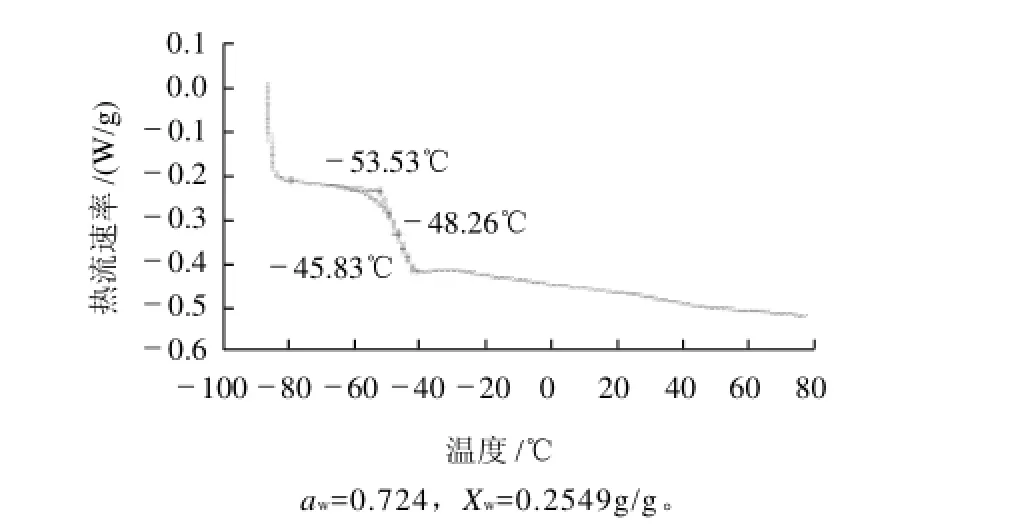
图8 半干型荔枝干经质量分数20%山梨糖醇溶液浸泡后的DSC曲线Fig.8 Typical DSC thermogram of semi-dried litchi after immersion with 20% sorbitol solution
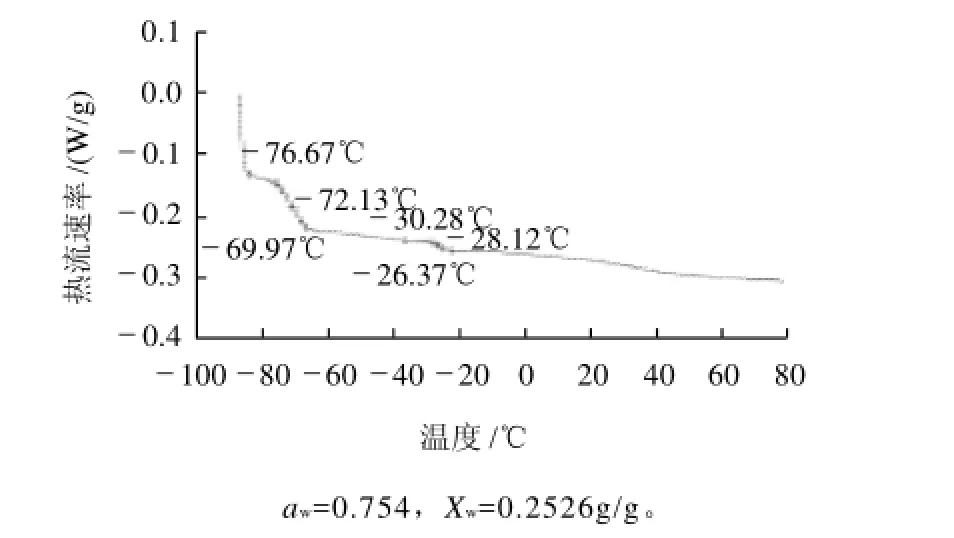
图9 半干型荔枝干经质量分数20%麦芽糊精溶液浸泡后的DSC曲线Fig.9 Typical DSC thermogram of semi-dried litchi after immersion with 20% maltodextrin solution
图9是用麦芽糊精溶液经过与蔗糖溶液相同处理后的半干型荔枝干DSC曲线。其玻璃化转变温度Tg=-76.67℃,与半干型荔枝干玻璃化转变温度(图2)很接近,说明添加
麦芽糊精对半干型荔枝干的玻璃化转变温度影响不大。在-26~-32℃之间有一个不明显的反玻璃化峰,Td=-30.28℃。
3 结 论
3.1 半干型荔枝干的吸湿等温线与GAB模型拟合程度好,呈现出“J”形。与大多数亚热带水果的吸湿等温线相似,平衡湿度越高,对应的水分活度越大。
3.2 半干型荔枝干的玻璃化转变温度为-77.35℃,经过退火处理后,玻璃化转变温度提高约10℃,基本消除反玻璃化峰。经冷冻干燥处理后的半干型荔枝干的玻璃化转变温度比半干型荔枝干的高。
3.3 半干型荔枝干模型溶液体系的玻璃化转变温度不能准确地预测半干型荔枝干产品的玻璃化转变温度。
3.4 半干型荔枝干产品用不同分子质量物质溶液浸泡处理,其中蔗糖和山梨糖醇能明显提高其玻璃化转变温度,麦芽糊精对其影响则不大。
[1]蔡长河, 张爱玉, 袁沛元, 等. 半干型荔枝干的加工技术研究[J]. 福建果树, 2003(4): 32-33.
[2]HUBINGER M, MENEGALLI F C, AGUERRE R J, et al. Water adsorption isotherms of guava, mango and pineapple[J]. Journal of Food Science, 1992, 57(6): 1405-1407.
[3]GABAS A L, TELIS-ROMERO J, MENEGALLI F C. Thermodynamic models for water sorption by grape skin and pulp[J]. Drying Technology, 1999, 17(4/5): 961-974.
[4]TELIS V R N, GABAS A L, MENEGALLI F C, et al. Water sorption thermodynamic properties applied to persimmon skin and pulp[J]. Thermochimica Acta, 2000, 343(1/2): 49-56.
[5]HUBINGER M, MENEGALLI F C, AGUERRE R J, et al. Water adsorption isotherms of guava, mango and pineapple[J]. Journal of Food Science, 1992, 57(6): 1405-1407.
[6]GABAS A L, TELIS-ROMERO J, MENEGALLI F C. Thermodynamic models for water sorption by grape skin and pulp[J]. Drying Technology, 1999, 17(4/5): 961-974.
[7]WANG Haiying, ZHANG Shaozhi, CHEN Guangming. Glass transition and state diagram for fresh and freeze-dried Chinese gooseberry[J]. Journal of Food Engineering, 2008, 84: 307-312.
[8]刘宝林, 华泽钊. 影响蔗糖溶液玻璃化转变温度的几个因素[J]. 华东工业大学学报, 1997, 19(3): 31-36.
[9]SLADE L, LEVINE H. Water and the glass transition-dependence of the glass tranasition on composition and chemical structure: special implications for our functionality in cookie baking[J]. Journal of Food Engineering, 1994, 22: 143-188.
[10]SOPADE P A, LEE S B, WHITE E T, et al. Glass transition phenomena in molasses[J]. LWT, 2007, 40: 1117-1122.
[11]SHIRKE S, LUDESCHER R D. Molecular mobility and the glass transition in amorphous glucose, maltose, and maltotriose[J]. Carbohydrate Research, 2005, 340: 2654-2660.
[12]SEO J A, KIM S J, KWON H J, et al. The glass transition temperatures of sugar mixtures[J]. Carbohydrate Research, 2006, 341: 2516-2520.
[13]RIZZOLO A, NANI R C, VISCARDI D, et al. Modification of glass transition temperature through carbohydrates addition and anthocyanin and soluble phenol stability of frozen blueberry juices[J]. Journal of Food Engineering, 2003, 56: 229-231.
[14]RUBINSON K A, LADNER J E, TORDOVA M, et al. Cryosalts: suppression of ice formation in macro-molecular crystallography[J]. Acta Cryst, 2000, 56: 996-1001.
[15]焦岩, 刘宝林, 周顺华. 未冻水与冻结食品质量的关系[J]. 冷饮与速冻食品工业, 2000(4): 1-3.
Preliminary Study on Glass Transition of Semi-dried Lichi
CAI Chang-he1,2,CHEN Yu-xu1,ZENG Qing-xiao1
(1. College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510640, China;2. Institude of Fruit Tree Research, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China)
In order to explore a moisture absorption isotherm and glass transition temperature of semi-dried litchi for long-term preservation, the glass transition temperature of semi-dried litchi was determined by using differential scanning calorimetry. Results indicated that the moisture absorption isotherm of semi-dried litchi exhibited an excellent fitting with GAB isotherm model to reveal a "J" shaped. The glass transition temperature (Tg) of semi-dried litchi was between -77.35 ℃ and 65.51 ℃. After the annealing treatment, the glass transition temperature was increased by 10 ℃ and devitrification peaks were eliminated. After freeze-drying treatment, the glass transition temperature semi-dried litchi was increased by 7 ℃.
litchi;semi-dried litchi;glass transition temperature;preservation
TS205.1
A
1002-6630(2010)23-0088-05
2010-08-29
广州市科技计划项目(2007Z1-E0011)
蔡长河(1964—),男,研究员,博士研究生,主要从事果品加工研究。E-mail:cch8876@126.com

