乳清蛋白酶解物促嗜酸乳杆菌增殖作用研究
白凤翎,李晓东,廖 玲,张柏林,*,金 苏,汪 涛,蒋湘宁
(1.北京林业大学生物科学与技术学院,北京 100083;2.渤海大学生物与食品科学学院,辽宁 锦州 121000)
乳清蛋白酶解物促嗜酸乳杆菌增殖作用研究
白凤翎1,2,李晓东1,廖 玲1,张柏林1,*,金 苏1,汪 涛1,蒋湘宁1
(1.北京林业大学生物科学与技术学院,北京 100083;2.渤海大学生物与食品科学学院,辽宁 锦州 121000)
利用胃蛋白酶水解乳清蛋白,获得酶解产物的优化工艺条件是pH值为2.2,水解温度为65℃,底物质量浓度为2g/100mL,酶与底物比为7%,其蛋白水解度为12.51%。乳清蛋白水解物与经过超滤和凝胶过滤后的分离物对嗜酸乳杆菌B有较好的增殖作用,其中分子量1000D以下的酶解产物增殖效果最为显著。质谱分析证实该段水解产物是分子量集中在213.2~956.9D之间的寡肽和氨基酸复合物,可使嗜酸乳杆菌B活细胞数量提高一个对数级。显然,应用廉价乳清蛋白水解产物作为培养基质可以提高嗜酸乳杆菌B的细胞数量。
乳清蛋白酶解物;嗜酸乳杆菌B;增殖
嗜酸乳杆菌(Lactobacillus acidophilus)主要来源于宿主(人和动物)的肠道系统。当外源口服足够数量时,嗜酸乳杆菌具有缓解乳糖不耐受症、调整肠道系统内有益和有害微生物菌群的平衡、改善机体免疫能力、降低血清胆固醇及抑制肿瘤形成等多种生理功能,是我国卫生部列出的9类益生菌之一[1]。按国际和国内规定要求,益生菌在货架期内的活菌数目不得少于106CFU/mL 或106CFU/g,否则不能产生渴望的健康诉求[1-2]。然而,由于自身生长特性及环境因素的影响,流通进入市场的益生菌产品中的活菌数量很低,往往无法满足其产品的质量要求,因此提高嗜酸乳杆菌的活菌含量则成为大规模益生菌制剂生产中的一项重要研究内容[3]。通常,包括嗜酸乳杆菌在内的乳酸菌大规模培养时,有必要添加一些富含维生素和氨基酸等生长因子的物质对其进行增殖,以便在细胞高密度培养时获得大量的活细胞。其中,氨基酸除了满足乳酸菌生长之外,对乳酸菌的生长还具有刺激作用[4]。国内外的部分研究证明,添加乳清蛋白和酪蛋白水解物对乳酸菌具有增殖效果[5-6]。添加乳清蛋白、酪蛋白及胱氨酸等到乳酸菌培养介质中可明显改善乳酸菌的生长,加入还原剂不仅提高了某些乳酸菌的耐氧效果,而且可以使酸奶中嗜酸乳杆菌和双歧杆菌的存活期限显著延长[7-9]。
本实验旨在以蛋白含量34.7%的乳清蛋白作为底物,用胃蛋白酶对其进行酶解,确定酶解乳清蛋白的优化工艺条件,再对其酶解产物进行分级过滤后,研究不同分子量范围的乳清蛋白水解产物(whey pro tein hydrolysate,WPH)对嗜酸乳杆菌的增殖效果,为提高益生菌的活菌数量探索一条新的途径。
1 材料与方法
1.1 材料
1.1.1 菌种及培养条件
嗜酸乳杆菌B(Lactobacillus acidophilus B)由波兰罗兹技术大学发酵工程与工业微生物系工业微生物菌种收藏中心(Lock 105)提供。冷冻干燥的供试菌株首先按体积分数10%的接种量被转接到MRS液体培养基中,37℃厌氧培养24h。每次测试前,菌株B均在MRS液体培养基中活化两次,37℃厌氧过夜培养,以便充分恢复活力。
1.1.2 培养基
MRS培养基(g/L):蛋白胨10.0、葡萄糖20.0、牛肉膏 10.0、酵母膏 5.0、无水乙酸钠5.0、柠檬酸二铵2.0、吐温-80 1.0mL、硫酸镁 0.58、硫酸锰 0.28、琼脂15.0、pH6.2~6.4;改良乳酸菌增殖培养基(g/100mL):葡萄糖 2.0、酵母膏0.25、西红柿汁 10.0m L、盐溶液甲(KH2PO4和K2HPO4各5g溶于50mL水中)和盐溶液乙(0.1g NaCl、0.1g FeSO4和 0.1g MgSO4溶于50mL水中)各5.0mL,吐温-80 1.0mL。
1.1.3 试剂
乳清浓缩蛋白(whey protein concentrate,WPC,蛋白含量为34.7%,乳糖含量为58.6%) 河北天香乳业有限公司;茚三酮 北京化学试剂厂;牛血清白蛋白北京鼎国生物科技有限公司;酪氨酸标准物、胃蛋白酶P-700、低分子量标准蛋白 美国Sigma 公司;丙烯酰胺、N,N-甲叉双丙烯酰胺、S D S、葡聚糖凝胶SephadexG-25、G-15 北京欣经科生物技术有限公司。
1.2 方法
1.2.1 乳清蛋白水解工艺
以34.7%乳清蛋白为底物,选用胃蛋白酶在前期单因素试验基础上,参照文献[10]进行蛋白水解正交试验,水解后95℃灭酶5min,5000r/min离心5min取上清液,按文献[11]测定WPH中氨基酸和多肽的含量,计算水解度(DH)。
DH /%=c×(1/1000m)×V1×(100/V2) ×100
式中:c为蛋白质质量浓度/(g/L);m为WPC的质量/g;V1为水解液的总体积/mL;V2为显色时所用稀释液的总体积/mL。
1.2.2 乳清蛋白WPH的超滤分级
取乳清蛋白水解液100mL,用水稀释至500mL,选用标准分子量为10、8、5kD的 Biomax系列滤膜进行三级超滤分级,将大于10kD、8~10kD、5~8kD和小于5kD 4个分子量范围的水解产物分别收集,冷冻干燥后保存备用。
1.2.3 WPH的凝胶层析纯化
将交联葡聚糖凝胶Sephadex-G25用水溶胀后装入1.6cm×60cm的分离柱中,用床体积2~3倍的0.05mol/L乙酸溶液洗脱平衡,选择对嗜酸乳杆菌有显著增殖效果的组分(小于5kD)经10000r/min离心,0.45μm的纤维素膜过滤后上柱,收集多肽组分。
1.2.4 WPH的SDS-PAGE电泳分析
取乳清蛋白及水解度为12.09%的不同质量浓度的WPH(4.0、2.0、1.0、0.5mg/mL)与不同水解时间(0、2、4、6 h)的W P H,浓缩胶为5%,分离胶为12.5%,按文献[12]进行SDS-PAGE分析获得蛋白电泳图谱。
1.2.5 WPH对嗜酸乳杆菌B的增殖作用
将嗜酸乳杆菌B在MRS培养基进行活化后,以1.0%接种量接种于改良乳酸菌增殖培养基。在增殖实验组中分别添加WPC、乳清蛋白酸水解物、WPH、经超滤分离的WPH各级组分(分子量大于10kD、10~8kD、8~5kD、小于5kD)以及以最优工艺条件不同酶解时间(6、4、2、0h)的WPH,添加量为0.015g/100mL,同时以乙酸铵(无机氮源)为对照组,使各组培养基的含氮量及pH值相等。每组分做4个平行实验,37℃温箱培养,每隔一定时间测定OD600nm和pH值,同时按文献[13]以质量浓度0.15g/100mL蛋白胨溶液进行10倍系列稀释后,选择合适的稀释度用MRS培养基进行嗜酸乳杆菌活菌计数。
1.2.6 WPH的质谱分析
在电喷雾离子化/质谱下(ESI/MS,Fragmentor∶70),对嗜酸乳杆菌B具有增殖活性组分(<5kD)应用API3000进行阳离子全面扫描。
1.2.7 统计分析
所有实验数据重复测定3次,结果为平均值±标准差。实验数据用Excel 2003进行单因素方差分析和显著性差异分析。
2 结果与分析
2.1 乳清蛋白水解工艺优化
从表1可以看出,影响胃蛋白酶水解乳清蛋白水解度的4个因素依次是酶与底物比、pH值、底物质量浓度和温度,其中pH值和酶与底物比影响程度相近,优化工艺组合为A3B3C2D3。基于优化组合条件,乳清蛋白酶解4h后的水解度实测值为12.51%,略高于表1中最大水解度预测值12.09%。由此,可以确定胃蛋白酶酶解乳清蛋白的最佳条件为pH2.2、酶解温度65℃、底物质量浓度2g/100mL、酶与底物比7%。

表1 胃蛋白酶酶解乳清蛋白正交试验L9(34)设计与结果Table 1 Design and results of orthogonal test for whey protein hydrolysis
2.2 WPH超滤分级和电泳分析
WPH经超滤后分别获得了大于10kD、8~10kD、5~8kD和小于5kD四级分离物,分别称之为组分Ⅰ、组分Ⅱ、组分Ⅲ和组分Ⅳ。对WPH酶解产物和乳清蛋白不同质量浓度的SDS-PAGE电泳分析(图1)可以看出,所有质量浓度下的乳清蛋白均呈现出清晰的蛋白泳带,但对WPH来说,仅有质量浓度为4.0mg/mL的水解产物呈现略微清晰的泳带(分子量接近于18.4kD),因此选择4.0mg/mL作为比较乳清蛋白酶解状况的基准质量浓度。
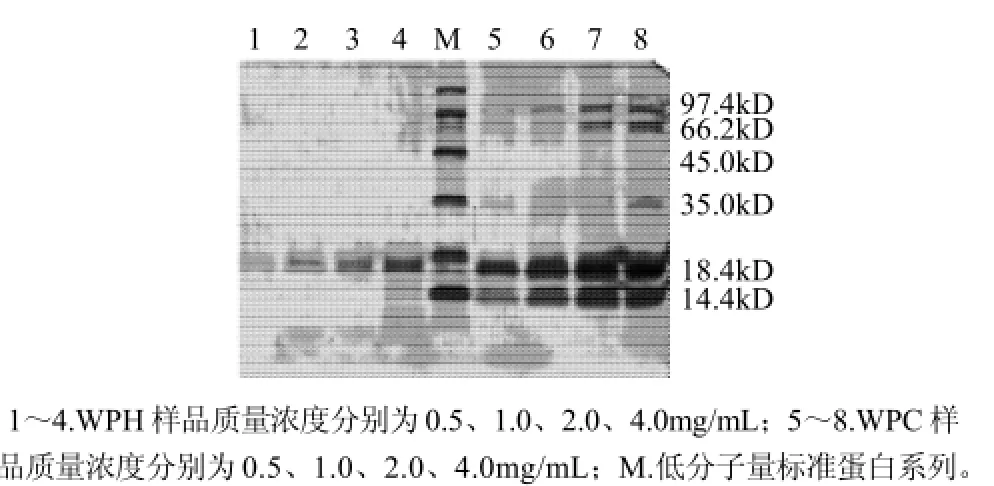
图1 不同样品质量浓度下SDS-PAGE图Fig.1 SDS-PAGE of whey protein hydrolysates with different concentrations

图2 不同酶解时间的WPH的SDS-PAGE图Fig.2 SDS-PAGE of whey protein hydrolysates obtained from different hydrolysis times
由图2可以看出,当酶解2h后,乳清蛋白酶解产物仅呈现出一条清晰的分子量接近18.4kD的蛋白带,但4h以后酶解产物并不能呈现蛋白条带,这意味着蛋白基本被酶解成小的片断。因此,在优化工艺条件下酶解4h后,可以推测乳清蛋白基本上被水解为小分子多肽及氨基酸。
2.3 WPH的凝胶层析纯化
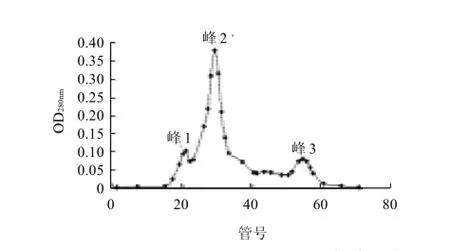
图3 WPH(<5kD)Sephadex-G 25凝胶层析图谱Fig.3 Chromatograph of whey protein hydrolysates separated by Sephadex-G 25
分子量小于5kD的WPH组分Ⅳ经Sephadex-G25凝胶过滤层析后得到3个峰(图3),进一步分别收集不同峰的组分,称为组分Ⅳ-1、Ⅳ-2和Ⅳ-3并冷冻干燥后备用。经茚三酮法[10]对组分Ⅳ-1、Ⅳ-2和Ⅳ-3进行测定,结果表明组分Ⅳ-1和Ⅳ-2含有一定量的肽,而组分Ⅳ-3含量很少。因此,选择组分Ⅳ-1和Ⅳ-2分别进行嗜酸乳杆菌B增殖实验研究。
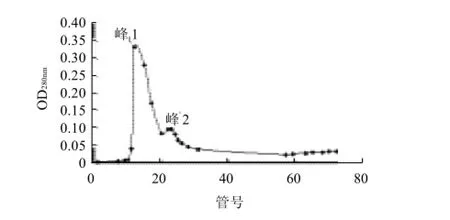
图4 WPH组分Ⅳ-2 Sephadex-G 15凝胶层析图谱Fig.4 Chromatograph of the fraction 2 from whey protein hydrolysates separated by Sephadex-G 15
图4是WPH组分Ⅳ-2经Sephadex-G15柱过滤层析的结果,从组分Ⅳ-2可以得到两个峰,收集后称为组分Ⅳ-21和Ⅳ-22,分别对嗜酸乳杆菌B进行增殖实验研究。
2.4 WPH对嗜酸乳杆菌B的增殖研究
2.4.1 WPH对嗜酸乳杆菌B的增殖作用
以WPH作为添加物,同时以乳清蛋白和乳清蛋白酸水解物作为参照物进行嗜酸乳杆菌B增殖实验,结果见表2。
从表2的OD600nm值可以看出,在37℃培养12h后,与对照组(乙酸铵为碳源)相比,添加乳清蛋白或乳清蛋白酸水解物并没有显著改善嗜酸乳杆菌B的生长。然而,添加WPH后,嗜酸乳杆菌B培养12h的OD600nm值平均比对照组高0.119,差异显著,说明在培养基中添加WPH会对嗜酸乳杆菌B具有显著的增殖效果。

图6 嗜酸乳杆菌B在不同组分WPH作用下对数生长末期介质的pH值Fig.6 Media pH ofL. acidophilusB at the log growth phase under the aid of different fractions separated from whey protein hydrolysates

表2 WPH对嗜酸乳杆菌B的增殖效果Table 2 Effect of whey protein hydrolysates on the proliferation ofL. acidophilusB
2.4.2 不同分子量范围的WPH组分对嗜酸乳杆菌B的增殖作用
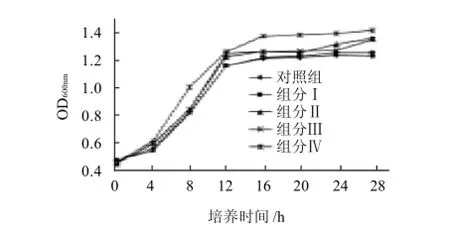
图5 不同分子量范围WPH对嗜酸乳杆菌B的增殖作用Fig.5 Effect of whey protein hydrolysates with various molecular weights on the proliferation ofL. acidophilusB
从图5可以看出,与对照组相同,添加组分Ⅰ后嗜酸乳杆菌B的生长没有太大变化;添加组分Ⅱ、组分Ⅲ和组分Ⅳ的OD600nm值较对照组有一定的增加,说明这3组成分对嗜酸乳杆菌B都有一定的生长促进作用,其中以组分Ⅳ的作用比较明显。
在对数生长末期(8h)后,对各WPH组分增殖培养介质的pH值测定结果见图6,显然各个组分与对照组之间培养介质在pH值上呈现明显差异,这从另一方面说明添加WPH组分后会加速嗜酸乳杆菌B的生长,从而引起介质的pH值快速下降。
2.4.3 WPH分离纯化组分对嗜酸乳杆菌B的增殖作用
由表3可见,与对照组相比,所有来自组分Ⅳ的WPH水解物均能明显促进嗜酸乳杆菌B的生长。同时,随着组分IV中分离物(多肽和氨基酸)的进一步被纯化,嗜酸乳杆菌B的OD600nm值逐渐增大,说明经过纯化的组分中含有嗜酸乳杆菌B的增殖因子。
进一步的活菌计数表明,WPH组分Ⅳ和Ⅳ-21对嗜酸乳杆菌B的增殖效果比对照组提高一个数量级(图7),这说明经过胃蛋白酶酶解的WPH对嗜酸乳杆菌B具有显著的增殖作用,且组分Ⅳ-21比组分Ⅳ增殖作用显著提高,可能是经过纯化后其中的WPH活性成分增多或增强的缘故。
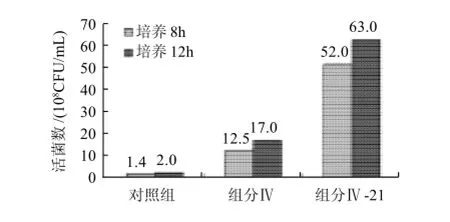
图7 WPH组分对嗜酸乳杆菌B的增殖作用Fig.7 Effect of different separation fractions of whey protein hydrolysates on the proliferation ofL. acidophilusB

表3 不同WPH分离组分对嗜酸乳杆菌B的增殖作用Table 3 Effects of different separation fractions from whey protein hydrolysates on the proliferation ofL. acidophilusB
2.5 WPH组分的质谱分析
对嗜酸乳杆菌B具有明显增殖作用的WPH组分Ⅳ-21进行质谱分析表明(图8,A图为Ⅳ-21组分的m/z 100~1500的POSITIVE FULL SCAN,B图为Ⅳ-21组分的m/z 200~600 POSITIVE FULL SCAN),WPH Ⅳ-21组分的相
对分子质量信息分别为m/z 379.3、402.0、478.9或m/z 535.8,这意味着组分Ⅳ-21是一些分子量在213.2~956.9D之间的一些2肽至8肽的寡肽混合物,表明分子量低于1000D的肽类和氨基酸复合物能显著促进嗜酸乳杆菌B的生长。
由于乳酸菌不能同化无机氮源,因此它们必须降解蛋白质和多肽来满足对氨基酸的需要,乳酸菌在乳中生长依靠其蛋白水解体系,该体系包括降解酪蛋白形成多肽片段的酶、转运寡肽进入细胞内的转运酶和细胞内部降解多肽为氨基酸的酶[14]。乳酸乳球菌在乳中生长所依赖氮源的98%来自于乳中的寡肽,其中寡肽转运系统发挥着非常关键的作用[15],如此说明乳酸乳球菌生长中多肽的形成、转运和降解具有非常重要的作用。虽然乳酸乳球菌胞外PI型蛋白酶水解β-酪蛋白就可产生100多种寡肽[16],但乳酸菌开始水解蛋白的能力很有限,一些必需氨基酸如亮氨酸、异亮氨酸和缬氨酸的含量很低[14],不能满足细菌生长的需要。因此,若提高乳酸菌的生长繁殖速度,在培养基中添加多肽和氨基酸是一条有效途径。同时乳清蛋白水解物对胞外多糖的形成和降低抗原性都具有很好作用[17-18],从而提高了乳制品的品质。以上实验结果表明在嗜酸乳杆菌B培养基中提供一些寡肽和氨基酸就能够加快氮源利用,使细胞繁殖很快达到一个较高的水平。

图8 组分Ⅳ-21质谱扫描全图Fig.8 Mass spectra of fraction 21 separated from whey protein hydrolysates
3 结 论
相对于乳清蛋白而言,胃蛋白酶酶解的WPH组分
能促进嗜酸乳杆菌B的生长,且随着WPH分离组分分子量的降低其增殖作用逐渐增强,分子量低于1000D的多肽和氨基酸复合物能更好的促进嗜酸乳杆菌B的生长。显然,在大规模益生菌制剂生产中,应用廉价乳清蛋白酶解产物作为培养基质能够提高益生菌的细胞数量。
[1]卫生部. 关于印发真菌类和益生菌类保健食品评审规定的通知[EB/ OL]. [2008-04-16].http∶//www.moh.gov.cn/pub/htm.
[2]STANTON C, GARDINER G, MEEHAN H, et al. Market potential for probiotics[J]. American Journal Clinical Nutrition, 2001, 73(Suppl)∶476-483.
[3]BRUHN C M, BRUHN J C, COTTER A C, et al. Consumer attitudes toward use of probiotic cultures[J]. Journal of Food Science, 2002, 67 (5)∶ 1969-1972.
[4]ASHRAF N H, JOSEPH F F. Starter cultures and their use[M]//ELMER H M, JAMES L S. Applied dairy microbiology. New York∶ Marcel Dekker, 2001∶ 167.
[5]李艾黎, 代敏, 霍贵成. 利用乳清培养基生产乳品发酵剂的研究[J].食品科学, 2006, 27(4)∶ 34-36.
[6]郭宇星, 陈庆森, 赵林森, 等. 酪蛋白水解物对发酵乳中乳酸菌增殖作用的研究[J]. 中国食品添加剂, 2006(增刊1)∶ 118-123.
[7]BURY D, JELEN P, KIMURA K. Whey protein concentrates as a nutrient supplement for lactic acid bacteria[J]. International Dairy Journal, 1998(8)∶ 149-151.
[8]DAVE R I, SHAH N P. Viability of yoghurt and probiotic bacteria in yogurts made from commercial starter cultures[J]. International Dairy Journal, 1997(7)∶ 31-41.
[9]DAVE R I, SHAH N P. Ingredient supplementation effects on viability of probiotic bacteria in yogurt[J]. Journal of Dairy Science,1998, 81(11)∶2804-2816.
[10]李晓东, 牛治霞, 张柏林. 乳清蛋白水解物水解度三种测定方法的比较[J]. 中国乳品工业, 2006, 34(10)∶ 59-62.
[11]贾建, 张丽萍. 胃蛋白酶水解乳清蛋白技术条件的优化[J]. 黑龙江八一农垦大学学报, 2007, 19(6)∶ 67-70.
[12]张杉, 陈敏, 李慧. SDS-PAGE 电泳测定乳清蛋白方法的研究[J]. 食品科技, 2008(1)∶ 215-219.
[13]DAVE R I, SHAH N P. Evaluation of media for selective enumeration of Streptococcus thermophilus, Lactobacillus delbrueckii ssp. bulgaricus, Lactobacillus acidophilus, and Bifidobacteria[J]. Journal of Dairy Science, 1996, 79∶ 1524-1536.
[14]TYNKKYNEN S, BUIST G, KUNJI E, et al. Genetic and biochemical characterization of the oligopeptide transport system of Lactococcus lactis[J]. Journal of Bacteriology, 1993, 175(23)∶ 7523-7532.
[15]JUILLARD V, BARS D L, KUNJI E R S, et al. Oligopeptides are the main source of nitrogen for Lactococcus lactis during growth in milk[J]. Applied and Environmental Microbiology, 1995, 61(8)∶ 3024-3030.
[16]JUILLARD V, LAAN H, KUNJI E R S, et al. The extracellular PI-type proteinase of Lactococcus lactis hydrolyzesβ-casein into more than one hundred different oligopeptides[J]. Journal of Bacteriology, 1995, 177 (12)∶ 3472-3478.
[17]ZISU B, SHAH N P. Effects of pH, temperature, supplementation with whey protein concentrate and adjunct cultures on the production of exopolysaccharides by Streptococcus thermophilus 1275[J]. Journal of Dairy Science, 2003, 86(11)∶ 3405-3415.
[18]KIM S B, KI K S, KHAN M A, et al. Peptic and tryptic hydrolysis of native and heated whey protein to reduce its antigenicity[J]. Journal of Dairy Science, 2007, 90(9)∶ 4043-4050.
Effect of Pepsin-based Whey Protein Hydrolysates on Proliferation of Lactobacillus acidophilus
BAI Feng-ling1,2,LI Xiao-dong1,LIAO Ling1,ZHANG Bo-lin1,*,JIN Su1,WANG Tao1,JIANG Xiang-ning1
(1. College of Biological Science and Biotechnology, Beijing Forestry University, Beijing 100083, China;2. College of Biotechnology and Food Science, Bohai University, Jinzhou 121000, China )
The optimal hydrolysis condition to obtain whey protein hyrolysates was pH 2.2, temperature at 65 ℃, substrate concentration of 2 g/100mL, and ratio between enzyme and substrate of 7%. The degree of hydrolysis (DH) reached up to 12. 51% whey protein. Whey protein hydrolysates and the fragments purified by ultra filtration and gel filtration exhibited an excellent proliferation effect on Lactobacillus acidophilus B. The fragments with molecular mass ranged from 213.2 to 956.9 D could promote this probiotic strain to grow 10 times faster than the control. Therefore, the addition of pepsin-based whey protein hydrolysates in media may be an economic and helpful strategy to improve the proliferation of probiotics.
whey protein hydrolysate;Lactobacillus acidophilus B;proliferation
TS252.1
A
1002-6630(2010)09-0161-05
2009-07-03
国家“863”计划项目(2008AA10Z335;2006AA10Z344)
白凤翎(1964—),男,教授,博士研究生,研究方向为食品微生物学与食品生物技术。E-mail:baifling@yahoo.com.cn
*通信作者:张柏林(1963—),男,教授,博士,研究方向为食品生物技术。E-mail:Zhangbolin888@126.com

