鲍鱼壳水溶性基质抗氧化活性研究
梁红宝,郭 葳,董声雄,伍久林,彭臻菲,刘志彬,张其清,2,*
(1.福州大学生物和医药技术研究院,福建 福州 350002;2.中国医学科学院生物医学工程研究所,天津 300192)
鲍鱼壳水溶性基质抗氧化活性研究
梁红宝1,郭 葳1,董声雄1,伍久林1,彭臻菲1,刘志彬1,张其清1,2,*
(1.福州大学生物和医药技术研究院,福建 福州 350002;2.中国医学科学院生物医学工程研究所,天津 300192)
考察鲍鱼壳水溶性基质(WSMA)抗氧化活性。利用DEAE-Sephadex A-25离子交换层析法(IEC)对WSMA进行纯化。以珍珠水溶性基质(WSMP)及VC为对照,通过对二苯代苦味肼基自由基(DPPH·)、羟自由基(·OH)、超氧阴离子自由基(O2·)的清除能力和Fe3+还原能力的研究考察其抗氧化作用。结果表明,WSMA与WSMP具有相似的Fe3+还原能力和O2·清除能力,而对DPPH·和·OH无清除作用。通过IEC纯化得到的AⅡ组分为主要活性成分,当质量浓度为1.0mg/mL时,对O2·清除率达80%,与0.1mg/mL的VC相当。
鲍鱼壳;水溶性基质;抗氧化性;离子交换层析
鲍鱼(abalone)属于软体动物,双壳纲,其壳由角质层、棱柱层、珍珠层组成,由95%的CaCO3和0.3%~5%的有机基质构成,有机基质主要存在于珍珠层。其水溶性有机基质含量约为0.03%~0.5%,由糖蛋白、磷蛋白、蛋白聚糖和黏多糖及一些简单蛋白质组成的异相混合物约占60%以上[1]。
在人体细胞代谢过程中,由于有氧的参与而产生一些活性氧(ROS),主要包括自由基,如超氧阴离子自由基(O2·)、羟自由基(·OH);一些非自由基,如H2O2、1O2[2]。ROS能够引起细胞膜磷脂成分的过氧化反应,导致H2O2的积聚,而H2O2很不稳定,容易产生·OH和1O2;ROS也能破坏一些非常重要的生物大分子,如:核酸、蛋白和多糖等,如果不能及时清除ROS,则会导致细胞的老化、死亡[3]。近年来,一些人工合成抗氧化剂已经应用到食品中辅助清除人体过量自由基,但是,由于合成抗氧化剂长期使用的安全性已经受到质疑,人们迫切需要天然无毒抗氧化剂的出现。
据文献[4]报道,珍珠水提取液能显著提高小鼠体内SOD活性和降低过氧化产物(MDA)的水平,有良好的镇静、养阴和抗氧化作用;珍珠层粉水解液能较好地清除超氧自由基[5-6]。近年来,由于珍珠价格的不断攀升,而贝壳珍珠层与珍珠具有非常相似的成分,因此人们把目标投向了用废弃的贝壳开发珍珠层粉。但是,由于珍珠层位于贝壳的最内层,而且很薄,利用物理或化学方法提取,不仅费时费力,而且很容易破坏所含的有机基质生物活性。因此,为了充分利用贝壳资源,本实验直接从贝壳粉中提取水溶性基质,并通过对二苯代苦味肼基自由基(DPPH·)、·OH、O2·3种自由基
的清除作用和Fe3+的还原能力来考察鲍鱼壳水溶性基质的抗氧化活性,以寻找天然的高效抗氧化剂。
1 材料与方法
1.1 材料与试剂
皱纹盘鲍(Haliotis discus hannai) 福建谊来鲍鱼制品有限公司;珍珠(pearl) 广西北海市铁山港区海瑞珍珠制品厂。
二苯代苦味肼基自由基(DPPH·) Alfa Aesar公司;黄嘌呤、黄嘌呤氧化酶 Roche公司;其余试剂均为国产分析纯。
1.2 仪器与设备
UV 1600紫外-可见光分光光度计 上海美谱达仪器有限公司;超声波清洗器 昆山市超声仪器有限公司;TGL-16C台式离心机 上海安亭科学仪器厂;RE-5210浓缩仪 上海亚荣生化仪器厂;SF-130C粉碎机 中国吉首市中城制药机械厂;电子天平 北京赛多利斯仪器系统有限公司;离子交换层析装置、RP-HPLC 日本岛津公司。
1.3 方法
1.3.1 样品制备
将鲍鱼壳冲洗干净自然晾干后,用粉碎机粉碎成80~120目的粉末。称取100g粉末放入200mL蒸馏水中,4℃搅拌溶解24h,取出混合液,残渣再用水提取两次后合并到混合液里,过滤后,4℃条件下以12000r/min离心20min,上清液即为鲍鱼壳水溶性基质(WSMA)。
同法制备珍珠水溶性基质(WSMP)。
1.3.2 DPPH·体系中抗氧化活性测定
[7]的方法:试管中依次加入:0.2mL样品溶液,1.8mL蒸馏水,2.0mL 2.0×10-4mol/L DPPH溶液,混合均匀后在室温下避光反应30min。在517nm波长处测定吸光度;空白为以等体积无水乙醇代替DPPH·溶液;对照为以等体积蒸馏水代替样品溶液。DPPH·清除率依据公式(1)计算。
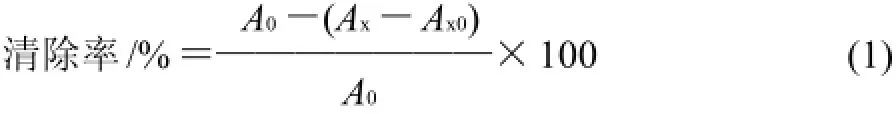
式中:Ax为加入样品后溶液的吸光度;Ax0为样品溶液本身的吸光度;A0为未加样品溶液的吸光度。
1.3.3 ·OH体系中抗氧化活性测定
参考文献[8]的方法:在试管中依次加入1.0mL 9.0mmol/L FeSO4,1.0mL 9.0mmol/L水杨酸-乙醇溶液,0.2mL样品溶液,1.0mL 8.8mmol/L H2O2,每加入1种试剂都要充分混匀,置于37℃水浴中保温45min,冷却至室温,于波长510nm处测吸光度。·OH清除率按照式(1)方法计算。
1.3.4 O2·体系中抗氧化活性测定
参考文献[9]的方法:在试管中依次加入1.0mL 75mmol/L磷酸盐缓冲液(pH7.8),待测样品0.2mL,0.1mol/L盐酸羟胺溶液0.1mL,75mmol/L黄嘌呤氢氧化钠溶液0.1mL,0.1U/mL黄嘌呤氧化酶0.1mL,摇匀后置于37℃水浴30min,加入2.0mL显色剂,静置10min后于530nm处测定吸光度。O2·清除率根据式(2)计算。
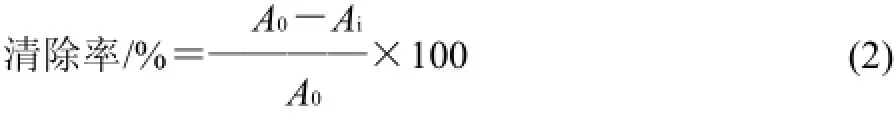
式中:Ai为加入抗氧化剂后的吸光度;A0为未加入抗氧化剂时的吸光度。
1.3.5 Fe3+还原能力测定
采用FRAP的方法测定Fe3+还原能力[7]:将200μL样品液同1.0 mL三价铁还原抗氧化能力测试工作液(FRAP) (0.2mol/L,pH3.6乙酸钠缓冲液、10mmol/L TPTZ和20mmol/L 三氯化铁以体积比10∶1∶1混合)混合,37℃反应10min,在593nm处测定吸光度。绘制样品- FeSO4质量浓度的标准曲线,以直线斜率表示还原能力的相对大小。
1.3.6 离子交换层析(IEC)分离
取100mL经过1kD透析袋透析后的WSMA上样于DEAE-Sephadex A-25离子交换层析柱。洗脱条件为:0~0.6mol/L NaCl 20mmol/L Tris-HCl(pH8.0)缓冲液120mL线性梯度洗脱,接着用2.0mol/L NaCl溶液洗脱,流速为1.0 mL/mi n,紫外检测2 8 0 n m波长处的光密度(OD280nm),自动收集器每管3mL收集洗脱液,并冷冻干燥,贮存备用。
1.3.7 活性组分主要成分分析
利用Bradford法[10]进行蛋白含量测定,以牛血清白蛋白为标准物,所得标准曲线为:Y=10.63X+0.0252,R2= 0.9907。利用苯酚-硫酸法[11]进行多糖含量测定,以葡萄糖为标准物,所得标准曲线为:Y=17.206X+0.0154,R2=0.9934。
2 结果与分析
2.1 WSMA自由基清除率测定结果
由图1可见,质量浓度为0.1、1.0、10mg/mL的WSMA对DPPH·和·OH的清除率都在5%以下,甚至出现负值,说明WSMA中可能存在一些具有氧化性的物质,而起到相反的作用。WSMA对O2·的清除率则从9.29%提高到50.02%。由此可见,WSMA的抗氧化性较强,且主要表现为清除O2·活性。当质量浓度为1.0mg/mL时,WSMA对O2·的清除率约为30%。
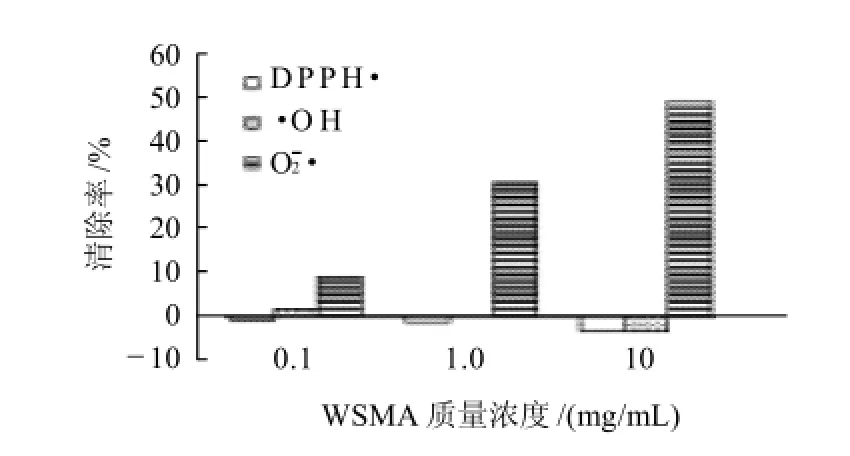
图1 不同质量浓度的WSMA对DPPH·、·OH和O2·的清除作用Fig.1 Scavenging capabilities of WSMA at various concentrations to DPPH·,·OH an d O2·
2.2 WSMA的IEC层析及对O2·清除能力测定
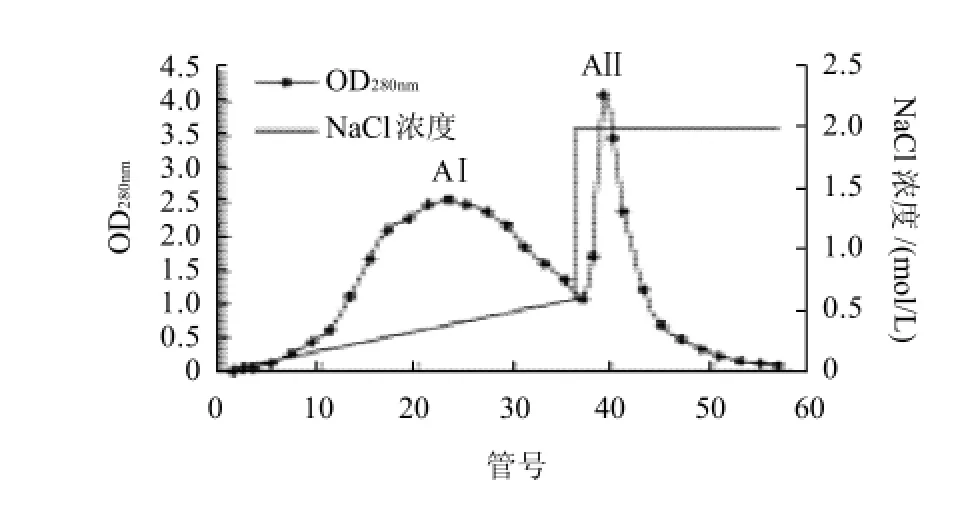
图2 WSMA在不同NaCl浓度下的洗脱曲线Fig.2 Elution profiles of WSMA at different salt concentrations
由图2可见,通过对WSMA进行离子交换分离,先用浓度为0~0.6mol/L NaCl溶液进行线性洗脱,可以得到一个比较宽的钟形峰,命名为AⅠ;再用2.0mol/L NaCl溶液洗脱,洗至无紫外吸收时,收集得到一个比较强的尖峰,命名为AⅡ。分别收集合并AⅠ、AⅡ峰尖部分洗脱液,进行O2·清除率测定。
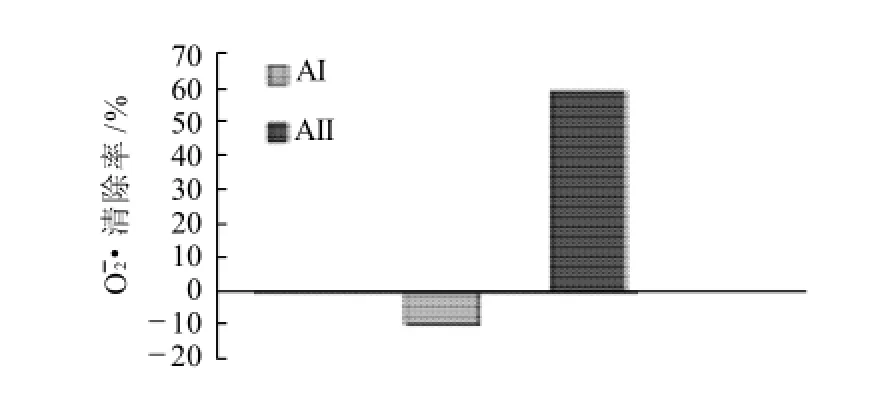
图3 AⅠ与AⅡ组分对O2·的清除作用Fig.3 Scavenging effects of AⅠ and AⅡ on O2·
由图3可知,组分AⅠ基本没有抗氧化活性,组分AⅡ具有较好的活性,对O2·清除率达到60%左右,因此,经过纯化的AⅡ为WSMA的主要抗氧化作用组分。2.3WSMP、WSMA和AⅡ对Fe3+的还原能力测定结果
由图4可知,FeSO4质量浓度在0~0.5mg/mL时,线性关系良好,回归方程Y=2.1237X+0.0072,R2=0.9999。在0~1.0mg/mL范围内,不同质量浓度样品对应FeSO4的质量浓度线性关系良好。WSMP、WSMA、AⅡ相应的回归直线的斜率分别为:0.037、0.047、0.11,可见AⅡ具有最强的还原能力,而WSMP 和WSMA则相对较弱。

图4 WSMA、AⅡ、WSMP对Fe3+的还原能力Fig.4 Reducing power of WSMA, AⅡ and WSMP to Fe3+
2.4 WSMP、WSMA和AⅡ对O2·清除能力的测定

图5 WSMA、WSMP、AⅡ与VC对O2·的清除率Fig.5 Scavenging effects of WSMA, WSMP, AⅡ and vitamin C on O2·
由图5可以看出,在0.01~1.0mg/mL质量浓度范围内,WSMP、WSMA对O2·具有相似的清除效果,尤其在质量浓度小于0.5mg/mL时,二者的清除率-质量浓度曲线基本重合。而组分AⅡ与WSMA、WSMP相比,清除率提高了1~1.5倍。质量浓度为1.0mg/mL的WSMP、WSMA对O2·清除率分别为39%和30%,而AⅡ则高达80%,与0.1mg/mL的VC清除能力相当。
此外,在0~1.0mg/mL范围内,WSMA、WSMP与AⅡ对O2·的清除率随着样品质量浓度的增大而增大,基本呈线性变化,表明三者的作用方式可能相同,而VC的作用曲线在0~0.1mg/mL范围内线性增大,此后速率不再随样品质量浓度变化而改变,与它们模式不尽相同,因而它们作用方式可能存在区别。O2·清除作用的机理一般有3种:1)抗氧化剂可以结合O2·形成一种更稳定的自由基而终止反应;2)抗氧化剂可能直接淬灭O2·;3)抗氧化剂可能干扰黄嘌呤氧化酶的活性,从而根本上消除了自由基的产生。对WSMA、WSMP与AⅡ对O2·的清除机理还需要进一步研究。
2.5WSMA和AⅡ蛋白和多糖含量的测定

表1 WSMA和AⅡ的蛋白和多糖含量的测定结果Table 1 Determination of proteins and polysaccharides in WSMA and AⅡ
由表1可知,WSMA中蛋白和多糖含量较低,而经过纯化后得到的AⅡ蛋白质量分数提高约10倍,达到3.5%,多糖含量也由1.3%提高到9.0%。由WSMA和AⅡ的外观来看,二者很可能都含有一些色素类物质,并且AⅡ中含量更高。与WSMA相比,AⅡ的蛋白、多糖、色素含量都明显增加,而抗氧化活性也随之增大,因此,可以推断它们可能对抗氧化活性都具有一定贡献。
由于鲍鱼壳成分复杂,仅仅通过透析和离子交换层析很难制得纯组分,许多研究[12-14]也证明了这一点。对AⅡ的进一步的分离纯化还有待下一步研究。
3 结 论
WSMA与WSMP相似,具有较好的Fe3+还原能力和O2·清除能力,而对DPPH·和·OH无清除作用。WSMA通过IEC纯化得到AII组分为主要活性成分,当质量浓度为1.0mg/mL时,对O2·清除率达80%,与0.1mg/mL的VC相当。AⅡ组分成分复杂,含有蛋白、多糖、色素等物质,都可能具有抗氧化活性,对它的进一步分离纯化工作还在进行。
参考文献:
[1]张刚生, 童银洪. 软体动物贝壳中的有机质研究进展[J]. 湛江海洋大学学报, 2000, 20(1)∶ 74-78.
[2]GULIN. Antioxidant and antiradical activities of L-carnitine[J]. Life Sci, 2006, 78(18)∶ 803-811.
[3]HALLIWELL B. Antioxidants in human health and disease[J]. Annu Rev Nutr, 1997, 16∶ 33-50.
[4]周大兴, 吴森林. 珍珠水提取液的抗炎、抗氧化作用[J]. 浙江中医学院学报, 2001, 25(4)∶ 41-42.
[5]戴俊, 段金廒, 李友宾, 等. 苏州产淡水珍珠生物活性评价及镇静活性物质基础研究[J]. 中国生化药物杂志, 2008, 29(5)∶ 294-298.
[6]高秋华, 黄开勋. 珍珠层粉水解液预防白内障的作用机理探讨[J]. 广东药学院学校, 1999(3)∶ 167-170.
[7]QIAO Deliang , KE Chunling, HU Bing, et al. Antioxidant activities of polysaccharides from Hyriopsis cumingii[J]. Carbohydrate Polymers, 2009, 78(2)∶ 199-204.
[8]LIU Chunhui, WANG Changhai, XU Zhiliang, et al. Isolation, chemical characterization and antioxidant activities of two polysaccharides from the gel and the skin of Aloe barbadensis Miller irrigated with sea water[J]. Process Biochemistry, 2007, 42∶ 961-970.
[9]陈春. TAT-PTD融合的hCu,Zn-SOD的表达、纯化和表征[D]. 福州∶ 福州大学, 2005∶ 53-59.
[10]WHIFFEN L K, MIDGLEY D J, MCGEE P A. Polyphenolic compounds interfere with quantification of protein in soil extracts using the Bradford method[J]. Soil Biology and Biochemistry, 2007, 39(2)∶ 691-694.
[11]WANG Zhaojing, LUO Dianhui, ENA Cai. Optimization of polysaccharides extraction from Gynostemma pentaphyllum Makino using uniform design[J]. Carbohydrate Polymers, 2007, 69(2)∶ 311-317.
[12]MICHENFELDER M, FU G, LAWRENCE C, et al. Characterization of two molluscan crystal-modulating biomineralization proteins and identification of putative mineral binding domains[J]. Biopolymers, 2003, 70∶ 522-533.
[13]BEDOUET L, MARIEA, DUBOST L, et al. Proteomics analysis of the nacre soluble and insoluble proteins from the oyster Pinctada margaritifera[J]. Marine Biotechnology, 2007, 9(5)∶ 638-649.
[14]BEDOUET L, RUSCONI F, ROUSSEAU M, et al. Identification of low molecular weight molecules as new components of the nacre organic matrix [J]. Comparative Biochemistry and Physiology, 2006, 144∶ 532-543.
Antioxidant Activity of Water-soluble Matrix from Abalone Shell
LIANG Hong-bao1,GUO Wei1,DONG Sheng-xiong1,WU Jiu-lin1,PENG Zhen-fei1,LIU Zhi-bin1,ZHANG Qi-qing1,2,*
(1. Institute of Biomedical and Pharmaceutical Technology, Fuzhou University, Fuzhou 350002, China;2. Institute of Biomedical Engineering, Chinese Academy of Medical Sciences, Tianjin 300192, China)
The water-soluble matrix from abalone shell (WSMA) was purified by ion exchange chromatography (IEC) in DEAESephadex A-25 column. The antioxidant activity of WSMA was evaluated by scavenging capabilities of DPPH (1,1-diphenyl-2-picrylhydrazy), hydroxyl (·OH) and superoxide anion (O2·) free radicals, and reducing powder of ferric ions. Compared with water-soluble matrix from pearl (WSMP) and vitamin C, WSMA revealed the similar reducing power and scavenging capability to O2· with WSMP, however, both WSMA and WSMP exhibited a weak inhibition effect on DPPH· and ·OH. The fraction from the second peak (AⅡ) separated by IEC was the major bioactive component. The scavenging capability of 1.0 mg/mL AⅡ to superoxide anion free radicals was 80%, which was equivalent to 0.1 mg/mL vitamin C.
abalone shell;water-soluble matrix;antioxidant activity;ion exchange chromatography
TS254.4
A
1002-6630(2010)09-0113-04
2009-09-07
梁红宝(1985—),男,硕士研究生,主要从事功能高分子研究。E-mail:ruby-boy@tom.com
*通信作者:张其清(1954—),男,教授,博士,主要从事生物医学工程研究。E-mail:zhangqiq@126.com

