昆虫谷胱甘肽-S-转移酶的基因组学研究及其介导的抗药性*
房守敏
(西华师范大学生命科学学院,南充 637002)
谷胱甘肽-S-转移酶(glutathione S-transferases,GSTs)是一个多功能的酶系,广泛分布于生物体[1]。昆虫GST s的主要功能是对外源有毒物质解毒,参与抗药性的形成[2]。昆虫GSTs的部分成员也具有硒非依赖性的谷胱甘肽过氧化物酶(non-selenium dependent glutathione peroxidases,non-SeGPx)活性,是昆虫体内重要的抗氧化酶。如杀虫剂进入生物体内,能打破体内氧化和抗氧化的动态平衡,大量产生的活性氧(reactive oxygen species,ROS)对膜(包括细胞膜和亚细胞器膜)脂质、DNA、蛋白质及糖类等生物大分子造成氧化损伤,进而产生新的细胞毒素和诱变剂引发氧化应激反应[3-6]。具有过氧化物酶活性的GSTs能对脂质过氧化中间产物磷脂过氧化氢(phospholipid hydroperoxides)和脂肪酸过氧化氢(fatty acid hydroperoxides)及终产物丙二醛(malondialdehyde,MDA)和4-羟基壬烯醛(4-hydroxynonenal,4-HNE)等有机氢过氧化物解毒[5],从而降低杀虫剂对生物体引起的氧化应激损伤。
近年来,昆虫GSTs的研究报道越来越多。对昆虫GSTs的主要集中于其与杀虫剂抗性的关系,已有研究发现GSTs在昆虫对有机磷(organophosphorus,OPs)、有机氯(organochlorine)和拟除虫菊酯(pyrethroid)等杀虫剂形成抗性中起着重要作用。国内外研究者对GST s参与杀虫剂抗性的生化和分子基础进行了综述[2,7-9]。GSTs基因的分类、结构、及调控机制相关研究也有一些综述进行了报道[7,9-11]。2005年,邱星辉对杀虫剂抗性遗传学与基因组学研究进展进行了综述,其中重点论述了细胞色素P450和酯酶[12],而昆虫GSTs的基因组学研究还未见综述报道。随着部分昆虫基因组全序列的测序完成以及基因组研究技术(如微阵列技术)的广泛运用,促进了抗性基因的鉴别进程,比较基因组学研究也不断出现。因此,本文综述了昆虫GSTs的比较基因组学研究及GSTs参与杀虫剂抗性的研究进展。
1 昆虫谷胱甘肽-S-转移酶的比较基因组学研究
随着基因组时代的来临,昆虫GSTs的全基因组鉴定与比较基因组学逐渐展开。目前,已完成全基因组鉴定的昆虫GST基因数目见表1。如表所示,不同物种间基因数目存在较大的差异,特别是蜜蜂Apismelli f era基因组中的GST基因仅有8个。半数以上的GST基因均分布于昆虫特异的Delta和Epsilon家族(除蜜蜂外),按蚊的2个昆虫特异家族的基因数达到总数的70%以上。Delta和Epsilon随着昆虫分化而进化形成,相对其他家族其进化产生的时间较晚,系统发生分析表明它们与Theta家族近源(图1)[13-16]。由于Delta和Epsilon家族在物种内的特异扩增,因此鉴定物种间的直系同源基因较为困难[13]。冈比亚按蚊Anopheles gambiae、埃及伊蚊Aedesaegypti和黑腹果蝇Drosophila melanogaster三种双翅目昆虫间,仅GSTd7和GSTe8存在明显的1∶1∶1直系同源关系[16]。相反,非昆虫特异家族的直系同源基因较容易鉴定,而且这些直系同源基因的相似性往往较高。这是因为非昆虫特异家族在一些保守的生理学途径中起着持家基因的功能,因而在物种的分化形成后,为保持其生理功能经历着约束性进化。因此,昆虫特异的Delta和Epsilon家族在昆虫适应特殊生境中起着重要作用,而非持家基因的功能。Claudianos等[17]研究发现蜜蜂基因组中仅有1个Delta基因,推测这可能是蜜蜂对杀虫剂非常敏感的主要原因之一。
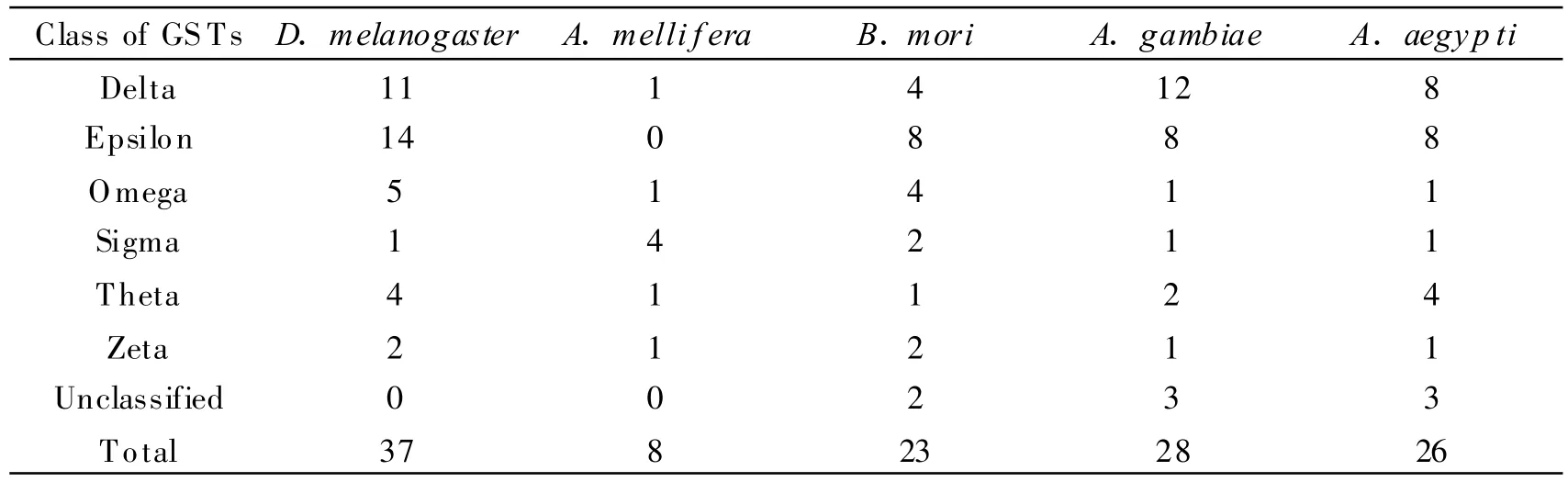
表1 几种模式昆虫GST基因数目的比较
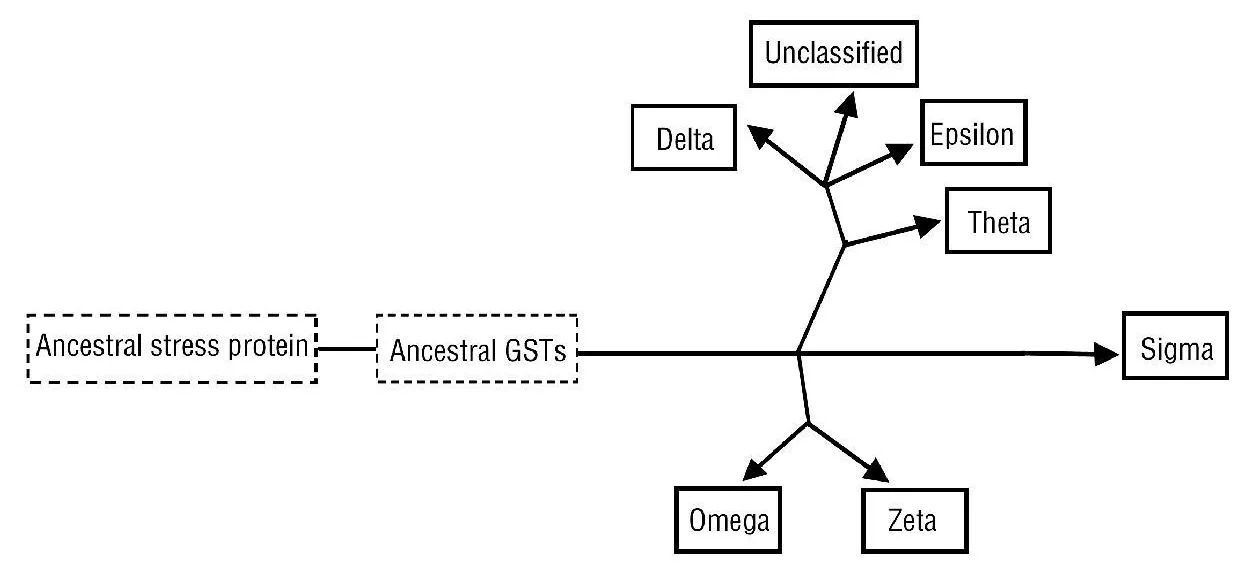
图1 昆虫GST s的进化模式图
Delta和Epsilon家族GSTs在昆虫基因组中显示出了呈簇分布的特征(图2)。冈比亚按蚊Delta基因位于第2号染色体的18B和19D区,Epsilon呈簇分布于3R的33B[14];果蝇的11个Delta成员则位于3R的87B,而10个Epsilon位于2R的55C,另外4个基因散布于2R染色体[14,18];家蚕Delta成员与其他几个物种一样呈cluster分布,但是8个Epsilon基因中,仅3个基因呈串联分布,其他的5个Epsilon基因则分布在不同的染色体上。因此,Epsilon GSTs在家蚕种内特异扩增的机制有别于其他昆虫。果蝇Epsilon基因簇中,物理距离的远近能反映基因间的相似性和进化关系,表明该基因簇由单个基因而非基因区段重复而来,并且在重复后没有基因重排现象发生[18]。其他几个物种的Epsilon基因簇部分基因也有类似现象。但是按蚊和伊蚊均有8个Epsilon基因,仅有少量的一对一的直系同源关系,表明两物种Epsilon基因簇中发生了局部的基因重复。
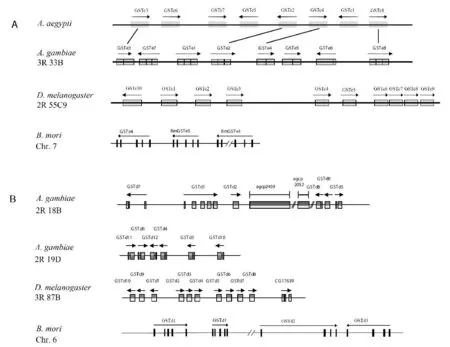
图2 昆虫Delta和Epsion GSTs的基因组分布[14-16]
比较基因学分析发现,冈比亚按蚊、埃及伊蚊及家蚕Bombyx mori基因组中均发现不能划分到已知家族的unclassified GST s,其在进化上与Delta和Epsilon关系较近(图1)。Lumjuan等[16]将伊蚊的3个unclassified GST基因在大肠杆菌Escherichia coli中进行原核表达,由于GSTI1和GSTX1以包涵体形式表达,且复性也不能获得活性蛋白,因此主要对GSTX2进行了亲和纯化和酶活性鉴定。发现GSTX2与血红素有较强的亲和力,因此该基因可能在保护伊蚊在吸血过程中免受血红素毒害起重要作用,这实际也表现为适应特殊生境的有利进化。按蚊和家蚕的unclassified GST s的功能及是否在适应特殊生境起重要作用等还有待进一步的研究。
2 谷胱甘肽-S-转移酶与昆虫抗药性
昆虫抗药性研究由来以久,早在1914年,Melander就报道了美国梨圆盾蚧Aspidiotus perniciosus对石硫合剂能产生抗性[19]。随着生物化学、分子生物学及基因组学的发展,昆虫抗药性研究取得了可喜进展。昆虫对杀虫剂产生抗性的机制主要包括表皮穿透率下降、作用靶标敏感性降低和解毒代谢作用增强等三个方面,其中解毒代谢作用增强是昆虫抗药性的主要机制[20]。昆虫体内参与杀虫剂解毒代谢的酶类主要包括细胞色素P450单加氧酶(cytochrome P450-dependent monooxygenases,P450s)、谷胱甘肽-S-转移酶和羧酸酯酶(carboxylesterases,COEs)三大超基因家族。GSTs是非常重要的一类解毒酶,它与昆虫对有机磷、有机氯和拟除虫菊酯类杀虫剂抗性相关。
2.1 谷胱甘肽-S-转移酶与昆虫有机磷抗性
有机磷杀虫剂由于其广谱性、低毒性和在环境中易被降解等特点,被广泛应用于农林害虫的防治。GSTs在昆虫有机磷抗性形成中起到了重要作用,它主要通过O-脱烷基作用(O-dealkylation)和O-脱芳基作用而解毒。如GSTs能催化谷胱甘肽与杀虫威轭合,致使结构中的一个O-甲基从杀虫剂上脱落,从而降低杀虫剂毒性[21-22];对硫磷和甲基对氧磷则是通过GSTs催化谷胱甘肽(glutathione,GSH)与杀虫剂的“离去基团”(leaving group)轭合而解毒[23]。在实际应用中,大量的有机磷杀虫剂常以硫代磷酸酯形式使用,当其进入昆虫体内P450s能将毒性较低的硫代磷酸酯氧化为毒性较高的有机磷,从而达到杀虫的目的,GSTs常作为次级代谢酶对这些高毒的硫代磷酸酯氧化物进行解毒[24]。
GSTs参与有机磷抗药性形成的研究主要集中家蝇Malus domestica和小菜蛾Plutella xylostella两个物种。而且这些研究相对较早,近些年GSTs参与OPs抗性形成的研究并不多见。由于吕敏等[8]对该研究进行了综述,在此不一一赘述。迄今为止,小菜蛾P xGSTe1是目前已研究较为清楚的参与有机磷抗性的基因之一,该基因外源表达蛋白具有降解对硫磷(parathion)、甲基对硫磷(methylparathion)和对氧磷(paraoxon)的活性[25];而MdGSTd3和MdGS T-6A则是家蝇对甲基对硫磷和/或二嗪磷抗性的重要基因[26-27]。
2.2 谷胱甘肽-S-转移酶与昆虫的有机氯抗性
GSTs与昆虫有机氯抗性关系的研究主要集中在双翅目昆虫的果蝇、冈比亚按蚊和埃及伊蚊三个物种。早期研究发现DmGSTd1和AgGSTe2是果蝇和冈比亚按蚊重要的DDT抗性基因[28-29]。随着冈比亚按蚊基因组的测序完成已及基因芯片技术的日益完善,David等[30]设计了“按蚊解毒芯片”(Anopheles detox chip),其中包括GSTs、P450s、COEs、氧化还原相关酶及对照基因共计230条探针,利用该芯片对DDT抗性和敏感品系的抗性相关基因进行表达差异研究,发现抗性品系AgGS Te2表达量是敏感系的3.88倍,及2个P450s和2个过氧化物酶在抗性品系中显著表达上调。结果表明,多基因参与形成了冈比亚按蚊对DDT的抗性。与以前研究一致的是,DDT抗性基因AgGSTe2在“按蚊解毒芯片”中也被筛选鉴定为抗性基因。因此,在基因组水平,采用基因芯片技术筛选抗药性候选基因是抗药性研究行之有效的方法。通过该方法可为后续功能鉴定提供目标基因,这将大大缩短抗药性基因的鉴定时间。
埃及伊蚊是DDT抗性研究的另一模式昆虫,Grant等(1991)根据生化和免疫学方法在抗性GG品系中鉴定出GST-1a和GST-2(AaGSTD1)两个过量表达的GST s同功酶,在不同发育阶段及性别原因,抗性品系GST-1a的表达量是敏感品系的2~5倍,而AaGSTd1则是25~50倍[31]。AaGSTd1的过量表达可能由于敏感品系中AaGS Td1基因的5'侧翼区存在一个抑制子,在抗性品系中该抑制子发生了功能缺失突变,从而导致AaGS Td1基因在抗性品系中过量表达[32]。但是在抗DDT和氯菊酯的品系PMD-R中,AaGSTd1基因并没有过量表达[33],而是AgGSTe2的直系同源基因AaGSTe2存在过量表达,且外源表达也证实了AaGSTe2具有DDT ase和GPx的活性。因此,AaGS Td1和AaGS Te2均是伊蚊的DDT抗性基因,但在不同的抗性材料中行使解毒功能。
2.3 谷胱甘肽-S-转移酶与昆虫的拟除虫菊酯抗性
拟除虫菊酯类杀虫剂因其高效、广谱、低毒(对人畜毒性低)和低残留等优点常被用作卫生杀虫剂和农林害虫的防治,但它致命的弱点是相对于有机磷和有机氯农药而言,昆虫的抗性发展迅速。1997年,王开运等[34]将棉铃虫在室内饲养和用药筛选,氰戊聚酯筛选15代后,抗性达到了311倍,但用甲基对硫磷和辛硫磷分别筛选14代和13代后,抗性仅分别达到3.5倍和5.2倍。Abdullah等[35]用氯氰菊酯对甜菜夜蛾连续筛选12代,LC50达到8 625 mg/L,而没有施药的种群为90 mg/L,筛选后的抗性是筛选前的95.83倍。尽管昆虫对拟除虫菊酯类杀虫剂的抗性发展迅速,但是在实际中仍被广泛使用。
2001年,Kostaropoulos等[36]通过酶的体外抑制试验,发现溴氰菊脂(decamethrin)是GSTs活性(CDNB)的竞争性抑制剂,它能与GSTs的活性中心结合,从而揭示了GSTs能与拟除虫菊酯分子结合,从而保护生物大分子免受损伤。拟除虫菊酯抗性品系中,过量表达的GSTs能被动隔离拟除虫菊酯分子,以增强昆虫抗药性。另外,拟除虫菊酯杀虫剂除了具有神经毒性外,还可诱导昆虫的氧化应激和脂质过氧化反应。Vontas等[37]克隆获得了抗拟除虫菊酯的褐飞虱品系中上调表达的NlGSTd1基因,体外表达研究表明该基因具有过氧化物酶活性。因此,GST s既可隔离拟除虫菊酯,也可对拟除虫菊酯引起的脂质过氧化产物解毒,从而增强昆虫对拟除虫菊酯的抗性。
目前,GSTs与拟除虫菊酯抗性关系的研究是3大类杀虫剂中最为活跃的领域。埃及伊蚊的实验室敏感品系经溴氰菊酯deltamethrin连续汰选20代后,非变性聚丙烯酰胺凝胶电泳和生化测定结果表明抗性品系中的GSTs对模式底物CDNB的活性提高了1.11倍,证实GSTs在埃及伊蚊对溴氰菊酯抗性发生中起着重要作用[38]。在实验室条件下,Hunt等[39]对莫桑比克南部的拟除虫菊酯抗性不吉按蚊A.funestus以0.1%的高效氟氯氰菊酯lambdacyhalothrin汰选3代后,发现筛选后的GSTs活性显著高于未筛选群体,表明GST s与不吉按蚊的高效氟氯氰菊酯抗性相关。
2005年,David等[30]利用“按蚊解毒芯片”比较了氯菊酯抗性和敏感品系间抗药性相关基因的表达,表明AgGS Te2在抗性品系RSP中的表达量是敏感系的2.36倍。大规模的20k MMC1芯片及小尺度的“按蚊解毒芯片”对斯氏按蚊A.stephensi拟除虫菊酯抗性(DUB-R)和敏感(BEECH)品系间的基因表达研究发现,AsGST1-2是解毒相关基因中表达变化最大的基因,该基因在DUB-R中过量表达[40]。由于Sigma GSTs对脂质过氧化产物有较高的亲和性[41],斯氏按蚊AsGS T1-2可能具有过氧化物酶活性,从而对脂质过氧化产物解毒的功能。Strode等[42]以含有204个特异70 mer探针的”伊蚊解毒芯片”(Aedes Detox Chip),对氯菊酯抗性和敏感品系成虫期的抗药性相关基因的表达进行了研究,发现AaGSTe2和AaGSTe7在抗性品系PMD-R中过量表达,而抗性IM品系中AaGSTe2,AaGSTe3,AaGSTe4为过量表达基因,在两份抗性材料中均发现了AaGS Te2过量表达。
3 展望
近十年来,在分子水平上研究GST s参与昆虫抗药性获得了前所未有的进展。但是美中不足的是,已鉴定的抗药性基因的表达调控机制研究仍相当匮乏。陈凤菊和高希武(2005)对昆虫GST s的表达调控机制进行了综述[10],但是已有的多数研究的顺式、反式调控机制还处于推测阶段,有待实验证实。由于GST s在药物代谢中起着重要作用,哺乳动物GSTs基因的表达调控机制研究较为深入,已经鉴定出了多种调控元件,例如异生物素反应元件、NF-kB抗氧化应激反应元件和亲电子反应元件等[43]。哺乳动物GST s的调控机制研究为昆虫的相关研究提供了有用参考。昆虫抗药性已成为世界性难题,害虫防治还有待合理利用这些杀虫剂重要靶标。因此,进一步阐明昆虫GST基因的调控机制仍是昆虫抗药性研究的重要课题。
数种昆虫的基因组测序完成及基因芯片技术的迅速发展和普遍应用,为快速筛选杀虫剂诱导以及在抗药性昆虫中过量表达的候选基因提供了便利。抗药性候选基因的获得可用于后续的功能鉴定,这必将大大缩短抗药性基因的鉴定时间。但由于杀虫剂对昆虫的选择往往会同时产生多种抗性机制,如靶标抗性和代谢抗性等。就代谢抗性而言,也存在点突变导致的酶活性增加及过量表达两种机制。基因芯片技术仅能筛选抗性和敏感品系间差异表达的基因,因此在抗药性研究中如仅以基因芯片来锁定抗药性基因是不全面的,还需对靶标抗性及利用遗传定位等方法进行研究。总体而言,抗药性相关基因的过量表达是抗性的主要机制,基因芯片技术将在抗药性基因的鉴定中得到更广泛的应用。
[1]Sheehan D.,Meade G.,Foley V.M.,et al.Structure,function and evolution of glutathione transferases:implications for classification of non-mammalian members of an ancient enzyme superfamily[J].Biochem J,2001,360:1-16.
[2]Li X.,Schuler M.A.,Berenbaum M.R.Molecular mechanisms of metabolic resistance to synthetic and natural xenobiotics[J].Annu Rev Entomol,2006,52:231-53.
[3]Giordano G.,Afsharinejad Z.,Guizzetti M.,et al.Organophosphorus insecticides chlorpyrifos and diazinon and oxidative stress in neuronal cells in a genetic model of glutathione deficiency[J].Toxicol Appl Pharmacol,2007,219:181-9.
[4]Vontas J.G.,Small G.J.,Hemingway J.Glutathione S-transferases as antioxidant defence agents confer pyrethroid resistance in Nilaparvata lugens[J].Biochem J.,2001,357:65-72.
[5]Parkes T.L.,Hilliker A.J.,Phillips J.P.Genetic and biochemical analysis of glutathione S-transferases in the oxygen defence system of Drosophila melanogaster[J].Genome,1993,36:1007-1014.
[6]M arnett L.J.,Riggins J.N.,West J.D.Endogenous generation of reactive oxidants and electrophiles and their reactions with DNA and protein[J].J.Clin.Invest.,2003,111:583-593.
[7]Enayati A.A.,Ranson H.,Hemingway J.Insect glutathione transferases and insecticide resistance[J].Insect Mol.Biol.,2005.14(1):3-8.
[8]吕敏,刘惠霞,吴文君.谷胱甘肽S-转移酶与昆虫抗药性的关系[J].昆虫知识,2003.40(3):204-207.
[9]Ranson H.,Hemingway J.2005.Glutathione transferases.In:Gilbert L.I.,Iatrou K.Gill S.S.(Eds.)Comprehensive molecular insect science-pharmacology,Vol.5.Oxford,Elsevier.
[10]陈凤菊,高希武.昆虫谷胱甘肽S-转移酶的基因结构及其表达调控[J].昆虫学报,2005,48:600-608.
[11]杨海灵,聂力嘉,朱圣庚,等.谷胱甘肽硫转移酶结构与功能研究进展[J].成都大学学报(自然科学版),2006.25(1):19-24.
[12]邱星辉.杀虫剂抗性:遗传学、基因组学及应用启示[J].昆虫学报,2005,48(6):960-967.
[13]Ranson H.,Claudianos C.,Ortelli F.,et al.Evolution of supergene families associated with insecticide resistance[J].Science,2002,298:179-181.
[14]Ding Y.,Ortelli F.,Rossiter L.C.,et al.The Anopheles gambiae glutathione transferase supergene family:annotation,phylogeny and expression profiles[J].BM C Genomics,2003,4:35.
[15]Yu Q.,Lu C.,Li B.,et al.Identification,genomic organization and expression pattern of glutathione S-transferase in the silkworm,Bombyx mori[J].Insect Biochem Mol Biol,2008,38:1158-1164.
[16]Lumjuan N.,Stevenson B.J.,Prapanthadara L.A.,et al.The Aedes aegypti glutathione transferase family[J].Insect Biochem Mol Biol,2007,37:1026-1035.
[17]Claudianos C.,Ranson H.,Johnson R.M.,et al.A deficit of detoxification enzymes:pesticide sensitivity and environmental response in the honeybee[J].Insect Mol Biol,2006,15:615-636.
[18]Sawicki R.Singh S.P.Mondal A.K.,et al.Cloning,expression and biochemical characterization of one Epsilon-class(GST-3)and ten Delta-class(GST-1)glutathione S-transferases from Drosophila melanogaster,and identification of additional nine members of the Epsilon class[J].Biochem J,2003,370(Pt 2):661-669.
[19]M elander A.L.Can insects become resistant to sprays?[J]J.Econ.Entomol.,1914,7:167-173.
[20]Hemingway J.,Hawkes N.J.,McCarroll L.,et al.The molecular basis of insecticide resistance in mosquitoes[J].Insect Biochem Mol Biol,2004,34:653-665.
[21]Oppenoorth F.J.,Van der Pas L.J.T.,Houx N.W.H.Glutathione S-transferase and hydrolytic activity in a tetrachlorvinphos-resistant strain of housefly and their influence on resistance[J].Pest Biochem Physiol.,1979,11:176-188.
[22]Fukuto T.R.Mechanism of Action of Organophosphorus and Carbamate Insecticides[J].Environ.Health.Persp,1990,87:245-254.
[23]Chiang F.M.,Sun C.N.Glutathione transferase isozymes of diamondback moth larvae and their role in the degradation of some organophosphorus insecticides[J].Pest Biochem Physiol.,1993,45:7-14.
[24]Che-Mendoza A.,Penilla R.,Rodr í guez D.Insecticide resistance and glutathione S-transferases in mosquitoes:A review[J].African J.Biotechnology,2009.8(8):1386-1397.
[25]Huang H.S.,Hu N.T.,Yao Y.E.,et al.M olecular cloning and heterologous expression of a glutathione S-transferase involved in insecticide resistance from the diamondback moth,Plutella xylostella[J].Insect Biochem Mol Biol,1998,28:651-658.
[26]Syvanen M.,Zhou Z.,Wharton J.,et al.Heterogeneity of the glutathione transferase genes encoding enzymes responsible for insecticide degradation in the housefly[J].J.M ol.Evol.,1996,43:236-240.
[27]Wei S.H.,A.G.C.,Syvanen M.Identification and cloning of a key insecticide metabolizing glutathione S-transferase(MdGST-6A)from a hyper insecticide-resistant strain of the housefly M usca domestica[J].Insect Biochem.Mol.Biol.,2001,31:1145-1153.
[28]Tang A.H.,Tu C.P.Biochemical characterization of Drosophila glutathione Stransferases D1 and D21[J].J.Biol.Chem.,1994,269:27876-27884.
[29]Ortelli F.,Rossiter L.C.,Vontas J.,et al.Heterologous expression of four glutathione transferase genes genetically linked to a major insecticide-resistance locus from the malaria vector Anopheles gambiae[J].Biochem J,2003,373:957-963.
[30]David J.P.,Strode C.,Vontas J.,et al.The Anopheles gambiae detoxification chip:a highly specific microarray to study metabolic-based insecticide resistance in malaria vectors[J].Proc Natl Acad Sci USA,2005,102:4080-4084.
[31]Grant G.F.,Dietze E.C.,Hammock B.D.Glutathione S-transferase isozymes in Aedes aegypti:purification,characterization,and isozyme-specific regulation[J].Insect Biochem,1991,21:421-433.
[32]Grant D.F.,Hammock B.D.Genetic and molecular evidence for a transacting regulatory locus controlling glutathione S-transferase-2 expression in Aedes aegypti[J].Mol.Gen.Genet.,1992,234:169-176.
[33]Lumjuan N.,M cCarroll L.,Prapanthadara L.A.,et al.Elevated activity of an Epsilon class glutathione transferase confers DDT resistance in the dengue vector,Aedes aegypti[J].Insect Biochem Mol Biol,2005,35:861-71.
[34]王开运,慕立义,刘峰,等.棉铃虫对氰戊菊酯等杀虫剂抗性的选育及其生化机理[J].昆虫学报,1997,40:23-31.
[35]Abdullah M.,Sarnthoy O.,Tantakom S.,et al.Monitoring insecticide resistance development in beet armyworm,Spodoptera exigua(Hubner)(Lepidoptera:Noctuidae)[J].Kasetsart J.(Nat.Sci.),2000,34:450-457.
[36]Kostaropoulos I.,Papadopoulos A.I.,Metaxakis A.,et al.Glutathione S-transferase in the defence against pyrethroids in insects[J].Insect Biochem Mol Biol,2001,31:313-9.
[37]Vontas J.G.,Small G.J.,Nikou D.C.,et al.Purification,molecular cloning and heterologous expression of a glutathione-S-transferase involved in insecticide resistance from the rice brown planthopper,Nilaparvata lugens[J].Biochem.J.,2002,362:329-337.
[38]Jagadeshwaran U.,Vijayan V.A.Biochemical characterization of deltamethrin resistance in a laboratory-selected strain of Aedes aegypti[J].Parasitol Res,2009.104(6):1431-1438.
[39]Hunt R.H.,Brooke B.D.,Pillay C.,et al.Laboratory selection for and characteristics of pyrethroid resistance in the malaria vector Anopheles funestus[J].M ed Vet Entomol,2005,19(3):271-275.
[40]Vontas J.,David J.P.Nikou D.,et al.,Transcriptional analysis of insecticide resistance in Anopheles stephensi using cross-species microarray hybridization[J].Insect Mol Biol,2007,16(3):315-324.
[41]Singh S.P.Coronella J.A.Benes H.,et al.,Catalytic function of Drosophila melanogaster glutathione S-transferase DmGSTS1-1(GST-2)in conjugation of lipid peroxidation end products[J].Eur J Biochem,2001,268(10):2912-23.
[42]Strode C.,Wondji C.S.,David J.P.,et al.Genomic analysis of detoxification genes in the mosquito Aedes aegypti[J].Insect Biochem Mol Biol,2008,38:113-123.
[43]Rushmore T.H.,Pickett C.B.Glutathione S-transferases,structure,regulation,and therapeutic implications[J].J.Biol.Chem.,1993,268:11475-11478.

