空间细胞生物学研究的新进展
夏伟强 ,樊尚春 ,邢维巍 ,刘长庭,王俊锋,李天志
(1. 北京航空航天大学 仪器科学与光电工程学院,北京 100191;2. 中国人民解放军总医院,北京 100853)
0 引言
空间生物医学(Space Biology and Medical Science)是研究宇宙空间环境中各种因素影响生物体功能的一般规律性以及进行相关医学研究的学科。世界空间生物医学的发展可以归纳为3个发展阶段[1-3]。
第一个阶段是为实现载人航天,探索太空生存环境阶段。这个阶段的研究是为了解近似绕地轨道飞行条件对动物的影响,间接了解空间条件对人的影响,判断把人送上天是否有危险,研究生存条件和保护装置。
第二个阶段是研究空间环境对航天器搭载人体、植物、动物等的直接影响阶段。体现在对空间飞行效应现象的观察。通过生命体的直接反应,了解人对于空间环境的适应性以及返回后的再适应。
第三个阶段是生物机理研究阶段以及分子细胞生物学阶段,并且还在继续深化研究。控制实验条件,采用多学科的方法,在有机体的分子、细胞、器官系统和整体等各种结构层次上探索微重力的效应。研究辐射、振动、高温、密闭环境等已知与未知的复杂太空环境的影响。
微重力可以借助旋转生物反应器这样的装置产生[4]。借助回转器的转动,作用于物体上的重力方向连续不断改变,转动一周(360°),可以认为,由于重力矢量方向改变,使生物体来不及感受重力的作用,其结果就像没有受到重力的作用一样,产生出类似于微重力环境下的现象。利用模拟微重力进行地面细胞培养实验已经大范围地展开,但是人工微重力与天然微重力并不完全相同,严格上说回转器并不能“模拟”微重力,但可能模拟微重力的部分效应,主要是细胞对重力矢量方向紊乱的响应。微重力细胞生物学实验一直面临如何将浮力对流消失引起的细胞培养传质条件改变的影响与细胞对重力的直接感应有效区分开来的问题。并且,空间问题是复杂的、可变的、混合因素的问题,妨碍了确定微重力对某一因素的直接影响,这就很难通过地面控制来模拟研究,所以必须在空间环境下进行研究[1-2]。
近30年的研究表明对人体有影响的空间环境主要是辐射和微重力[5-7]。辐射可引起细胞损伤和基因突变,可通过足够的防护减轻其损伤;微重力的影响十分广泛,通过十多年的研究已经查明,重力不仅能在整体水平上、而且必定能在细胞水平上影响生命过程[1-2]。空间飞行对人类淋巴细胞,肺的胚细胞系以及其他细胞类型的细胞生理有广泛影响已经得到证实,其影响包括繁殖的改变,基因表达的改变,信号传导的改变,形态改变,能量代谢的改变等。在1999年发射的“FOTON 12”航天器上所进行的研究重点是放到细胞中的信号传导上,如重力刺激传导中钙和相关蛋白的作用,重力对细胞骨架的影响和它在细胞所接收的信号传导中的作用,在器官形成中重力变化对感应细胞和神经细胞之间联络形成的影响等。另外,研究细胞对环境其他干扰因素(包括飞行器发射和再入大气层时强烈的超重与振动)的应激反应无疑是很重要的。虽然适当的防护可以短时性地降低其影响,但是可能的增强辐射损害也必须考虑[8-9]。
同时,在空间微重力条件下,由于重力引起的沉降和对流趋于消失,细胞(或微组织)可以均匀悬浮于介质中,为细胞的真正三维生长、正常分化和高密度培养创造了良好的条件,不但有利于提高介质的利用率和单位容积的产量,也有利于获得更加均一、纯净的培养产物,从而使空间细胞培养成为目前国际看好的3大空间生物技术(蛋白质结晶、细胞培养、生物分离)之一[10],也是空间生命科学研究和空间生物加工的重要组成部分。空间细胞培养不仅对解释一系列生命现象很有价值,而且可以用于特殊药品或化学物质的制备。近期发现,一种能引起食物中毒的沙门氏菌,在太空飞船零重力的情况下度过12 d后,其致病几率几乎是地上细菌的3倍。这将有助于发明出效果更好的抗生素,此疫苗如能够应用于人类临床实验,将是首次基于太空研究的医学成果[11-12]。
随着航天技术及航天医学技术不断的发展,空间细胞生物学的研究不断深化,同时与细胞培养技术、传感技术、通信技术、数据处理技术相结合,为我们进行新的研究提供了可能。
1 空间细胞装置的研究现状及未来发展
1.1 细胞装置的研究现状
随着航天技术的发展,空间细胞培养装置已成为在微重力条件下进行相关研究的必备工具。然而由于空间环境与地面环境相差十分显著,在对空间细胞培养装置进行设计时,除了作为细胞培养装置的基本要求外,还应考虑空间环境的特殊之处,合理考虑装置的传质特性、传热特性和可操作性[13]。
空间细胞培养装置必须能在空间提供一个细胞生长的环境条件,这些条件包括适宜的温度、充分的营养和溶氧、均匀稳定的pH值、低有毒分泌物浓度和合理的力学环境等。这些技术和措施的采用都是为细胞的培养(发育、生长、分化)创造尽可能接近理想的条件(温度、养料、湿度、氧气、pH值),为研究人员对细胞培养过程提供更多的监测、观察和控制手段,以求获得尽可能多的、真实的、有意义的信息和结果。
多年来,空间细胞培养一直为众多国家所重视并进行了广泛的研究,而且已取得许多有重要意义的进展[13-14]。为了开展空间细胞生物学的研究,具有适合于空间研究使用的细胞组织培养传感系统是必要的。早期主要航天国家细胞培养装置概况如表1所示。

表1 早期的细胞培养装置Table 1 Early space cell culture devices
经过30多年的研究和发展,空间细胞培养设备和技术取得了长足的进步,走过了从简单到复杂,再到逐步完善和成熟的历程。经历了由简单生长环境到精密可控细胞生长环境;从静态的批量培养到动态的连续灌流式培养;从单一培养容器到微型化和自动化的微流控芯片培养;从人简单地参与静态图像拍摄到在线自动观测、显微观测,甚至进行遥控操作的细胞培养的发展变化。
近期,已经进行过飞行实验的典型生物反应器有动态细胞培养系统(Dynamic Cell Culture System,DCCS)和灌注生物反应器(Perfusion Bioreactor)。此外还出现了商业性生物研究单元(Commercial Biological Research Unit,CBRU)和发展出新的无损伤光学检测仪,可用于空间或地面的细胞、组织和器官的观测与诊断。约翰逊空间飞行中心推出的微重力生物反应器,可以在一个较大的应力范围内对重力的作用进行模拟研究,成为组织工程的重要工具。至今已经发展了4~5代用于生物和细胞培养的空间飞行装置,并融入在线检测装置。图1是NASA、欧空局(ESA)和加拿大空间局(CSA)的几个成功应用的空间生物培养装置[15]。

图1 近期成功应用的空间细胞装置Fig. 1 Space cell devices applied successfully recently
1.2 空间细胞装置的未来发展
1.2.1 细胞培养技术新发展
空间细胞培养研究装置的发展基于地面的细胞培养技术的发展。近年,基于地面的细胞培养技术取得了令人瞩目的成就[16-17]:一方面是从细胞层面上对基本生物学过程的认识,另一方面是细胞生物学应用由全层面扩展到生理学上。
大量基于地面细胞培养应用研究的开展[18-20],例如病毒检测、具体动物组织细胞代谢、人体组织的早衰研究等,为空间细胞研究提供了技术经验。作为信息科学与生物医学高度交叉融合学科,随着生命科学、生物技术与医学的飞速发展和工程技术的进步,在地面,各种形式、结构、尺寸和用途的培养装置或生物反应器已相当普及,细胞培养已经发展成为一个新的工程学科,创造着越来越大的社会效益和经济效益,并且为空间技术应用提供了可能。例如最近有文献提出一种利用微流体技术,微型三维灌注细胞培养平台(如图2所示),提供均匀稳定的细胞培养环境、高效的介质输送以及细胞装载,同时减少人工介入,可以实现更高精度和高产量的基于细胞培养的实验[21]。这项技术可以向空间环境应用扩展,满足空间环境下对细胞培养的小体积、微功耗、精确智能三维培养实验。
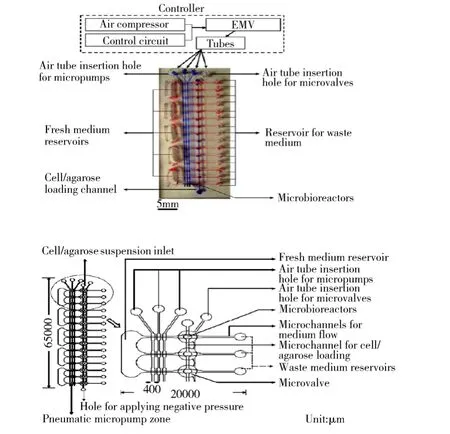
图2 微型三维细胞培养平台Fig. 2 Micro-3D cell culture platform
瑞士Hamilton公司生产的BioLevitator 3D细胞培养仪(图3)利用磁性微球载体和磁悬浮技术,使贴有细胞的微球载体悬浮在培养液中,确保了高质量、高密度的细胞繁殖,突破了传统有盖培养皿、培养瓶或微孔板等的细胞培养耗时繁琐和细胞产量微小等的局限性[22-23]。通过模拟体内细胞生长环境,在GEMs™上生长的细胞具有更好的三维形态结构,而且允许直接分析GEMs™的细胞,无需先用酶消化收获细胞,因此适合大多数细胞培养,包括原代细胞和干细胞。作为综合的细胞培养仪,不需要其他外围设备,所需人工操作极少,可用于进行大量细胞培养。

图 3 Hamilton BioLevitator™3D细胞培养仪Fig. 3 Hamilton BioLevitator™3D for cell culture
这些基于地面的最新细胞培养技术,无论体积、微功耗设计还是细胞培养自动化、细胞生长环境控制等都满足空间应用条件,为设计空间细胞装置提供了技术基础。虽然移植到空间环境应用还需要进行必要的改进,但是在设计空间细胞培养装置时是可以成为必要的参考。
1.2.2 细胞传感技术新发展
先进的细胞成像技术作为信息科学与生命科学的交叉学科,一直是科学家研究的热点。将细胞培养技术以及细胞研究方法和先进的细胞传感技术相结合,提供了细胞研究的新方向。近些年,随着基于计算机技术的图像增强与处理技术飞速发展,借助共焦显微镜和激光扫描显微镜等显微成像技术,通过添加高灵敏度荧光染料,荧光成像技术取得了突破性进展。双光子成像技术、二次谐波成像技术、全内反射技术成像、荧光能量转移成像技术等可实现低损伤活体单细胞成像,这些荧光成像技术已成功实现商业化。借助这些技术,细胞显微成像向着更高的分辨率、多维成像、更高的成像速度、多色彩成像、更小的细胞损伤、多光子活体成像等方向发展。这些技术处在科学发展的活跃领域,提供研究细胞过程新方法。
除了成像技术本身外,显微成像系统的智能化是另一个研究重点。国外主要显微技术厂商(包括莱卡、奥林巴斯、尼康等)都推出具有自动功能的智能显微系统。将显微观察的全自动控制和图像采集方式转换全部自动完成。可以方便通过计算机软件进行图像最优化、数字共聚焦、三维/多维重建、定位、测量和图像分析,并具备自动拼图、目标追踪、测量等功能。最突出的成果如图4所示,为奥林巴斯公司智能生物图像导航仪及激光扫描共聚焦显微镜[24]。它将智能化技术和最先进的荧光显微技术集成,具有全内置、高智能、全自动的特点,可以自动识别标本类型、自动聚焦、自动曝光、自动生成多视野图像。这项技术成果和图2所示细胞培养机一起被美国《科学家》(The Scientist)杂志评为2009年度“生命科学领域十大最创新产品”之一。

图4 奥林巴斯智能生物图像导航仪及激光扫描共聚焦显微镜Fig. 4 Olympus bio imaging navigator and confocal laser scanning biological microscope
1.2.3 空间细胞系统的发展趋势
世界各国通过人体和动物、植物搭载实验,开展空间环境对于地球生命影响的宏观研究,并且通过空间细胞搭载,在空间环境对细胞影响的研究上也取得了巨大的成就。近年,为了进一步地深入研究失重生理效应发生的分子机理,从分子和基因水平解释失重环境诱导的生理病理改变,在太空中进行细胞搭载实验时,结合最新的细胞传感技术进行实时测量,逐步受到各国关注。特别是在基因组织学及先进细胞成像技术迅猛发展的背景下,这类研究的层次及所受关注度明显提高,代表了国际空间科学研究的前沿和发展方向。
为了进一步开展空间细胞生物学的研究,就必须在现有空间细胞培养装置的基础上,开发智能细胞传感系统。就像空间细胞生物学是人类进入航天时代以来细胞生物学在空间的延伸和发展一样,空间细胞系统也是地面细胞培养装置在空间特定环境下的延伸和发展。早期的无人空间细胞实验一般考虑了细胞的自动培养问题,但都是在培养装置返回地面后进行最终的分析,由于技术条件限制,没有考虑连续观察的问题,培养过程中的一些信息是无法获得的。而这些信息,例如发射和降落过程中的大过载是否造成细胞死亡、特定环境和时间下的细胞发育特点等,对于深入研究是很有用的。同时,科学家们也无法根据这些过程信息及时对实验过程进行干预。随着技术的发展,近期许多新的研究项目都提供了在线过程监控功能,图1(d)中的NASA CGBA即是一例,该装置允许科学家在任务过程中从地面监视并发送指令控制,但是在线过程监控都是在空间站有人参与下完成的,而缺乏无人自动智能成像功能。对于空间细胞培养实验,培养过程的图像是很有用的信息,可以帮助科学家深入研究空间细胞成长的特性。至今,尚未见到在培养过程中进行实时图像采集的实用的培养系统。同时,空间环境中可能存在长时间的失重、辐射以及大振幅、长时间的振动,这些必然对设备以及细胞环境提出更高的要求,必须充分考虑。选择合适的技术手段和整个观测装置的设计对于实验的成功实现具有重要意义。
因此,针对空间细胞培养环境的特殊需求,借鉴上文的先进地面细胞培养技术和先进的细胞成像技术,研究实时过程自动控制、自动追踪的微型化细胞系统,不仅对于提高我国空间生物学研究的总体水平具有重大的学术价值,而且对于提高我国地面细胞传感技术具有显著的社会效益和经济效益。
2 空间细胞生物学的研究现状及发展趋势
2.1 空间细胞生物学总体研究现状
生物反应的基本过程在于细胞的生长。由生命所特有的新陈代谢这一基本特点决定,生物反应体系与一般化学反应体系不同,是一个多组分、多相的非线性体系,其中既包括了各种细胞内部的生化反应、胞内与胞外的物质交换,也包含有胞外的物质传递和生化反应。而细胞生物学就是在基本的生物单位——细胞层面上观察生物进程。虽然一方面日益加入分子角度的研究,另一方面向组织层面扩展,但是细胞生物学研究主要着眼于单独特定细胞的本质现象和细胞对环境因素的响应。
细胞生物学为其他相关空间生物学研究提供支撑,包括发生生物学,肌肉、骨骼、矿物新陈代谢,心肺以及其他适应性系统,免疫学,运动感觉协调等。每个领域的组织和机体层面的研究最终决定于独立细胞的正常功能以及细胞融合所成的生理网络。
以往的医学研究已证实,空间环境会对人类心血管、骨骼和骨骼肌、免疫内分泌等系统产生影响,导致心血管功能障碍、肌肉萎缩、骨质减少、免疫功能低下、内分泌紊乱等病理变化。地面模拟微重力及辐射生物学研究,也从细胞水平证实了上述因素对细胞生物特性的影响。
研究空间环境对哺乳动物细胞的影响(特别是细胞培养)开始于最早的空间飞行,并且目前仍在继续[1-2]。例如,Dickson在1990年借助单独的细胞(微生物、植物和哺乳动物)进行了飞行实验。表2中列出了早期的微重力下细胞生物学实验的一些现象[25]。这些研究取得了一定的进展,但是多基于细胞现象的研究,限于早期传感技术的限制,还很少涉及过程及机理的研究。

表2 早期进行的微重力下细胞效应实验Table 2 Early cell experiments in microgravity
回顾过去,空间飞行对人类淋巴细胞、肺的胚细胞系、骨细胞以及其他细胞类型的细胞生理产生广泛影响已经得到证实[2]。这些影响包括繁殖的改变,基因表达的改变,信号传导的改变,形态改变,活动力以及细胞间相互作用即能量代谢的改变。
近年,随着空间细胞生物学的研究深入,人们认识到,空间环境更重要的是在细胞水平及至细胞亚显微结构水平上的效应。目前,对空间细胞生物学的研究已不仅仅是研究重力对哪些细胞有什么样的效应,而是具体研究细胞是如何感知重力,又如何将这种感知传递给细胞的各个层次,进而产生一系列的变化,并表现为各种生物效应的。
目前认为,细胞对重力的感受可分为4个阶段:1)刺激阶段——重力对细胞的刺激发生了变化;2)信息感知——重力刺激的变化导致膜极性的变化;3)膜极性的变化导致某些化学变化;4)化学变化导致各种生物效应。现在的研究重点在于2)、3)两阶段[25]。美国密歇根大学的Robert S Banduraki等人通过研究玉米种子细胞在重力刺激下的反应,他们认为细胞所在重力场的变化首先会导致细胞膜的极化,使得在导管组织和周围组织之间的质膜通道开启或关闭,使得分子有选择地流入茎的某一侧,使该侧更快地生长,从而导致植物生长特性的改变。宾夕法尼亚大学的Daniel T Cosgrove阐明了细胞膜极性的变化如何会引起化学变化,进而产生生物效应的。
由于细胞骨架可以感受重力并对其作出反应,因此空间微重力诱导的细胞学效应直接影响细胞骨架系统。Lewis等的研究显示,空间飞行条件下可以出现微丝、微管的解聚,Actin应激纤维、微管和中间纤维的形态异常,有序性降低,微管变短,细胞核周围的网状结构消失等[26]。微重力能够通过改变细胞骨架分布,影响细胞正常形态的维持和信号传导,导致细胞功能和增殖等细胞生物学特性的改变。并且,微重力通过直接或间接影响细胞骨架和信号传导来影响细胞的基因表达。大量研究表明,包括空间辐射和微重力等在内的空间特殊环境可以促使细胞性状产生变异、染色体发生畸变和基因表达发生改变等。但对于空间环境引起细胞发生这些改变的具体机制还不十分清楚,有待于进一步深入探讨[27]。
许多已描述的单一细胞(特别是在培养皿成长)对空间飞行环境的细胞响应,可以归结于微重力或其他飞行环境的间接作用。特别相关的是微重力下沉淀和热对流的缺乏,因为这导致细胞周围形成稳定的边界层,严重的还导致养分的摄取和气体交换的减少,以及有毒产物难以排除。例如,太空飞行实验中为植物拟南芥(Arabidopsis)提供足够的营养成分和气体交换的重要性已经得到Musgrave和同事的严密论证。相比地面情况,葡萄糖的消耗减少也可以近似用缺乏对流流动时营养物质和氧气难以传送来解释,这导致细胞成长速度放慢[2]。
然而,单细胞是否可以直接感受重力,又是如何感受的?因为相比于大得多的分子力,单一的正常尺寸细胞感受重力是很微小的。这时的问题变成力作用于单细胞可以被放大成为对生理起明显作用的信号吗?并且,哪些应归于重力对细胞的直接作用,哪些是细胞环境改变间接导致的结果?这些问题是空间细胞生物学必须回答的。
空间环境中的各个因素对细胞基因表达的影响并不是孤立的,而是相互联系、相互影响的。目前微重力与空间辐射的相互关系有多种观点,因此对于各因素的相互作用还需要进一步研究[28-29]。但是,限于以往的传感技术限制,实验缺乏过程数据,并且许多实验的进行缺乏足够的控制或难以重复进行。实验仪器的限制经常破坏实验的严谨性。这使得我们对造成这些变化的原因的机理理解还是有限的。
2.2 我国空间细胞生物学的研究现状
我国空间细胞生物学研究的起步较晚。从1998年中国航天员科研训练中心创建了航天分子生物学实验室起步,到“神舟六号”飞船首次进行搭载心肌和成骨细胞实验。航天生物学的研究也从整体水平跨越到细胞、分子水平。长期处于失重状态下可引起骨质脱矿、肌肉萎缩、心血管功能异常、呼吸系统异常、免疫系统异常以及中枢神经系统的改变等[25]。我国重点针对这些现象,展开空间细胞生物学的研究。
1)空间环境对骨细胞的影响
经过空间飞行的航天员出现不同程度的骨钙流失、骨强度降低等现象,这些现象引起了众多学者的关注。我国采用回转仪模拟失重,研究了失重对成骨细胞形态、结构、细胞骨架、成骨瘤细胞分裂与增殖、基因表达、细胞凋亡的影响,并深入探讨了其分子学机理[30-35]。在地面模拟的基础上,我国于1999年利用ESA的返回式卫星在法国的IBIS上搭载了3对成骨细胞,进行了为期96 h的失重飞行观察,以探讨失重飞行对成骨细胞增殖、结构和功能的影响及中药SHJ的防护效果的研究[30]。我国通过“神舟六号”飞船首次搭载了骨细胞,研究了空间飞行对新生大鼠成骨细胞数量、成骨细胞BGP分泌、成骨细胞ALP活性的影响等[36]。
2)空间环境对肺细胞的影响
失重或微重力状态下,重力缺失引起人体脏器生理功能的显著变化。肺脏是最易受重力影响的器官之一,而且通过对航天员的研究发现肺脏受损是肯定的。在肺损伤过程中细胞因子都发生着各种变化,有的起损伤作用,有的却是起保护作用。解放军总医院对空间环境对肺功能的影响研究最多,他们主要采用模拟失重的方法进行空间环境对肺细胞的实验研究,但还未见空间搭载的报道。研究证实模拟失重对肺细胞的影响,造成肺脏的生物活性物质的改变及细胞因子的变化[37-46]。
3)空间环境对心肌细胞的影响
空间飞行以及模拟失重时均可出现心血管功能的障碍[47-48]。我国失重生理学研究中,失重心血管系统的研究起步最早,研究范围最广、最深入。目前认为,空间环境下心脏功能减弱主要与以下3个方面有关[49]:心肌细胞尤其是肌浆网的Ca2+转运功能降低;心肌收缩蛋白结构改变,其与Ca2+结合的能力可能改变;心肌内的内皮细胞调节功能减弱。
我国通过地面模拟,研究发现失重抑制心肌功能,导致细胞收缩力减弱、细胞骨架分布改变、基因表达和信号传导改变,并研究了其可能的机理[50-53]。在地面模拟实验研究的基础上,我国在国际上首次开展了心肌细胞空间实验研究和空间药物实验[36],研究了空间飞行对细胞结构的影响和细胞功能的影响,并首次证实微重力抑制体外培养的心肌细胞功能,影响细胞骨架的有序性。对成骨细胞分析发现,空间飞行降低了成骨细胞的功能。
4)空间环境对神经细胞的影响
重力对神经系统发育具有重要影响,由于重力的作用,胚胎中枢神经元的轴突可以到达各自靶区,维持神经系统正常发育和机能。微重力环境导致神经元骨架蛋白的分布排列紊乱,影响神经系统的细胞发育[54-56]。
5)空间环境对免疫细胞的影响
我国失重免疫功能研究主要进行了模拟失重对免疫系统的影响及机理探讨。通过地面模拟和空间搭载,证明了失重可引起人和动物的非特异性免疫功能下降,细胞免疫功能和细胞因子的改变[57-62],并且进一步研究了产生这些变化的机理[63-64]。另外,我国在航天因素引起免疫功能变化的机理和防护措施上也进行了一些研究[63]。
实验证明,空间环境可以引起机体免疫系统和神经内分泌系统的功能发生紊乱,其中所伴随的有关生理、生化指标的变化仍存在一些争议;而且各系统的改变是否有内在的因果关系,关系又是如何,这些都需要做进一步探讨。空间环境能够使机体免疫细胞因子分泌发生变化,而且目前关于这方面的研究仅此而已,至于航天飞行环境中机体的免疫细胞因子对神经内分泌系统的影响尚不清楚[61,65]。
6)空间环境对肿瘤细胞的影响
在空间环境中,微重力和微磁场可增加生物体对诱变因素的敏感性,增加变异发生的概率;高能重粒子系统和射线辐射则有可能使生物体细胞DNA损伤,从而引发可遗传的变异。这为我们利用空间环境诱变细胞,探索肿瘤免疫治疗新途径提供了条件。我国对搭载在“神舟四号”飞船及第18颗返回式卫星上的小鼠黑色素瘤B16研究细胞的细胞核变化显著,在此基础上研究了空间环境的复合作用对黑色素瘤B16体内成瘤性、蛋白水平、细胞间黏附能力、基因表达、细胞间通讯的影响[66-71]。
美国和俄罗斯(前苏联)经过40多年的载人航天实践,空间细胞生物学的研究条件很强,并积累了丰富的太空实验经验和数据;而我国在空间细胞生物学领域起步较晚,在技术和投入方面与先进国家有一定差距。因此,必须根据我国的实际情况,在认真的调研和地面实验的基础上,结合目前我国载人航天以中短期飞行为主的实际情况,将整体—细胞—分子水平的研究结合在一起,借助最新地面细胞传感技术,开发先进的空间细胞硬件系统,展开进一步研究,以便更好地找出空间生命活动的规律性,更深入了解其生理机制,推进我国生命科学的发展。
2.3 空间细胞生物学研究的趋势
现代分子生物学技术的迅速发展和科技的进步,特别是随着后基因组时代的到来,某些已知细胞基因已经成功实现克隆,并且它们的规则和基因产物也越来越被我们认知。先进的测试仪器,包括电子和X光衍射、磁共振、质谱分析以及基于计算机计算分析和分子建模的瞩目成就,彻底地颠覆了传统结构生物学,这些成果把对蛋白质如何记录具体生理反应的认识提升到了一个新的高度。
以往大量的研究证明许多细胞品种的干细胞,包括骨骼、肌肉、器官等,可以在可控制分化的环境下培养生长。随着微质量培养、微球体培养和生物反应器等细胞培养技术的研究,使得离解细胞培养技术日益提高,同时,分离块培养、切片培养、重新聚集培养为解离的细胞群和完整的组织间提供中间步骤。初始状态位置、迁移、区别具体干细胞的特征分子的识别,使得我们可以分别在培养皿和在活体内分析细胞谱系细节,包括源的微环境规则、迁移以及区分[72-74]。并且上文中提出的先进自动细胞培养技术、荧光成像技术和最新的智能成像技术相结合,必将提升未来的空间细胞装置,通过开发出具备实时观察的细胞智能培养系统,使得基于地面的细胞研究问题同时也将成为空间生物医学研究的热点[75-76]。
1)细胞的增殖和调控[2,77]
细胞正常的分裂、增殖、分化与衰老维持着机体自身的稳定,细胞周期的异常会导致这一系列过程的紊乱。细胞的增殖是通过细胞周期来实现的,所以研究细胞增殖的基本规律及细胞周期的调控机制,不仅是控制机体生长发育的基础,也是研究细胞癌变发生及控制的重要途径。空间环境的特殊性为这些研究提供了机会,包括细胞基因是如何进行复制和保持的。不仅涉及细胞正常的生长发育(包括衰老),而且涉及到癌症生物学。例如,特定肿瘤抑制途径的识别,调节细胞存活和死亡遗传学程序的相互作用,阐述解释染色体端粒长度和它对基因表现的影响;还包括单独细胞如何执行遗传学分化和发展的程序,发展成特化的组织和多细胞机体。研究将有助于在细胞水平上解释在生长发育过程中,导致具体谱系途径选择的关键性基因和表观遗传事件。
2)细胞的衰老和死亡[78-79]
细胞死亡有两种类型:细胞程序性死亡(细胞凋亡)和细胞坏死。研究表明细胞凋亡与个体生长、发育以及疾病发生和防治有着密切的关系,所以找出细胞凋亡的关键调控基因及其作用机制将是研究细胞死亡的重点工作。当前多集中于分子水平上的研究,如探索衰老相关基因、癌基因或抑癌基因等癌肿相关基因与细胞衰老的关系,及一些与疾病有关的物质在衰老中的作用等。需要研究空间环境对细胞衰老和死亡的影响。
3)细胞骨架(包括核骨架与染色体骨架)
研究细胞如何产生和保持包括细胞骨架与大量特定的附着薄膜在内的细胞器及薄膜区域复杂的内部细胞结构,并且调节它们的发育和结构。细胞膜中心附着复合物的局部扰动被传递遍及整个细胞体,会导致深远的影响[80-81]。这通过连接细胞表面到细胞骨架和核基质,融合各独立部分组成为一个复杂网络实体。太空环境的长期微重力环境等对细胞骨架的形成和功能影响需要进行深化研究。
4)细胞外环境改变时有机体在细胞水平的响应如何[82-85]
主要涉及细胞通讯和细胞信号传导。高等生物所处的环境无时无刻在变化,细胞作为一个生命的基本单位,一个相对独立的系统,如何识别周围环境中存在的各种信号,并将其转变成细胞内各种分子功能上的变化,从而改变细胞内的某些代谢过程,影响细胞的生长速度,甚至诱导细胞的死亡。研究的关键点包括信号接收或探测装置以及机械性刺激感受器。研究细胞的机械性刺激感受作用装置应该包括细胞受体的识别,研究在细胞薄膜和细胞骨骼结构内的可能变化,分析反应的传递路径,包括实时的信号传递和识别以及可能的离子跃迁空间。细胞对空间飞行造成的环境应力(例如缺氧、温度、冲击、振动等)的研究应该包括细胞受体本质的研究,信号传导路径的研究,基因表达改变的研究,以及鉴别、协调响应应力蛋白质的结构和功能分析研究。研究结果将成为疾病机制研究(如肿瘤、药物中毒)、药物的筛选及毒副作用研究的基础。
3 对策与建议
本文总结了以往空间细胞生物学的研究成果和空间细胞装置的发展,给出了未来空间生物学的研究趋势。但是,无论是开展地面研究还是空间细胞研究,都必须有相应的硬件设备,需要基于地面的先进细胞培养技术和先进细胞传感技术,发展高度智能化的专用空间仪器设备以及先进的实验方法。
由于空间环境的特殊性(振动、冲击、温度、压力、真空、辐射等),很难严格地评价一些空间飞行中采用细胞培养技术的生物研究。所以,为了减小这些因素的影响,细胞研究的相关实验装置(包括细胞培养及传感设备)应该在实验前进行仔细评估,考虑其在空间环境中应用的合理性,尽可能地进行地面环境测试;充分考虑测试硬件的可用性和执行适当控制的能力;一些精选的模型系统应该便于实验中进行对照,建立可靠的数据基础和充足的样本容量,以及实验的可重复性。同时,硬件设备的低功耗、微小型化、抗干扰性以及系统稳定性也是必须优先考虑的。
(
)
[1] Space Science Board, National Research Council. A strategy for space biology and medical science for the 1980s and 1990s[M]. Washington, D C: National Academy Press, 1987
[2] Committee on Space Biology and Medicine, National Research Council. A strategy for research in space biology and medicine into the next century[M]. Washington, D C: National Academy Press, 1998
[3] 吴国兴. 航天医学的发展[J]. 航天医学与医学工程, 1994, 7(2): 146-150
[4] 蒋远大, 李维宁, 王鲁峰, 等. 几种新型回转器[J]. 航天医学与医学工程, 2008, 21(4): 368-371
[5] Buravkova L B, Grigorieva О V, Rykova M P. The effect of microgravity on the in Vitro NK cell function during six International Space Station missions[J]. Microgravity Science Technology, 2007, XIX-5/6: 145-147
[6] Slenzka K. Neuroplasticity changes during space flight[J]. Advances in Space Research, 2003, 31(6) :1595-1604
[7] Yang Cheng, Li Yuehui, Zhang Zhijie, et al. Effects of space flight exposure on cell growth, tumorigenicity and gene expression in cancer cells[J]. Advances in Space Research, 2008, 42: 1898-1905
[8] Blakely E A, Chang P Y. A review of ground-based heavy-ion radiobiology relevant to space radiation risk assessment. Part II: cardiovascular and immunological effects[J]. Advances in Space Research, 2007, 40: 461-469
[9] Durante M, Manti L. Human response to high- background radiation environments on Earth and in space[J], Advances in Space Research, 2008, 42: 999-1007
[10] 汤章城. 空间生物技术研究与应用动态[J]. 生命科学, 2002, 12(6): 375-378
[11] Salmonella spills its secrets on the space shuttle[EB/OL]. [2009-05-06]. http://science.nasa.gov/headlines/y2009/ 06may_ salmonella.htm
[12] Wilson J W, Ott C M, Höner zu Bentrup K, et al. Space flight alters bacterial gene expression and virulence and reveals a role for global regulator Hfq[J]. PNAS, 2007, 104(41): 16299-16304
[13] 吴汉基, 蒋远大, 张志远, 等. 空间细胞与组织培养装置的发展[J]. 中国航天, 2005(2): 16-19
[14] Kern V D, Bhattacharya S, Bowman R N , et al. Life sciences fFlight hardware development for the International Space Station[J]. Advances in Space Research, 200l, 27(5): 1023-1030
[15] Commercial Generic Bioprocessing Apparatus (CGBA)[EB/OL]. [2009-02-02]. http://www.nasa.gov/ centers/marshall/news/background/facts/cgba.html
[16] Nusrat A, Delp C, Madara J L. Intestinal epithelial restitution characterization of a cell culture model and mapping of cytoskeletal elements in migrating cells[J]. Epithelial Cell Motility in Restitution, 1992, 89(5): 1501-1511
[17] Gmünder F K, Suter R N, Kiess M, et al. Mammalian cell cultivation in space[J]. Advances in Space Research, 1989, 9(11): 119-127
[18] Nachman1 R L, Jaffe E A. . Endothelial cell culture: beginnings of modern vascular biology[J]. The Journal of Clinical Investigation, 2004, 114(8): 1037-1040
[19] Leland D S, Ginocchio C C. Role of cell culture for virus detection in the age of technology[J]. Clinical Microbiology Reviews, 2007, 20(1): 49-78
[20] Hall K K, Lyman J A. Updated review of blood culture contamination[J]. Clinical Microbiology Reviews, 2006, 19(4): 788-802
[21] Wu Minhsien , Huang Songbin , Cui Zhanfeng, et al. Development of perfusion-based micro 3-D cell culture platform and its application for high throughput drug testing[J]. Sensors and Actuators B, 2008, 129: 231-240
[22] BioLevitatorTM3D cell culturing developed for the benchtop[EB/OL]. [2010-06-10]. http://www.hamiltoncompany. com/products/biolevitator/c/819/
[23] GEMTM3D cell culture simplified[EB/OL]. [2010-06-10]. http://www.globalcellsolutions.com/index. php?p=gem
[24] 年度生命科学十大创新揭晓,多合一显微镜渐成趋势[EB/OL]. [2010-02-05]. http://news.xinhuanet.com/tech/ 2010-02/05/content_12937840.htm
[25] 汪恭质, 张晓铀. 空间细胞生物学研究的动态和意义[J]. 航天医学与医学工程, 1996, 9(3): 228-231
[26] Lewis M L, Cubano L A. The cytoskeleton in spaceflown cells: an overview[J]. Gravit Space Biol Bull, 2003, 17(1): 3
[27] 蔡哲, 张岚, 舒峻, 等. 空间环境因素对细胞生物学特性的影响[J]. 中国康复理论与实践, 2005, 11(1): 42-44
[28] Boonstra J. Growth factor-induced signal transduction in sdherent mammalian cells is sensitive to gravity[J]. FASEB J, 1999, 13(Suppl): 35-42
[29] Kobayashi Y, Nagaoka S. Recovery of deinococcus radiodurans from radiation damage was enhanced under microgravity[J]. Biology Science Space, 1996(10): 97-101
[30] 沈羡云, 王林杰. 我国失重生理学研究进展[J]. 航天医学与医学工程, 2008, 21(3): 182-187
[31] 丁柏, 汪恭质, 张晓铀, 等. 模拟失重和超重刺激对体外培养成骨瘤细胞分裂、增殖影响的研究[J]. 航天医学与医学工程, 1997, 10(2): 104-107
[32] 张晓铀, 汪恭质, 丁柏, 等. 模拟失重对成骨样细胞细胞周期变化的影响[J]. 中华航空航天医学杂志, 2000, 11(1): 43-45
[33] 王冰, 张舒, 吴兴裕. 模拟失重条件下骨形态发生蛋白-2对大鼠骨肉瘤成骨样细胞基因表达的影响[J].航天医学与医学工程, 2004, 17(3): 176-179
[34] 孟芮, 续惠云, 王哲, 等. 模拟失重骨细胞条件培养基对成骨细胞活性的影响[J]. 航天医学与医学工程, 2009, 22(4): 247-251
[35] 续惠云, 安龙, 王哲, 等. 模拟失重对人成骨样细胞凋亡的影响[J]. 细胞生物学杂志, 2008, 30: 651-654
[36] 丁柏, 李莹辉, 谭映军, 等. 空间飞行对心肌细胞和成骨细胞结构功能的影响[C]//中国科协年会, 2006: 84-89
[37] 李天志, 刘长庭, 李向红, 等. 模拟失重时对大鼠肺组织 NF-κB表达的影响[J]. 解放军医学杂志, 2006, 31(10): 997-998
[38] 李天志, 刘长庭, 李向红, 等. 模拟失重时对大鼠血清及肺组织细胞间黏附分子-1的影响[J]. 军医进修学院学报, 2006, 27(6): 401-403
[39] 孙磊, 向求鲁, 汪德生, 等. 微重力与模拟微重力条件下肺循环变化[J]. 航天医学与医学工程, 2003, 13(4): 305-309
[40] 冉王鑫, 欧阳能太, 陈顺存, 等. 原癌基因 SIS,C-fos在缺氧大鼠肺内的表达的研究[J]. 中国组织化学与细胞化学杂志, 1996, 5(4): 473
[41] 李天志, 刘长庭, 李向红, 等. 模拟失重对大鼠血清及肺组织细胞因子的影响研究[J]. 重庆医学, 2007, 36(12): 1152-1154
[42] 郝从军, 刘长庭, 王俊锋. 模拟失重对大鼠肺动脉eNOS表达的影响[J]. 解放军医学杂志, 2006, 31(7): 704-705
[43] 王林林, 魏文宁, 陈智超. 一氧化氮对血管内皮细胞凋亡的影响[J]. 中国血栓与止血学杂志, 2002, 8(4): 162-164
[44] 章烨, 袁明, 李婷, 等. 模拟失重对肺微血管内皮细胞F-actin的影响[J]. 军医进修学院学报, 2009, 30(1): 91-92
[45] 章烨, 袁明, 李婷, 等. 模拟失重对肺微血管内皮细胞凋亡的影响[J]. 军医进修学院学报, 2009, 30(1): 93-94
[46] 王俊锋, 刘长庭, 刘岩, 等. 模拟失重对大鼠肺微血管通透性的影响[J]. 军医进修学院学报, 2003, 24(1): 13-15
[47] 岳茗, 张小铀, 汪恭质, 等. 模拟失重对培养心肌细胞形态和结构的影响[J]. 空间科学学报, 1998, 18(1): 75-80
[48] 张晓铀, 汪恭质, 丁柏, 等. 模拟失重和辐射对体外培养心肌细胞代谢的影响[J]. 航天医学与医学工程, 1998, 11(4) :258-261
[49] 耿传营, 向青, 房青, 等. 空间环境对细胞与动物的影响[J]. 中国康复理论与实践, 2004, 10(11): 657-659
[50] 李莹辉, 丁柏, 汪恭质, 等. 药物对模拟失重条件下心肌细胞功能的保护作用[J]. 中华航空航天医学杂志, 1999, 10(2): 73-76
[51] 熊江辉, 李莹辉, 聂捷琳, 等. 模拟微重力和槲皮素对心肌细胞微丝和微管分布的影响[J]. 动物学报, 2003, 49(1): 98-103
[52] 郑琪, 刘朝霞, 黄伟芬, 等. 模拟失重对大鼠心肌组织细胞因子基因表达谱的影响[J]. 航天医学与医学工程, 2008, 21(1): 11-15
[53] 杨芬, 李莹辉, 马永洁, 等. 回转模拟失重对心肌成纤维细胞生长因子及 ERK信号传导的影响[J]. 航天医学与医学工程, 2003, 16(增刊): 532-537
[54] 冯林音. 空间飞行对培养的神经细胞的影响[J]. 空间科学学报, 1997, 17(增刊): 62-66
[55] 王菁华, 孙博, 王广友, 等. 模拟微重力条件下体外培养神经细胞模型的初步建立[J]. 中华航空航天医学杂志, 2006, 27(3): 169-171
[56] 戢玉环, 李呼伦, 王丹丹, 等. 模拟微重力对神经细胞形态及其生长的影响[J]. 航天医学与医学工程, 2007, 20(5): 327-331
[57] 汪涛, 温秀兰, 杨光华, 等. -6°卧床模拟失重对T淋巴细胞的影响及内分泌调节机制的研究[J]. 空间科学学报, 1998, 18(3): 261
[58] 汪涛, 杨光华. 空间飞行因素对免疫系统的影响和机制[J]. 航天医学与医学工程, 1996, 9(1): 70-74
[59] 温秀兰, 杨光华, 汪涛, 等. 模拟失重对小鼠 T细胞亚群及IL-2、IL-6活性的影响[J]. 航天医学与医学工程, 2001, 14(1): 60-62
[60] 张虹, 胡平, 黄宾. 尾部悬吊对大鼠淋巴细胞 AP-1基因表达的影响[J]. 中华航空航天医学杂志, 2001, 12(1): 43-45
[61] 杨光华, 温秀兰, 王宝珍, 等. 模拟失重(HDT-30o)和噪声复合因素对大鼠神经-内分泌-免疫功能的影响[J].空间科学学报, 1994, 14(3): 2l0-213
[62] 司少艳. 航天因素对T淋巴细胞功能的影响及其机制探讨[J]. 航天医学与医学工程, 1997, 10(2): 153-156
[63] 汪涛, 杨光华, 温秀兰. 模拟失重对大鼠免疫功能和垂体β争内啡肽的影响[J]. 中华航空医学杂志, 1995, 6(3): 138-142
[64] 司少艳, 汪涛, 杨光华. 从IL-2和Bcl-2基因转录水平探讨模拟失重鼠T淋巴细胞功能改变的机制[J]. 航天医学与医学工程, 1998, 11(4): 254-257
[65] 章烨, 王常勇. 空间飞行对免疫功能影响的研究进展[J].中华航空航天医学杂志, 2007, 18(2): 134-138
[66] 唐劲天, 房青, 向青, 等. 太空环境诱导肿瘤细胞变异的初步结果[J]. 中日友好医院学报, 2003, 17(4): 229-231
[67] 唐劲天, 向青, 徐梅, 等. 空间诱变肿瘤细胞的初步实验[J]. 中国康复理论与实践, 2004, 10(11): 641-643
[68] 郭宇鹏, 唐劲天, 徐梅, 等. 太空环境对黑色素瘤B16细胞成瘤性的影响[J]. 中华防射与防护杂志, 2005, 25(4): 301-304
[69] 向青, 肖诚, 徐梅, 等. 空间环境对黑色素瘤细胞基因表达谱的影响[J]. 中华航空航天杂志, 2006, 17(3): 165-168
[70] 柴大敏, 向青, 徐梅, 等. 空间环境对恶性黑色素瘤B16细胞间通讯功能的影响[J]. 科技导报, 2007, 25(2): 41-44
[71] 耿传营, 向青, 徐梅, 等. 空间环境对黑色素瘤 B16细胞致瘤基因和蛋白质表达的影响[J]. 科技导报, 2007, 25(3): 34-38
[72] Gmünder F K, Suter R N, Kiess M, et al. Mammalian cell cultivation in space[J]. Advances in Space Research, 1989, 9(11): 119-127
[73] Nachman1 R L, Jaffe E A. Endothelial cell culture: beginnings of modern vascular biology[J]. The Journal of Clinical Investigation, 2004, 114(8): 1037-1040
[74] Leland D S, Ginocchio C C. Role of cell culture for virus detection in the age of technology[J]. Clinical Microbiology Reviews, 2007, 20(1): 49-78
[75] Richard Wingate, Marius Kwint. Imagining the brain cell: the neuron in visual culture[J]. Nature Reviews: Neuroscience, 2006, 7(9): 745-752
[76] Stephens D J, Allan V J. Light microscopy techniques for live cell imaging[J]. Science, 2003, 300(5616): 82-87
[77] Moos P J, Fattaey H K Johnson T C. Cell proliferation inhibition in reduced gravity[J]. Experimental Cell Research, 1994, 213(2): 458-462
[78] Joanna Owens. Cell death by design[J]. Nature Reviews: Drug Discovery, 2005(4): 539
[79] Bourg E L. A review of the effects of microgravity and of hypergravity on aging and longevity[J]. Experimental Gerontology, 1999, 34: 319-336
[80] Jongkind J F, Visser P, Verkerk A. Cell fusion in space plasma membrane fusion in human fibroblasts during short term microgravity[J]. Advances in Space Research, 1996, 17(6/7): 21-25
[81] Gaubin Y, Prkvost M C, Criven C, et al. Enzyme activities and membrane lipids in artemiacysts after a long duration space flight[J]. Advances in Space Research, 1996, 18(12): 221-227
[82] Kholodenkol B N, Kolch W. Giving space to cell signaling[J]. Cell, 2008, 133(5): 566-567
[83] Belting M, Dorrell M, Sandgren S, et al. Regulation of angiogenesis by tissue factor cytoplasmic domain signaling[J]. Nature Medicine, 2004, 10(5): 502-509
[84] Kordyum E L. Calcium signaling in plant cells in altered gravity[J]. Advances in Space Research, 2003, 32(8): 1621-1630
[85] Schwarzenberg M, Pippia P, Melon M A, et al. Signal transduction in T lymphocytes—a comparison of the data from space, the free fall machine and the random positioning machine[J]. Advances in Space Research, 1999, 24(6): 793-800

