miR-221功能研究进展
陆黎敏,高学军,李庆章,李 晔,李 春,刘 杰
(东北农业大学乳品科学教育部重点实验室,哈尔滨 150030)
MicroRNAs(miRNAs)是一类长 21~28 个核苷酸的小分子非编码RNA(non-coding RNA,ncRNA),它通过碱基互补与靶基因mRNA结合,从而抑制靶基因的表达。目前研究主要采用miRNA表达谱微阵列技术和生物信息学技术相结合的方法,高效且特异地发现生物体中的新miRNA[1]。miRNA一般来源于染色体的非编码区域,由大约70个碱基大小的可形成发夹结构的前体经Dicer酶加工而来。这类小RNA在表达上具有保守性、时序性和组织特异性,是调节其他功能基因表达的重要调控分子,在生物的生长发育过程中发挥着重要作用。最近的研究表明,miRNA参与神经系统的发育[2]、胰岛素分泌和脂肪细胞调控[3-4]、造血和红系分化[5-6]、细胞凋亡和肿瘤形成[7-8]等,在不同的调节途径中发挥着重要作用。
1 miRN A的成熟过程
miRNA的生物起源是一个复杂的过程[9]。miRNAs与一般的mRNA一样,都是由RNA聚合酶Ⅱ在核内转录,转录后会经过一些加工,主要是5'端的加帽和3'端的多聚腺苷化形成产物称pri-microRNA。随后它将经历两次剪切过程,第一次是在核内,被 RNaseⅢ酶Drosha在Pasha(也称DGCR8)的帮助下剪切成约70 nt大小的前体premicroRNA[10];pre-microRNA在 Exportin5蛋白帮助下转运出细胞核,进入细胞质,再经细胞质中的RNaseⅢ酶 Dicer剪切成约 22bp的双螺旋结构,然后由RNA双链解旋酶解螺旋,双链miRNA中的一条进入一个核糖蛋白复合体miRNP(也叫RISC),miRNA通过与靶基因的3'非翻译端(3'UTR)互补配对,指导miRNP复合体对靶基因mRNA进行切割或者翻译抑制(见图1)[11-12]。

图1 miRNA的形成过程Fig.1 Formation process of miRNA
2 miR-221的简介
miR-221基因大约位于X染色体18723420~18723514bp之间[13]。在miRBase中查得miR-221的茎环结构(见图2)。

图2 miR-221的茎环结构Fig.2 Stem-loop structure of miR-221
依照GenBank发表的miR-221序列是5'AGCUACAUUGUCUGCUGGGUUUC 3'。miR-221 的茎环结构在Dicer酶的作用下被剪切产生成熟的miR-221。已有文献中指出miR-221能够与目标基因所转录出的mRNA的3'UTR区特定序列互补配对,形成miRNA复合体[14-15]。在脊椎动物中miR-221与mRNA互补配对时为不完全配对,miR-221的5′端的2~8位置的7个核苷酸被称为种子序列[16],这一段核苷酸吻合度被认为最为重要,与靶mRNA结合中起着重要作用。
3 miR-221的功能研究
3.1 与发育相关
3.1.1 血液系统
在脐血CD34+造血干细胞培养中,miR-221的表达水平显著下调。Felli等通过生物信息学分析表明,miR-221的作用靶位点是Kit mRNA的3'UTR区。荧光素酶检测也证实miR-221直接与Kit mRNA的靶位点相互作用。在红细胞生成培养中,红细胞呈对数生长,miR-221表达下调,提高了Kit蛋白表达水平,而Kit mRNA表达水平不变。功能学研究表明,寡核苷酸转染的CD34+干细胞中,抑制红细胞增殖与分化,并且Kit蛋白表达水平降低。此外NOD-SCID小鼠转基因试验中,在miR-221处理过的CD34+干细胞嵌入能力和活性降低。说明在红细胞对数生长期沉寂miR-221,开启了Kit mRNA的信号传导通路,提高了Kit蛋白表达水平,从而使Kit能够作用其受体促进红细胞增殖和分化,但Kit mRNA水平不变(见图3)[17]。这些结果提示,miR-221能够与靶基因Kit mRNA结合,在转录水平引起mRNA的翻译抑制,从而影响红细胞生成。
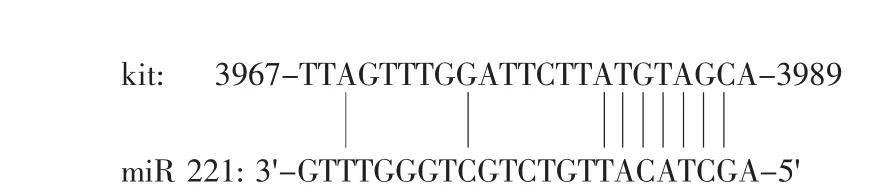
图3 miR-221在Kit mRNA 3'UTR作用的靶位点Fig.3 Kit mRNA 3'UTR site targeted by miR-22
3.1.2 血管生成
Dicer酶是microRNA成熟的关键酶,为了证明Dicer酶的作用和miRNAs在人内皮细胞中关于血管生成的重要性,通过特异性的沉默Dicer来减少内皮细胞中miR-221的含量,并且研究内皮细胞的表型。沉默内皮细胞中的Dicer,改变了内皮生物学和血管生成相关调控因子的表达。例如,TEK/Tie-2、KDR/VEGFR2、Tie-1、内皮型一氧化氮合成酶(eNOS)、IL-8等。尽管Dicer沉默后激活了内皮型一氧化氮合成酶途径,但却减少了内皮细胞增殖和索状结构。提示Dicer沉默后,miRNA-221调节内皮型一氧化氮合成酶蛋白水平[18]。
在c-kit基因编码的一种跨膜受体蛋白(c-kit蛋白)阳性人脐静脉上皮细胞(HUVEC)中,c-kit蛋白由SCF(干细胞因子)激活促进人脐静脉上皮细胞分化形成导管以及细胞的迁移、存活。为了研究miR-221是否调节c-kit蛋白水平和生物活性,在miR-221转染复合物中,c-kit的含量降低而mRNA水平不改变。而在受体水平降低可能减弱了干细胞因子的生物学效应。根据这个假说,研究发现转染miR-221超表达子的细胞,在SCF作用下,不能够使细胞分化形成导管。为了证明miR-221和c-kit之间直接的相互作用,建立了一种异源系统。miRanda预测 miR-221靶基因是 c-kit,在其mRNA的3'UTR区的靶位点是215,TargetScan预测的靶位点是1030和1959。在已公布的c-kit mRNA序列里不是都有1959靶位点,因此为了降低预测假阳性,需要采用目前公认的预测精度高、算法原理各异的软件,并且取其交集,来最后得出预测的靶基因。综上所述,这些结果表明了miR-221调节c-kit蛋白水平,miR-221和c-kit的相互作用在红细胞生成过程中有非常重要的作用,也可能是在生理和病理(肿瘤生长)条件下新生血管形成起作用[19]。
3.1.3 乳腺
王春梅等分别取青春期、妊娠期、泌乳期、退化期等各个时期小鼠乳腺组织分别进行miRNA芯片杂交[20],结果表明,miR-221在小鼠乳腺发育的各个时期表达不同。通过脂质体转染技术,在小鼠乳腺细胞株中转染miR-221抑制子,从而改变miR-221在小鼠乳腺上皮细胞和组织中的表达量,并采用高效液相色谱(HPLC)、Western印迹、电镜技术等检测miR-221对小鼠乳腺上皮细胞和乳腺组织的影响。结果表明,miR-221沉寂后,乳腺上皮细胞增殖能力增强,β-酪蛋白的表达增加,生长激素受体(GHR)表达增强,小鼠泌乳量增加。提示miR-221可能通过抑制靶蛋白GHR表达,进而抑制乳腺上皮细胞增殖和泌乳[21]。
3.2 与疾病相关
3.2.1 肝癌
Fornari等研究表明[22],miR-221在人的肝癌细胞中表达含量比正常细胞高,并且miR-221负调控细胞周期蛋白依赖性激酶抑制剂CDKN1B/p27和CDKN1C/p57。miR-221能与CDKN1C/p57的mRNA 3'UTR区结合,影响其mRNA的翻译。在肝癌细胞株中转染miR-221抑制子,有效的下调miR-221的表达,并使CDKN1B/p27和CDKN1C/p57蛋白含量升高 。在人的肝癌细胞中,上调的miR-221通过抑制CDKN1B/p27和CDKN1C/p57水平,从而增加了DNA合成期细胞的数量,实验证明CDKN1B/p27和CDKN1C/p57是miR-221的靶基因。后来Gramantieri等通过转染方法[23],将miR-221抑制子和超表达子转入肝癌细胞中,发现miR-221负调控Bmf,并证明Bmf也是miR-221的靶基因。因此通过抑制肝癌细胞系中miR-221表达,上调 p27、p57和Bmf对肝癌进行治疗,将会给治疗肝癌提供一个新思路。
3.2.2 乳腺癌
Zhao等研究雌激素α表达调控子发现了一系列miRNA[24],这些miRNA在雌激素受体α(ERα)阴性乳腺癌中表达水平明显提高。在ERα阴性细胞中上调的miRNA中,miR-221直接作用在ERα 3'UTR区。miR-221在MCF-7和T47D细胞的异位表达,导致了ERα蛋白表达下降,而mRNA不减少,而在ERα阴性或mRNA阳性细胞中,沉寂miR-221可以使ERα表达上调。特别是转染miR-221的MCF-7和T47D细胞对三苯氧胺耐药性比对照组细胞强,而且沉寂miR-221使MDA-MB-468细胞系对三苯氧胺诱导细胞生长抑制和凋亡敏感,这些发现表明乳腺组织中miR-221的表达与ERα表达有关,ERα阴性表达的乳腺癌细胞系的miR-221表达水平高于ER阳性表达乳腺癌细胞系,提示miR-221通过靶向ERα,参与乳腺癌的治疗。许践刚等的研究也认为miR-221为乳腺癌重要的标记物[25]。
3.2.3 甲状腺癌
Pallante等用微阵列芯片对人甲状腺癌组织和正常组织进行分析[26],发现miR-221在甲状腺癌组织中的表达显著上调。人甲状腺癌细胞系(NPA)转染pRS-GFP-Neo-221和pRS-GFP-Neo,并利用Northern blot、荧光定量等方法分析miRNA-221过表达影响甲状腺癌细胞的生长,通过转染方法沉默miR-221后,甲状腺癌细胞增殖能力下降,说明miR-221促进甲状腺癌细胞增殖。miR-221(左侧)与Kit mRNA(右侧)杂交。箭头指示为结合部位的一个多态性区域SNPrs17084733。
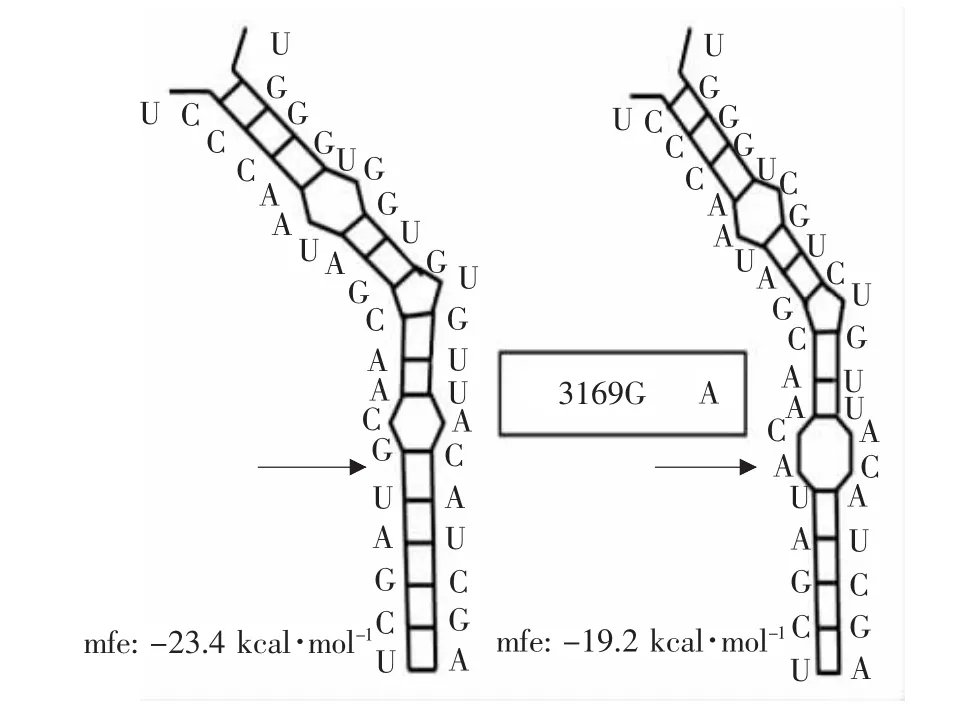
图4 计算机模拟miR-221与kit基因的相互作用Fig.4 Interaction between miR-221 and kit mRNA by computer simulation
He等检测乳头状甲状腺癌患者病例组织的miRNA表达情况时,发现miR-221转录水平明显升高,并且miR-221在乳头状甲状腺癌的临近的正常组织中表达也升高,表明可能与早期肿瘤形成有关,而且miR-221对Kit的转录和蛋白含量的抑制明显(见图 4)[27]。
3.2.4 胰腺癌
Lee等以人的胰腺癌组织、良性胰腺组织、正常胰腺组织、慢性胰腺炎组织以及九个胰腺癌细胞系为研究对象,原位反转录聚合酶链式反应表明,miR-221在胰腺癌细胞中表达水平高,并且差异显著,而在胰腺间质、正常胰腺腺泡和导管中表达差异不显著,microRNA在胰腺癌细胞中的差异表达将会为胰腺肿瘤发生提供新的线索[28]。
潘国伟等从miRNA资料库中搜寻miR-221可能的目的基因,筛选出了HIF-1β基因为可能的目标基因。HIF-1β为缺氧诱导因子(Hypoxia-inducible factor-1,HIF-1)其中的一个子单元,HIF-1转录因子在许多重要的细胞活动中扮演重要的角色。作者以消化道系统的癌细胞株为研究模型,在此细胞株中转染miR-221超表达子和抑制子,然后用Western blot分析HIF-1β蛋白的表达情况,结果证实miR-221抑制HIF-1β蛋白表达。然后又构建载体,其中载有正常的或miR-221种子位点识别序列突变的HIF-1β基因3'-UTR片段的报道基因质体,进行活性分析,证实HIF-1β确实是miR-221的目标基因。最后将miR-221抑制子注入裸鼠,观察miR-221对胰脏癌细胞增生的影响。研究结果表明,miR-221对胰腺癌细胞增生有显著作用[29]。
3.2.5 恶性胶质瘤
le Sage等在p27Kip13'UTR的上游构建了含有GFP编码区逆转录病毒载体[30],将其转入Hela细胞中,荧光报告显示miR-221表达载体抑制p27的3'UTR活性。为了进一步证实miR-221抑制p27的3'UTR的特异性,将含有p27Sen和control-Sen载体转入细胞中,结果表明control-Sen组荧光强度大约是p27Sen组银光强度的2.5倍。证明miR-221是细胞周期抑制剂和肿瘤抑制剂p27基因的有效调控因子。在此癌细胞系中miR-221高表达而p27低表达来维持细胞增殖。普遍认为miR-221在恶性胶质瘤细胞中高表达和p27低表达存在相关性。因此,miR-221可能通过抑制p27的表达促进了肿瘤的生长。
4 展望
通过对miR-221功能的介绍,表明对miR-221的研究现在不止停留在理论假说上,已经可以通过基因超表达和沉默技术来证明microRNA调控途径及其作用的靶基因。目前研究表明,miR-221参与了血细胞生成、血管生成、乳腺的发育与泌乳、肝癌、乳腺癌、甲状腺癌、胰腺癌、恶性胶质瘤等发育过程和疾病发生,其靶基因涉及了GHR、p27、p57、Bmf、HIF-1β、c-kit等。随着对miRNA的不断深入研究,寻找生物体内具有特殊调控功能的miRNA及其调控的靶点非常重要。miRNAs调控细胞的分化是一个复杂的过程,一个miRNAs可调控细胞中与某一种物质代谢或信号转导途径相关的几种mRNA,这样更能有效地发挥作用。也就是说,miRNAs调控基因方式是多对多的,一个mi-RNAs分子可以有多个靶基因,它可以在一个细胞里同时调控多个靶基因来影响该细胞的生长发育,也可以通过对不同细胞中不同的靶基因的调控使得不同的细胞行使不同的功能。与此同时,一个基因的3'非翻译区可能有不止一个miRNAs调控位点,也就是说,一个基因可以同时被多个miRNAs所调控。随着该领域不断深入的研究,miRNA的研究必然走向整体综合的水平。人们将发现越来越多的microRNA,并通过信息学与分子细胞生物学的手段鉴定它们的靶基因,进而分析他们在生理和病理状况下的意义,最后microRNA将会与人工设计的外源性siRNA一起,为疾病治疗提供新型的基因药物,使我们能在基因调控的水平来控制疾病的发生和发展。
[1]Grundhoff A,Sullivan C S,Ganem D,et al.A combined computational and microarray-based approach identifies novel microRNAs encoded by human gamma-herpesviruses[J].RNA,2006,12(5):733-750.
[2]Choi P S,Zakhary L,Choi W Y,et al.Members of the miRNA-200 family regulate olfactory neurogenesis[J].Neuron,2008,57(1):41-55.
[3]Lovis P,Gattesco S,Regazzi R.Regulation of the expression of components of the exocytoticmachinery of insulin-secreting cells by microRNAs[J].Biol Chem,2008,389(3):305-312.
[4]Wang Q,Li Y C,Wang J H,et al.miR-17-92 cluster accelerates adipocyte differentiation by negatively regulating tumor-suppressor Rb2/p130[J].Proc Natl Acad Sci USA,2008,105(8):2889-2894.
[5]Wang Q,Huang Z,Xue H.MicroRNA miR-24 inhibits erythropoiesis by targeting activin type I receptor ALK4[J].Blood,2008,111(2):588-595.
[6]Garzon R,Croce C M.MicroRNAs in normal andmalignant hematopoiesis[J].Curr Opin Hematol,2008,15(4):352-358.
[7]Shi L,Cheng Z,Zhang J,et al.The mechanism of apoptosis in human U87 glioma cells induced by miR-21 antisense oligonucleotide[J].Zhonghua Yi Xue Yi Chuan Xue Za Zhi,2008,25(5):497-501.
[8]Cohen E E,Zhu H,Lingen M W,et al.A feed-forward loop involving protein kinase Calpha and microRNAs regulates tumor cell cycle[J].Cancer Res,2009,69(1):65-74.
[9]Rane S,Sayed D,Abdellatif M,et al.MicroRNA with amacrofunction[J].Cell Cycle,2007,6(15):1850-1855.
[10]Tomari Y,Zamore P D.microRNA biogenesis:drosha can't cut it without a partner[J].Curr Biol,2005,15(2):61-64.
[11]Ji X.The mechanism of RNase III action:how dicer dices[J].Curr Top Microbiol Immunol,2008,320:99-116.
[12]Kusenda B,Mraz M,mayer J,et al.MicroRNA biogenesis,functionality and cancer relevance[J].Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub,2006,150(2):205-215.
[13]Ciafre S A,Galardi S,mangiola A,et al.Extensive modulation of a set of microRNAs in primary glioblastoma[J].Biochem Biophys Res Commun,2005,334(4):1351-1358.
[14]Doench J G,Sharp P A.Specificity of microRNA target selection in translational repression[J].Genes Dev,2004,18(5):504-51.
[15]Lai E C.MicroRNAs are complementary to 3'UTR sequence motifs that mediate negative post-transcriptional regulation[J].Nat Genet,2002,30(4):363-364.
[16]Lai E C,Tam B,Rubin G M.Pervasive regulation of Drosophila notch target gene by GY-box-,Brd-Box-and K-Box-class micro-RNAs[J].Genes Dev,2005,19(9):1067-1080.
[17]Felli N,Fontana L,Pelosi E,et al.MicroRNAs 221 and 222 inhibit normal erythropoiesis and erythroleukemic cell growth via kit receptor down-modulation[J].Proc Natl Acad Sci USA,2005,102(50):18081-18086.
[18]Suárez Y,Fernández-Hernando C,Pober J S,et al.Dicer depend-ent microRNAs regulate gene expression and functions in human endothelial cells[J].Circ Res,2007,100(8):1164-1173.
[19]Poliseno L,Tuccoli A,mariani L,et al.MicroRNAs modulate the angiogenic properties of HUVECs[J].Blood,2006,108(9):3068-3071.
[20]Wang C,Li Q.Identification of differentially expressed microRNAs during the development of Chinese murinemammary gland[J].Journal of Genetics and Genomics,2007,34(11):966-973
[21]陆黎敏,李庆章,王春梅,等.miR-221对小鼠乳腺上皮细胞增殖和泌乳功能的影响[J].中国生物化学与分子生物学报,2009,25(5):454-458.
[22]Fornari F,Gramantieri L,Ferracin M,et al.MiR-221 controls CDKN1C/p57 and CDKN1B/p27 expression in human hepatocellular carcinoma[J].Oncogene,2008,27(43):5651-5661.
[23]Gramantieri L,Fornari F,Ferracin M,et al.MicroRNA-221 targets Bmf in hepatocellular carcinoma and correlates with tumor multifocality[J].Clin Cancer Research,2009,15(16):5073-5081.
[24]Zhao J J,Lin J,Yang H,et al.MicroRNA-221/222 negatively regulates Estrogen Receptor α and is associated with tamoxifen resistance in breast cancer[J].J Biol Chem,2008,283(45):31079-31086.
[25]许践刚,黄关立,颜育祥,等.miR-221/miR-222在乳腺浸润性导管癌中的表达及临床意义[J].温州医学院学报,2010,40(1):27-31
[26]Pallante P,Visone R,Ferracin M,et al.MicroRNA deregulation in human thyroid papillary carcinomas[J].Endocr Relat Cancer,2006,13(2):497-508.
[27]He H,Jazdzewski K,Li W,et al.The role of microRNA genes in papillary thyroid carcinoma[J].Proc Natl Acad Sci USA,2005,102(52):19075-19080.
[28]Lee E J,Gusev Y,Jiang J,et al.Expression profiling identifies microRNA signature in pancreatic cancer[J].Int J Cancer,2007,120(5):1046-1054.
[29]潘国伟.MicroRNA-221/222调控HIF-1β蛋白表现的探讨[D].台湾:台湾大学,2008:1-51
[30]le Sage C,Nagel R,Egan D A,et al.Regulation of the p27Kip1 tumor suppressor by miR-221 and miR-222 promotes cancer cell proliferation[J].EMBO J,2007,26(15):3699-3708.

