协同催化光度法测定环境水样中痕量汞研究
姜洪波
(黑龙江绥化学院化学与制药工程系,黑龙江 绥化 152061)
汞对环境和人体健康的危害已引起世界各国的高度重视[1],研究表明含汞的废水进入水体通过微生物的作用,可转化为比无机汞毒性更大的甲基汞。而含汞的废水和土壤可使汞累积在作物中,再通过食物链进入人体。汞进入人体后,可通过血液流动到全身及各器官组织与蛋白质等生命活性成分结合形成稳定的化合物,造成中枢神经异常,肝及肾脏的损伤,从而破坏人体正常生理活动。汞已作为环境污染指标,成为重点监测的重金属元素之一。痕量汞的测定通常采用分光光度法[2-5],固相萃取光度法[6],所用时间长,准确度差。荧光法[7-8],价格昂贵,难以普及。催化褪色光度法测定痕量汞的报道较少[9],但方法的检出限达到10-10g·mL-1数量级的并不多。本试验研究发现,在酸性介质中,溴酸钾协同过氧化氢氧化偶氮胂Ⅰ褪色,而超痕量汞对该反应又具有进一步的催化作用,据此建立了测定痕量汞的催化光度分析新方法,确定了Hg-KBrO3-H2O2-偶氮胂Ⅰ催化体系的最佳反应条件,方法具有较好的选择性和较高的灵敏度。试验研究了干扰离子的影响,该方法简便快速,仪器简单,本法可用于环境废水中痕量汞的测定,结果满意。
1 材料与方法
1.1 仪器与试剂
756紫外分光光度计(上海第二分析仪器厂);723型分光光度计(上海第三分析仪器厂);超极恒温水浴(余姚市东方电工仪器);汞标准溶液:用优级纯HgCl2按常规方法配制成浓度为1 g·L-1的储备液,使用时逐级稀释成所需工作溶液;偶氮胂Ⅰ溶液:称取0.4021 g偶氮胂Ⅰ(上海试剂总厂第三分厂)于烧杯中加水溶解后转入500mL的容量瓶中,用水稀释至刻度;H2O2溶液:2.00×10-2mol·L-1;KBrO3溶液:1.00×10-2mol·L-1;H2SO4溶液:1.00×10-2mol·L-1。试剂均为分析纯,水为二次蒸馏水。
1.2 方法
于两支25mL比色管中分别加入适量Hg(Ⅱ)标准溶液(其中一只不加)加水稀至10mL,然后分别加入H2SO4溶液1.5mL;KBrO3溶液 1.5mL;H2O2溶液2mL;偶氮胂Ⅰ溶液1.2mL加水稀释至刻度,摇匀后迅速放入700℃恒温水洛中加热反应10 min,取出后用流水冷却至室温,用1 cm比色皿以水为参比,在570nm波长处测定非催化体系的吸光度A0和催化体系的收光度A,计算Ig A0/A=0.086+1.06ρ。
2 结果与分析
2.1 吸收光谱
按试验方法测定不同系列的吸收光谱(见图1),曲线1.2表明偶氮胂Ⅰ与H2SO4及KBrO3无腿色反应,曲线3表明H2O2氧化偶氮胂稍有腿色,曲线4表明H2O2和KBrO3可以协同氧化偶氮胂Ⅰ褪色,曲线5表明汞可加速偶氮胂l褪色,但吸光度明显降低,表明Hg对Hg-KBrO3-H2O2-偶氮胂Ⅰ体系褪色有强烈的催化作用。非催化体系和催化体系的吸收曲线在570nm处均有最大吸收,故本试验选定测量波长为570nm。

图1 配合物的吸收光谱Fig.1 Absorption spectrum of the complex
2.2 体系酸度和缓冲溶液用量的影响
按试验方法,在不同酸性介质中进行显色反应试验,试验了HCl、HNO3、H3PO4、HAC、H2SO4等不同介质对反应体系的影响。结果表明,在HCl介质中反应太快,灵敏度太低且反应条件不易控制;在HNO3、H3PO4、HAC中灵敏度较低且反应体系不稳定;而在H2SO4介质中体系的灵敏度最高,吸光度最大,体系的稳定性较好。选用H2SO4为反应介质,按试验方法改变介质的用量,反应体系在H2SO4的加入量在0.5~2.5mL时,体系的吸光度最大且稳定,故选用H2SO4的用量为1.5mL(见图 2)。

图2 酸度对吸光度的影响Fig.2 Effect of acidity on absorbance
2.3 试剂用量的确定
固定反应温度为900℃,反应时间为8 min,分别改变H2SO4、偶氮胂Ⅰ、KBrO3、H2O2的用量,按试验方法进行试验。结果表明,H2SO4用量在1.00~3.00mL;偶氮胂Ⅰ用量在0.50~1.80mL; KBrO3用量在 1.00~3.10mL;H2O2用量在 2.00~4.00mL。△A值较大且稳定,故试验选用H2SO441.5mL、偶氮胂Ⅰ1.20mL、KBrO31.50mL、H2O22.00mL。
2.4 反应温度和反应时间的影响
在选定的反应条件下,进行反应条件试验,在600℃以下,△A值较小,随温度升高非催化体系和催化两体系反应速度都有所增加,但催化体系反应速度增加较快,△A值增大。700℃以后△A值增加速度在900℃时达最大值,超过900℃△A值有所下降,试验采用在900℃时加热。取出冷却至室温终止反应,按试验方法,测定900℃时不同反应时间的△A和A。试验结果表明,随反应时间的增长△A不断变化,当反应时间在0~16 min范围内时,△A-t呈线性,8 min时达最大值且稳定,结果见图3、4。

图3 温度曲线Fig.3 Temperature curve
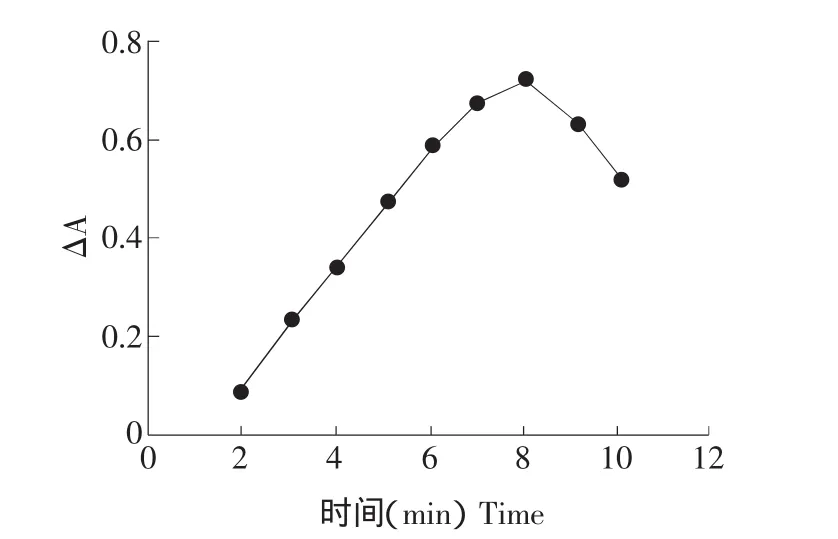
图4 时间曲线Fig.4 Time curve
2.5 标准曲线
在试验条件,分取不同量的汞标准溶液,测定其吸光度,绘制标准曲线,在 0~6.5μg·mL-1,范围内线性良好,其线性回归方程为IgA0/A=0.086+1.06ρ(μg·25mL-1)相关系数 r=0.9997,以 1.0μg 的Hg标准溶液为样品,重复10次试验测定其吸光度,检查该工作曲线的精密度,RSD为2.98%。根据空白试验值的标准偏差S=2.97×10-3(n=10),以及工作曲线的斜率N,按3S/N法计算该方法的捡出限为 7.26×10-10g·mL-1。
2.6 共存离子的影响
按试验方法,在适宜反应条件下对常见共存离子进行干扰实验,当测定的相对误差≤±5%时,其共存离子的允许量(以μg计)Na+、K+、NH4+、Ca2+、Ba2+、Sr2+、Mg2+(300);Cr(Ⅵ)、F-、I-、Cl-、Zn2+(200);Mn2+(150);Ag+、Cd2+(100);Sb3+、Bi2+(30);Cu2+(10);Sn2+(5);SO42-、C2O4-、PO43-、NO3-、NO2-、Ac-、Ar-等离子不干扰测定。1mL 10 g·L-1柠檬酸可掩蔽0.8 mg的Al3+。0.5mL 2 g·L-1EDTA 可掩蔽0.2 mg Cu2+、0.02 mg Cr3+和 1.6 mg Fe3+。对测定中干扰离子较多的样品可以用CCl4萃取和水进行反萃取后按试验方法测定。从上述结果看,大多数离子不干扰测定,方法具有较好的选择性。
2.7 样品分析
样品分析参照文献[10]所示的方法,取电厂废水、药厂废水、生活污水(未经环保处理)各一份,每份50mL,过滤,滤液放入100mL烧杯中进行消化处理,分别加入10mL浓HNO3盖上表面皿,在低温电热板上加热,待溶液的体积蒸至10mL左右时加入10mL 30%的H2O2,继续在低温电热板上加热,蒸至近干,然后加水溶解结晶盐,并转移溶液至25mL容量瓶中,定容。取5mL样液于25mL容量瓶中,调制酸度近中性,按试验方法测定并做回收试验,结果见表1。

表1 样品测定结果及回收实验(n=6)Table1 Determination results and recovery of palladium in samples
依据我国污水排放标准,汞含量不能超过0.05 mg·L-1,而我国饮用水标准规定汞含量不得超过0.001 mg·L-1[10]。所以上述所测水样符合污水排放标准,而不符合生活饮用水标准,本法结果(n=6)与原子吸收分光光度法(AAS)方法对照结果(n=6)之间不存在显著性差异。
3 结论
本文研究了不同酸性介质,反应温度,反应时间及干扰离子对试验的影响。该方法简便快速,仪器简单,方法具有较好的选择性和较高的灵敏度,检出限为7.26×10-10g·mL-1,线性范围为0~6.5μg·mL-1。本法可用于环境废水中痕量汞的含量,结果满意。
[1]姜洪波,张慧云.人类与环境保护[M].哈尔滨:哈尔滨地图出版社,2005.
[2]姜洪波,张慧云,李应辉.汞与溴代氨基苯基荧光酮多元络合物的光度研究及应用[J].现代仪器,2002,8(6):29.
[3]张其颖,潘教麦,李在均.新试剂2,6二甲基苯基重氮氨基偶氮苯测定化妆品中微量汞[J].分析试验室,2004,23(3):19.
[4]徐斌,邹欣平,吴微.安替比林基重氮氨基-2,4-二硝基苯与汞的显色反应及应用[J].分析化学,1995,23(5):579.
[5]杨明华,郑云法,陈爱新,等.新试剂1-(2,6-二溴-4-硝基苯)-3-(4-硝基苯)-三氮稀与汞的显色反应及应用[J].理化检验-化学分册,2002,38(8):415.
[6]胡秋芬,杨光宇,尹家元.对磺酸基苯亚甲基若丹宁固相萃取光度法测定水中的汞[J].分析试验室,2002,21(4):93.
[7]侯明,李海云,殷辉安.汞(Ⅱ)-吖啶橙-十二烷基磺酸钠荧光体系的研究及应用[J].分析试验室,2005,24(8):14.
[8]罗兆福,左超,潘祖亭,等.荧光光谱法测定工业废水中痕量汞的研究[J].分析试验室,2000,19(2):187.
[9]黄泱,林艳琳.催化褪色光度法测定痕量汞[J].漳州师范学院学报:自然科学版,2003(4):77-80.
[10]魏复盛.水和废水监测方法[M].北京:中国环境科学出版社,1998.

