一种新型迟发性Ⅰ型糖尿病大鼠动物模型的建立
杨 牧
(华中师范大学生命科学学院, 湖北 武汉 430071)
0 前 言
糖尿病是一类由多种病因引起的代谢类疾病.该病以高血糖为主要特征,并伴随多饮、多尿、多食以及消瘦等症状.糖尿病发展下去,持续的高血糖会损害心脏、血管、眼睛、肾脏和神经等组织和器官,引起一系列并发症最终导致死亡.因此,建立稳定可靠的糖尿病动物模型成为该疾病研究的前提[1].化学性糖尿病动物模型诱发简便、来源广,是目前应用较广泛的模型[2].但传统沿用的胰岛素依赖型糖尿病(IDDM)大鼠模型均为一次性大剂量注射化学药物(链脲佐菌素(STZ) 或四氧嘧啶(Alloxsen)),在短时间内引起β细胞大量损害而诱发糖尿病[3].目前,国内外大多采用腹腔一次性注射60 mg·kg-1STZ,诱导IDDM大鼠模型.国外研究中有应用小剂量多次注射STZ,诱导IDDM小鼠模型,对大鼠尚无系统性研究[4,5].
当患者的空腹血糖大于7.2 mmol/L,餐后2 h内血糖大于11.1 mmol/L,我们即定义为糖尿病患者.大部分糖尿病患者的空腹血糖都在8.8~11.1 mmol/L之间,只有少数严重患者的空腹血糖在11~18 mmol/L之间.传统高剂量STZ诱导方法,因STZ毒副作用强,给药剂量大,具有较高的死亡率和成本.更为重要的是一次性的大量破坏胰腺β细胞,使模型动物在短期内达到过高的空腹血糖水平,用该方法所建立的动物模型无法较为准确地模拟糖尿病患者的真实血糖情况,不能更好地用于糖尿病发生、发展以及发病机制的研究.本研究通过改良传统的注射剂量和注射方式,首次采用大鼠尾静脉15 mg·kg-1和10 mg·kg-1的两次注射方式,极大程度地降低了STZ的用量,减少了造模成本并提高了造模成功率,且小剂量两次注射所诱导的大鼠糖尿病模型血糖上升缓慢,能够更为准确地模拟糖尿病患者的真实血糖状况,较好地反映出糖尿病发生、发展的过程,为糖尿病治疗药物的研究以及预防提供了更为经济且适合的动物模型.
1 材料与方法
1.1 实验材料
主要试剂:链脲佐菌素,Sigma公司产品,批号1000543148;大鼠血清胰岛素ELISA试剂盒,美国ADL公司产品;大鼠糖化血红蛋白A1c(GHbA1c)酶联免疫试剂盒,美国UCL公司产品;其他化学试剂为分析纯,国药集团化学试剂有限公司产品.
动物:健康成年SD大鼠,雄性,普通级,体重为150~200 g,购买于上海斯莱克实验动物有限责任公司,动物质量合格证号SCXK(沪)2007-0005.
1.2 实验方法
1.2.1 STZ注射液的配制
首先配制0.1 mol/L柠檬酸缓冲液(pH 4.4).配制方法:柠檬酸2.1 g,柠檬酸钠2.94 g,分别用生理盐水定容至100 mL,使其各自的浓度均为0.1 mol/L,取上述柠檬酸溶液28 mL,柠檬酸钠溶液22 mL,充分混匀,4 ℃冰箱保存备用.用0.1 mol/L的柠檬酸缓冲液将STZ配成浓度为120 mg·mL-1的STZ注射液(现用现配),避光保存置于冰上,且尽可能快地给大鼠注射,否则STZ在数分钟之内即失效.
1.2.2 实验动物分组和模型建立
将SD大鼠随机分成对照组(30只)、剂量A组(30只)、剂量B组(30只)和剂量C组(30只),将SD大鼠正常饲喂2周后其体重达到180~200 g即开始试验.试验开始前,需将SD大鼠禁食不禁水12 h.剂量A组按照35 mg·kg-1剂量,一次性尾静脉注射120 mg·mL-1的STZ注射液;剂量B组首次按15 mg·kg-1剂量,尾静脉注射120 mg·mL-1的STZ注射液,间隔3 d按10 mg·kg-1剂量,尾静脉第二次注射120 mg·mL-1的STZ注射液;剂量C组按照60 mg·kg-1剂量,一次性腹腔注射120 mg·mL-1的STZ注射液;对照组只注射柠檬酸-柠檬酸钠(pH 4.4)缓冲液.
1.2.3 糖尿病模型生化和体征指标检测
STZ注射后,每隔3 d检测一次空腹血糖,4周后检测糖基化血红蛋白水平.选取注射4周后空腹血糖浓度>16. 65 mmol/L,且糖基化血红蛋白水平>6.2%的模型大鼠,将其判定为Ⅰ型糖尿病动物模型.尾静脉采血,利用葡萄糖氧化酶法测定血糖,其余血样一部分加入抗凝剂检测糖基化血红蛋白水平,另一部分离心分离血清检测血清中胰岛素水平.在实验期间对所有实验组的体重变化、日采食量、饮水量进行检测.
1.2.4 统计分析
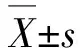
2 结果

表1 不同剂量组的造模成功率
2.1 糖尿病动物模型的建立
以注射4周后空腹血糖>16. 65 mmol/L,且糖基化血红蛋白水平>6.2%为判断标准,计算成模率.剂量A组注射4周后成模29只,4周内死亡1只,成模率为93%(28/30).剂量B组注射4周后成模29只,4周内无死亡,成模率为96%(29/30).剂量C组注射4周后成模25只,3只注射后死亡,4周内死亡2只,成模率为83%(25/30),如表1所示.
2.2 空腹血糖、糖基化血红蛋白、血清胰岛素检测结果
大鼠空腹血糖结果表明,对照组实验前后,血糖(4.5±0.47 mmol/L)无明显差异.剂量A组、剂量B组与剂量C组在达到血糖最高水平时无明显差异.剂量A组在注射一周后一直维持较高水平的空腹血糖(24.5±2.42 mmol/L),较对照组空腹血糖(4.1±0.40 mmol/L)差异极显著(P<0.01);剂量B组在注射一次后,空腹血糖(8.1±0.65 mmol/L)与对照组(4.4±0.26 mmol/L)比较差异显著(P<0.05),二次注射后空腹血糖逐渐上升,第4周后升至最高(22.3±1.39 mmol/L);剂量C组注射后血糖即开始升高,注射后第3天后达到24.4±1.92 mmol/L.剂量A组、剂量B组与剂量C组在升至血糖最高值后并无明显差异.B组成模后的血清胰岛素水平(15.21±1.04 U/mL)较A组(10.32±0.62 U/mL)和C组(10.07±0.83 U/mL)差异显著(P<0.05);B组糖基化血红蛋白水平(12.3±0.95%)较A组(16.7±0.97%)和C组(17.3±1.12%)差异显著(P<0.05).不同剂量组空腹血糖检测结果如表2所示.剂量A组、剂量B组与剂量C组成模大鼠4周后的糖基化血红蛋白水平和血清胰岛素水平检测结果如表3所示.
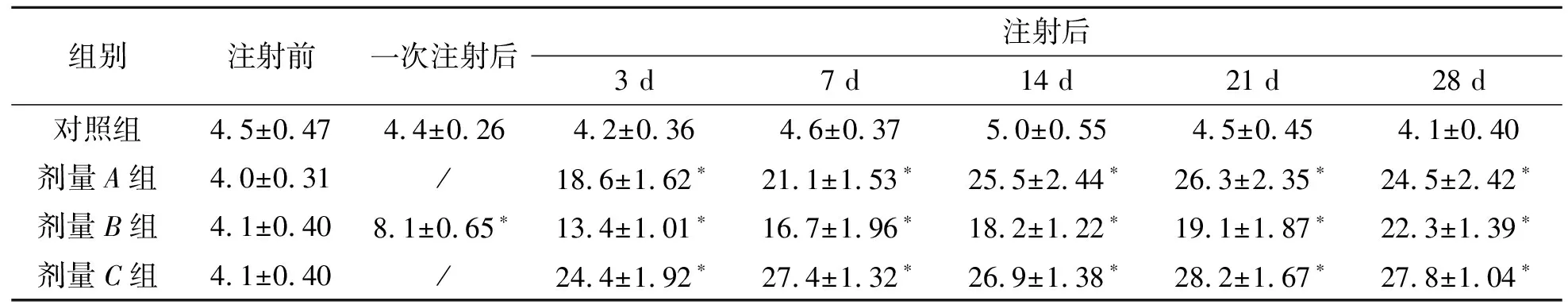
表2 不同剂量组空腹血糖测定结果 单位:mmol/L
注:“*”P<0.01.
2.3 大鼠体重变化
表3剂量A组、剂量B组及剂量C组成模大鼠糖基化血红蛋白水平和血清胰岛素水平

组别糖基化血红蛋白/%血清胰岛素/(U/mL)对照组4.4±0.2621.44±1.23剂量A组16.7±0.97∗∗10.32±0.62∗∗剂量B组12.3±0.95∗15.21±1.04∗剂量C组17.3±1.12∗∗10.07±0.83∗∗
注:“*”P<0.05,“**”P<0.01.
检测了不同剂量组注射后大鼠的体重变化,发现不同剂量组在注射后7 d体重变化与对照组相比没有明显差异,剂量A组注射14 d后,体重(174.2±3.18 g)较对照组体重(201.1±9.53 g)下降明显(P<0.01),剂量B组在注射21 d后体重(170.3±6.66 g)较对照组体重(201.2±9.04 g)下降明显(P<0.01),剂量C组在注射7 d后,体重(170.1±2.64 g)较对照组体重(194.7±8.76 g)下降明显(P<0.01),结果见表4.
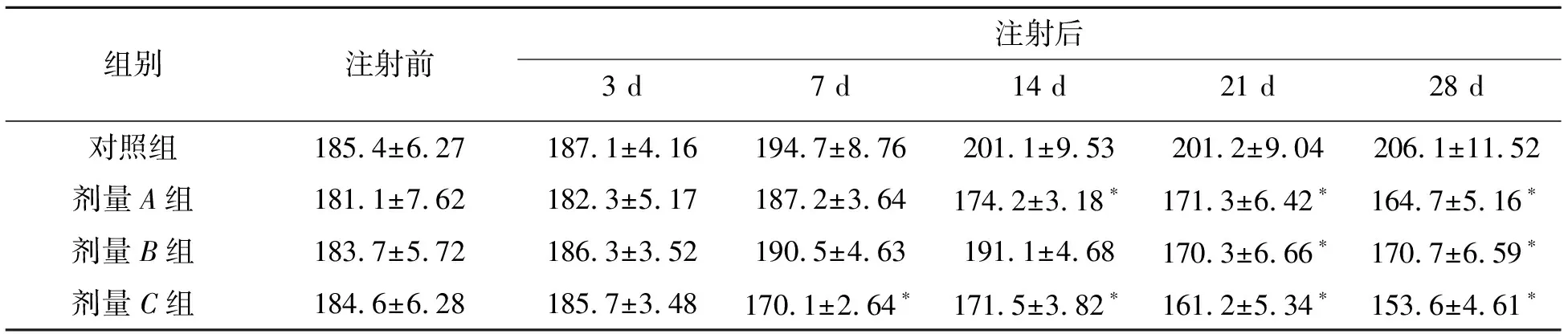
表4 不同剂量组成模大鼠体重变化 单位:g
注: “*”P<0.01.
2.4 大鼠进食量、饮水量变化
分别检测了造模成功大鼠第3 d、7 d、14 d、21 d、28 d的日进食量与饮水量.剂量A组注射后3 d的进食量(8.9±1.10 g)与对照组(4.8±0.44 g)相比较差异显著(P<0.05);C组注射后3 d的进食量(11.9±0.85 g)与对照组(4.8±0.44 g)相比较差异极显著(P<0.01);剂量B组注射7 d后的日进食量(9.3±1.13 g)与对照组(5.1±1.15 g)相比较差异显著(P<0.05),如表5所示.与日进食量不同的是3种剂量组在注射后的第3天,A组(157.3±8.43 mL)、C组(177.5±10.28 mL)的日饮水量与对照组(54.7±3.74 mL)相比较差异极显著(P<0.01),B组的日进水量(113.4±7.42 mL)与对照组(54.7±3.74 mL)相比较差异显著(P<0.05),如表6所示.
表5 不同剂量组成模大鼠日进食量 单位:g
注:“*”P<0.05, “**”P<0.01.

表6 不同剂量组成模大鼠日饮水量 单位:mL
注:“*”P<0.05, “**”P<0.01.
3 讨论
目前STZ诱导IDDM模型已经成为一种常用的方法,国内大多采用腹腔一次性注射60 mg·kg-1STZ,数天后可产生高血糖[6-12].据沈亚非[6]等报道,60 mg·kg-1STZ单次尾静脉注射与60 mg·kg-1STZ单次腹腔注射,空腹血糖值有显著差异(P<0.01).据谢明智等[13]报道,小剂量25~30 mg·kg-1STZ尾静脉注射可造成大鼠模型胰腺β细胞轻度损伤,造成糖耐量异常,空腹血糖有显著差异(P<0.01).
采用传统的腹腔一次性注射60 mg·kg-1STZ的造模方法注射量较大,死亡率较高,且短期内诱导动物产生20 mmol/L以上的空腹血糖水平.糖尿病患者的空腹血糖水平一般都在8.8~11.1 mmol/L之间,只有少数严重患者空腹血糖能够达到11 ~18 mmol/L之间,因此此种造模方式无法较为准确的模拟糖尿病患者的真实空腹血糖情况.尾静脉一次性注射35 mg·kg-1组与传统方法相比,虽然STZ用量减少了一半,模型死亡率也大大降低,但仍存在成模后空腹血糖水平过高的情况.本研究所采用的尾静脉低剂量(15 mg·kg-1和10 mg·kg-1)少量两次注射方式,在克服了传统方法的成模率低和成本高的前提下,较小程度的破坏胰腺β细胞,并且相对较低的糖基化血红蛋白水平反映出低剂量组在一段时间内血糖上升的缓慢程度,诱导大鼠平缓的出现糖尿病典型的“三多一少”临床特征,产生迟发性的糖耐量异常.
糖尿病临床症状多样、病因复杂,因此选择一种合适的动物模型对于研究本身意义重大.尤其是广泛应用于药理学、药效学研究的SD大鼠的Ⅰ型糖尿病模型,对于糖尿病新药物的研制更为关键.采用尾静脉小剂量多次给药,在严格控制大鼠体重和健康的情况下,能够提高造模的成功率,大幅地降低STZ用量,减少研究成本.更为重要的是利用小剂量多次尾静脉注射,能够诱导大鼠产生迟发性的糖耐量异常,并能够较准确的模拟糖尿病患者的真实空腹血糖,反映糖尿病从发生、发展到临床症状期的特征,这也正是传统的造模方法所无法比拟的优势所在,这种方法为糖尿病预防、治疗和发病机制的研究提供了更为适合、简便且经济的动物实验平台.
参考文献
[1] 吴清洪,顾为望, 袁 进.链脲佐菌素诱导建立Ⅰ型糖尿病大鼠模型[J].动物医学进展,2006,27(8):116-117.
[2] 张浩军,赵静波,李 平. 糖尿病肾病动物模型研究进展[J].中国药理学通报,2008,24(7):845-848.
[3] 刘 霆, 张桂珍, 卜丽莎,等. STZ小剂量多次注射诱导大鼠胰岛素依赖性糖尿病动物模型探讨[J] . 白求恩医科大学学报,2001,27(6): 578-580.
[4] Bloch TN , VezysV. Diabetes induced with low-doses of streptozotocin is mediated by V β8.2+ T-cells[J]. Diabetes,1995,44:354-359.
[5] Herold KC, VezysV , Sun Q ,etal. Regulation of cytokine production during development of auto immune diabetes[J]. J Immunol,1996,156(9):3 521-3 527.
[6] 沈亚非,徐焱成. 链脲佐菌素诱导实验性糖尿病大鼠模型建立的研究[J].实用诊断与治疗杂志,2005,19(2):79.
[7] 梁海荣,唐焕文,罗 皓,等. 链脲佐菌素诱导糖尿病大鼠肾病模型的建立[J]. 应用预防医学,2006,12(3):57-59.
[8] 杨润军, 李青旺, 赵 蕊. 四氧嘧啶与链尿佐菌素诱导小鼠糖尿病模型的效果比较[J].西北农林科技大学学报,2006,34(2):66-68.
[9] 刘学政, 萧 鸿. 链脲佐菌素致大鼠糖尿病模型的研究[J]. 锦州医学院学报,2001,22(4):35-38.
[10] 王 芳, 朱大菊, 孙明谨, 等. 链脲菌素在糖尿病鼠模型中的应用及其作用机理[J]. 郧阳医学院学报,2004,23(1):15.
[11] 黄 波, 刘学政, 庞东渤. 不同途径注射链脲佐菌素致大鼠糖尿病模型的研究[J]. 锦州医学院学报,2003,24(1):59-62.
[12] 张 静, 吴靖芳, 郑慧娥, 等. 链脲佐菌素致大鼠糖尿病模型的实验研究[J].河北北方学院学报 (医学版),2006,123(14):77-80.
[13] 谢明智, 刘海帆, 张凌云, 等. 实验性肥胖及糖尿病大鼠模型[J]. 药学学报,1985,20 (11):801-805.

