5-FU和放射线联合应用对人子宫颈腺癌HeLa细胞凋亡的影响
杨滨,蔡敏,阎华,邹华伟,杨帆,刘渊
(1.中国医科大学 附属盛京医院妇产科,沈阳 110004;2.辽宁省计划生育科学研究院 附属医院,沈阳 110031)
5-FU和放射线联合应用对人子宫颈腺癌HeLa细胞凋亡的影响
杨滨1,蔡敏1,阎华2,邹华伟1,杨帆1,刘渊1
(1.中国医科大学 附属盛京医院妇产科,沈阳 110004;2.辽宁省计划生育科学研究院 附属医院,沈阳 110031)
目的 研究5-氟尿嘧啶(5-FU)和放射线联合应用对人子宫颈腺癌HeLa细胞凋亡的影响。方法 将人子宫颈腺癌HeLa细胞分为单纯5-FU化疗组、单纯放射线组、放化疗联合组(5-FU和放射线联合应用组)及空白对照组4组。应用MTT法筛选5-FU作用于人子宫颈腺癌HeLa细胞的药物浓度(48h IC50);经AnnexinⅤ-FITC/PI双标记流式细胞技术(FCM)进行细胞凋亡分析;用荧光显微镜观察各组细胞经作用后凋亡的形态学变化。结果 单纯化疗、单纯放疗及放化疗联合都可诱导HeLa细胞凋亡,放化疗联合组与单纯化疗和单纯放疗组比较可明显增加HeLa细胞凋亡率(P<0.05)。结论 5-FU和放射线联合应用可明显增加人子宫颈腺癌HeLa细胞的凋亡,为临床应用提供理论依据。
5-氟尿嘧啶;放射线;HeLa细胞;凋亡
子宫颈癌是妇科常见的恶性肿瘤之一,虽然其总体发病率及死亡率呈下降趋势,但子宫颈腺癌的发病率近年来明显增加,世界范围内的检出率已达10%~22%[1]。宫颈癌传统治疗主要以手术和放疗为主[2],可使部分患者得到根治或缓解,但子宫颈腺癌单纯手术或放疗后仍易短期内复发或转移,且对化疗又不敏感,故预后不良。近年来有报道[3~5]新辅助化疗(即术前或放疗前的化疗)和同步放化疗等一些新的治疗手段,可减少病灶的体积,消除亚临床转移,提高手术或放疗的效果,化疗与放疗的联合已成为肿瘤治疗方面的研究重点。5-氟尿嘧啶(5-fluorouracil,5-FU)作为一种抗代谢类抗肿瘤药物,已被广泛应用于多种恶性肿瘤的治疗,也是子宫颈癌新辅助化疗的常用药物之一,并且还有一定的放射增敏效果[6]。另外,5-FU还是新型口服型氟尿前体类药物卡培他滨(capecitabine,CAP)在体内选择性发挥抗肿瘤作用的活性成份[7]。因此本文通过检测细胞凋亡探讨了5-FU和放射线(radiotherapy,RT)联合在人子宫颈腺癌HeLa细胞株中的应用效果,以期为应用卡培他滨与放疗联合治疗子宫颈腺癌提供依据。
1 材料与方法
1.1 细胞株和试剂
人子宫颈腺癌HeLa细胞株由盛京医院中心实验室提供;RPMI1640培养基为海克隆生物制品有限公司产品;胎牛血清为天津市灏洋生物制品科技责任有限公司产品;四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)为北京夏斯生物技术有限公司产品;异硫氰酸荧光素(FITC)标记的Ca2+依赖性磷脂结合蛋白Ⅴ(AnnexinⅤ)和碘化丙锭为北京博奥森生物技术有限公司产品;5-FU为上海旭东海普药业公司产品。
1.2 主要设备和仪器
垂直单向流洁净工作台(青岛海尔特种电冰柜有限公司,型号 HRLD-ZD);解剖显微镜(Olympus);倒置显微镜(Olympus);CO2培养箱(GASINCUBATORTE-HERWATEER-JACKETHIRASAWA);冰箱(Haier);低温离心机;高压灭菌器(LDZX-40BⅠ型上海申安医疗器械厂);电热恒温鼓风干燥箱(101-3-BS-Ⅱ型上海跃进医疗器械厂);自动酶标读数仪(Tanon Gis-1000Labsystems Dragon Wellscan MK3);流式细胞仪(FACSCalibur美国BD公司);荧光显微镜(Olympus);X线瓦里安直线加速器2300C/DSN(293美国CLINA)。
1.3 方法
1.3.1 HeLa细胞的培养:HeLa细胞株单层贴壁培养于含 10%胎牛血清、100U/ml青霉素、100μg/ml链霉素的RPMI1640培养液中,37℃、饱和湿度、5%CO2的培养箱中培养。每周传代2次,实验时用对数生长期细胞。
1.3.2 MTT法检测5-FU处理HeLa细胞48h的50%抑制浓度(inhibitory concentration 50,IC50):收集对数生长期细胞,调整细胞悬液浓度,分于96孔板,每孔 200μl,5000~10000个细胞/孔。置 37℃、5%CO2培养箱培养24h使细胞贴壁。更换新鲜培养液后加入5-FU处理细胞,终浓度分别为250,125,62.5,31.3,15.6,7.8,3.9,2.0,1.0和 0.5μg/ml,每个剂量设6个重复孔,同时设空白对照组(未加药物),继续培养 48h。每孔加入 20μl MTT溶液(5mg/ml),继续培养4h。然后吸掉上清,每孔加入150μl二甲基亚砜,置摇床上低速振荡10min,使结晶物充分溶解。在酶联免疫检测仪490nm处测量各孔的吸光度值。增殖抑制率(%)=(对照组OD值-加药组OD值)/对照组OD值×100,作出增殖抑制率曲线,以此找到5-FU处理HeLa细胞48h的IC50。
1.3.3 流式细胞术检测HeLa细胞凋亡:取对数生长期HeLa细胞,按1×106/ml将单细胞悬液2ml接种至6孔细胞培养板中,培养24h。将细胞随机分为空白对照组、单纯5-FU组、单纯放射线组及5-FU+放射线联合组4组。更换新鲜培养液,空白对照组不进行任何处理;单纯5-FU组分别加入根据MTT法所选出的大于及等于IC50的2种浓度的5-FU。单纯放射组放射线的照射取2Gy、6Gy 2个剂量;5-FU+放射线联合组先进行放射线的照射,后根据分组情况分别加入大于或等于IC50浓度的5-FU。每组均设3个重复孔,继续培养24,48h后,离心收获细胞。以磷酸盐缓冲液(PBS)洗涤后,采用异硫氰酸荧光素(FITC)标记的annexinⅤ和碘化丙锭染色,置于流式细胞仪上进行细胞凋亡检测。
1.3.4 荧光显微镜观察凋亡细胞形态:取对数生长期子宫颈腺癌HeLa细胞,制成浓度为2.5×105/ml的细胞悬液,将细胞悬液按2ml/孔加至放有盖玻片的6孔板内,使每孔内细胞数为5×105个。将细胞于盖玻片上生长24h后更换新鲜培养液,与前述方法相同分组,每组均设3个重复孔,各组应用与前述同等浓度及剂量的5-FU、放射线及5-FU+放射线联合诱导细胞凋亡。继续培养24及48h后,用PBS洗涤2次。在 500μl的 Binding buffer中加入 10μl annexinⅤ-FITC、5μl Propidium Iodide混匀。将上述溶液滴加于盖玻片表面,使长有细胞的盖玻片表面均匀覆盖。避光、室温反应5min。将盖玻片倒置于载玻片上,于荧光显微镜下观察。annexinⅤ-FITC荧光信号呈绿色,碘化丙锭荧光信号呈红色。1.4 统计学分析
数据使用SPSS13.0进行处理,组内比较采用配对t检验,组间比较采用单因素方差分析。P<0.05表示有统计学意义。
2 结果
2.1 MTT法检测5-FU48h IC50
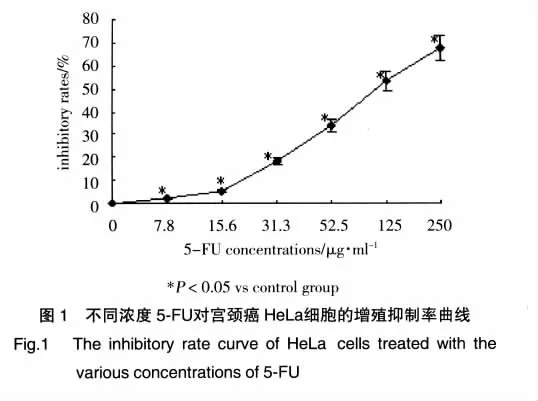
不同浓度5-FU处理HeLa细胞48h的增殖抑制率曲线见图1,可见细胞增殖抑制率随药物浓度增加而增加。当浓度为250μg/ml和125μg/ml时,细胞抑制率≥50%,与空白组比较P<0.05,即5-FU处理HeLa细胞48h的 IC50为125μg/ml。故确定125μg/ml和 250μg/ml作为单纯化疗组的投药浓度。
2.2 流式细胞术检测HeLa细胞凋亡的变化
表1显示各组HeLa细胞凋亡率随时间变化的情况。可见作用24h时,放化疗联合组均比其相应剂量的单纯放疗或单纯化疗组凋亡细胞率高(P<0.01);125μg/ml 5-FU+6Gy 放射的联合组所诱导的凋亡细胞最多;联合组中125μg/ml浓度的5-FU与2Gy或6Gy放射联合投予,均比浓度为250μg/ml 5-FU与2Gy或6Gy放射联合投予时所诱导的凋亡细胞多(P<0.05)。作用48h时,放化疗联合组凋亡细胞率均低于其相应剂量的单纯化疗组但高于其相应剂量的单纯放疗组(P<0.01)。
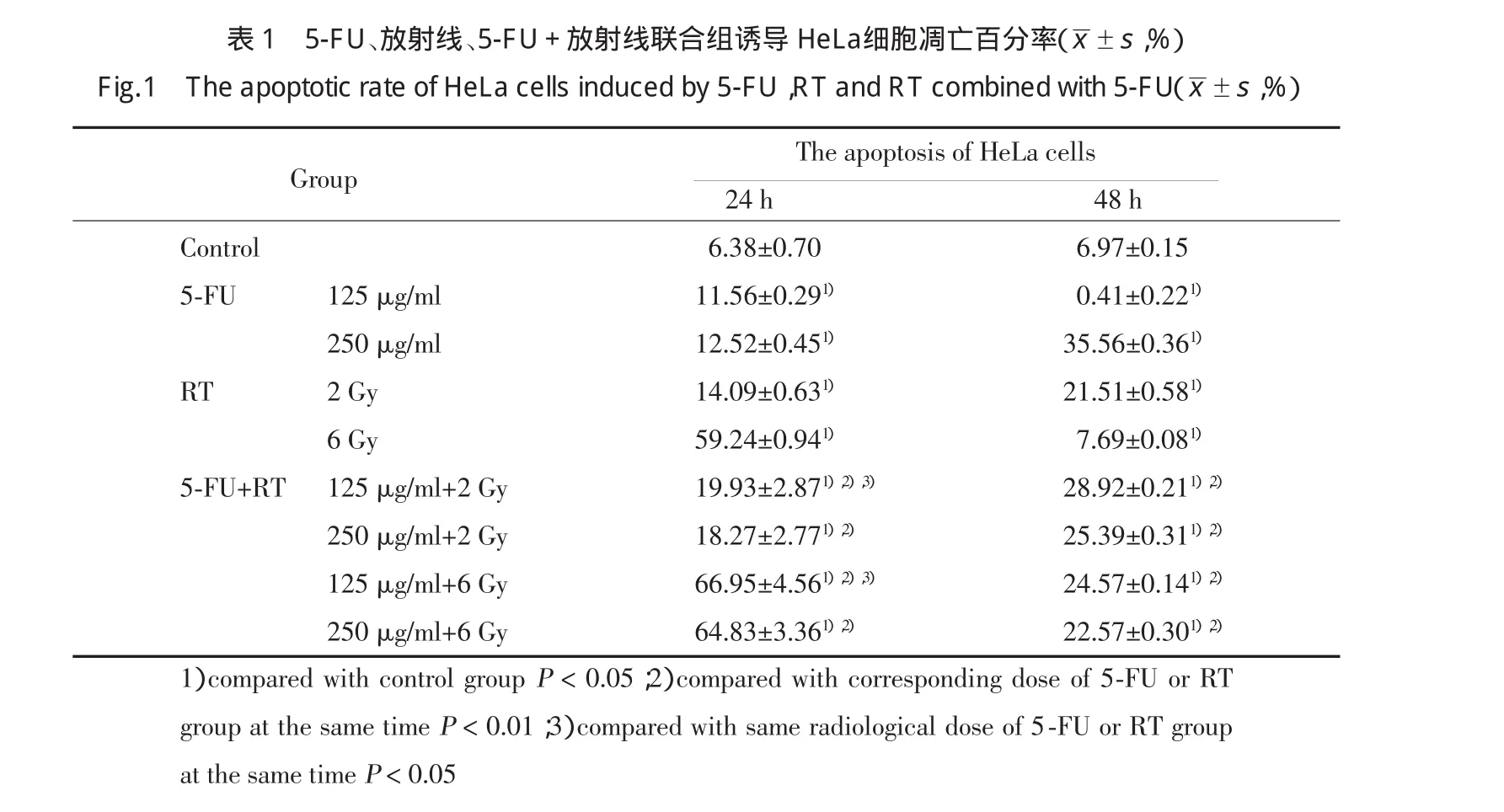
表15-FU、放射线、5-FU+放射线联合组诱导He La细胞凋亡百分率(±s,%)Fi g.1Th e a p o p t o t i c r a t e o f He La c e l l s i n d u c e d b y 5-FU,RTa n d RTc o mb i n e d w i t h 5-FU(±s,%)The apoptosis of HeLa cells 24h 48h Control 6.38±0.70 6.97±0.155-FU 125μg/ml 11.56±0.291) 0.41±0.221)250μg/ml 12.52±0.451) 35.56±0.361)RT 2Gy 14.09±0.631) 21.51±0.581)6Gy 59.24±0.941) 7.69±0.081)5-FU+RT 125μg/ml+2Gy 19.93±2.871),2),3) 28.92±0.211),2)250μg/ml+2Gy 18.27±2.771),2) 25.39±0.311),2)125μg/ml+6Gy 66.95±4.561),2),3) 24.57±0.141),2)250μg/ml+6Gy 64.83±3.361),2) 22.57±0.301),2)Group 1)compared with control groupP<0.05;2)compared with corresponding dose of 5-FUor RTgroup at the same timeP<0.01;3)compared with same radiological dose of 5-FUor RTgroup at the same timeP<0.05
2.3 荧光显微镜观察凋亡细胞形态
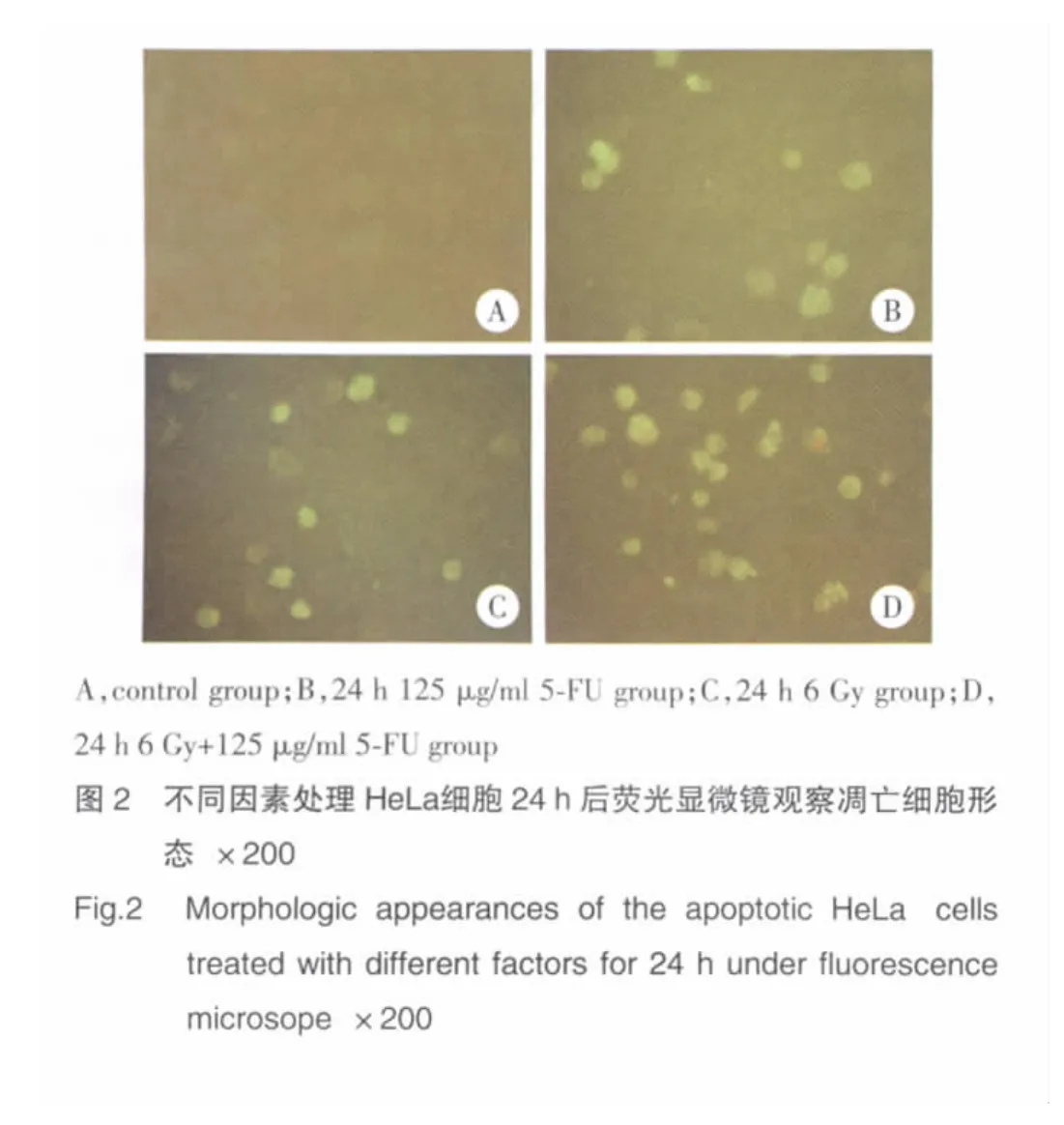
凋亡细胞对碘化丙锭染料有抗染性,坏死细胞则不能。因此,在细胞凋亡的早期细胞呈现绿色荧光信号(图2B、2C),而死亡细胞可被碘化丙锭着染产生红色荧光(图2D),正常活细胞的荧光很弱仅能看到轮廓(图2A)。图2B、2C、2D中均可见到典型的细胞凋亡改变,细胞核缩小,染色质凝集,细胞表面形成突起,部分突起与细胞脱离,形成凋亡小体。
3 讨论
多基因突变的细胞失控性生长、细胞增殖失控和凋亡受阻是恶性肿瘤发生、发展的主要原因[8]。有效诱导肿瘤细胞凋亡是肿瘤治疗的新方法之一,放射可诱导肿瘤细胞发生凋亡,并加速细胞凋亡过程而使更多的肿瘤细胞死亡,从而使肿瘤发生消退[9]。放疗和化疗均可诱发细胞凋亡[10]。从本研究结果中可以看出单纯5-FU,单纯放疗及5-FU和放疗联合都可诱导人子宫颈腺癌HeLa细胞凋亡,但联合治疗的效果明显高于单纯放疗或者单纯5-FU,说明两者联合后有协同作用产生,能诱导更多的HeLa 细胞发生凋亡,这与文献报道[6,11]在其他肿瘤细胞中的作用一致。其单纯化疗组随药物浓度增加凋亡细胞产生增多且有一定的时间依赖性;单纯放疗组放疗后24h,随着剂量增加产生的凋亡细胞逐渐增多,但放疗后48h,随着剂量的增加凋亡细胞的产生反而出现减少,这可能与继发性坏死细胞和细胞碎片增多有关。放化疗联合组中,两种不同浓度5-FU与放射剂量6Gy的联合效果均明显好于和放射剂量2Gy联合的效果;其中5-FU浓度为125μg/ml与放射剂量6Gy的联合效果比5-FU浓度为250μg/ml与6Gy放疗的联合效果还好,诱导产生的早期凋亡细胞最多。由此可以看出并不是随着药物浓度、放射剂量及作用时间的增加就能诱导产生更多的凋亡细胞,这可能与细胞在凋亡过程中转化成了死亡细胞或者是大剂量直接导致了细胞死亡有关。提示联合应用的5-FU剂量过大可能直接导致HeLa细胞死亡,对正常细胞也可有严重损伤,在临床应用过程中5-FU和放疗联合的效果可能会受5-FU剂量的限制。因此选择合适剂量的5-FU来与放疗联合既要获得良好治疗效果又要避免产生较大的副作用非常重要。寻找适当的放射剂量和5-FU药物浓度进行放化疗联合是进一步临床治疗的研究课题。
5-FU结构与尿嘧啶和胸腺嘧啶相似,它通过干扰肿瘤细胞DNA的合成发挥细胞毒性作用,抗癌谱广,可用于治疗各种肿瘤,已广泛应用于临床,放疗是治疗子宫颈癌的重要手段之一,近年来,国内外报道认为放射与细胞凋亡存在密切关系,细胞凋亡是放射治疗引起细胞死亡的主要类型之一[4]。细胞凋亡也称程序性细胞死亡(programmed cell death),是细胞正常死亡的一种途径。细胞凋亡后在形态学可以观察到细胞固缩,胞质浓缩,空泡状,核致密深染呈多叶状或新月状,颗粒常聚集在核周边,破裂的染色质形成圆形或椭圆形大小不等的细胞凋亡小体(apoptotic bodies),位于细胞质内或逐渐向细胞外散落。在本研究中,荧光显微镜下观察到较典型的HeLa细胞凋亡改变。
CAP是一种新型的5-FU前体药物,并且是目前口服制剂中唯一疗效能超过静脉给药的氟尿嘧啶类药物。CAP口服后经小肠吸收入肝脏后,经过三步特殊的代谢过程,最后在肿瘤细胞内通过胸苷磷酸化酶(thymidine phosphorylse,TP)转化成 5-FU发挥抗肿瘤活性,本身无毒性,对肿瘤细胞选择性高,特异性强,周身副作用小[7]。本研究前期实验[13]通过建立裸鼠模型证明CAP对子宫颈腺癌有抑制作用,其与放疗联合显示出了比单纯CAP化疗和单纯放疗都好的抑制效果。另报道[14]X线放射能提高子宫颈腺癌HeLa细胞TP酶的表达,二氢嘧啶脱氢酶(dihydropyrimidine dehydrogenase,DPD,5-FU代 谢失活的限速酶)表达不受影响,TP/DPD比值升高,因而能提高CAP对子宫颈腺癌HeLa细胞的抗肿瘤活性。本研究结果也显示5-FU和放射联合能诱导更多的HeLa细胞发生凋亡。因此提示临床放射治疗子宫颈腺癌时,同时投给CAP,可能获得比5-FU和放疗联合更佳的治疗效果,而且更能减少5-FU的毒副作用,是一种值得期待的子宫颈腺癌联合治疗方法。
[1]Sherman ME,Wang SS,Carreon J,et al.Mortality trends for cervical squamous and adenocarcinoma in the United States.Relation to incidence and survival[J].Cancer,2005,103(6):1258-1264.
[2]朗景和,丁晓曼.当前妇科肿瘤临床诊治的特点和问题[J].癌症进展杂志,2006,1,4(1):2-6.
[3]Lopez-Graniel C,Reyes M,Chanona G,et al.Type Ⅲ radical hysterectomy after inductionchemotherapy for patients with locally advanced cervical carcinoma[J].Gynecol Cancer,2001,11(3):210-217.
[4]Aoki Y,Tomita M,Sato T,et a1.Neoadjuvant chemotherapy for patients younger than 50years with high-risk squamous cell carcinoma of the ce rvix[J].Gynecol Oncol,2001,83(2):263-267.
[5]Roberts KB,Urdaneta N,Vera R,et al.Interim results of a randomized trial of mitomycinCas an adjunct to radical radiotherapy in the treatment of locally advanced squamous-cellcarcinoma of the cervix[J].Int JCancer,2000,90(4):206-223.
[6]Thomas G,Dembo A,Ackerman I,et al.Arandomized trial of standard versus partially h-yperfractionated radiation with or without concurrent 5-fluorouracil in locally advanced cer-vical cancer[J].Gynecol Oncol,1998,69(2):137-145.
[7]Miwa M,Ura M,Nishida M,et al.Design of a novel oral flouropyrimidin carbamate,capecitabine,which generates 5-fluorouracil selectively in tumors by enzymes concentrated in human liver and cancer tissue[J].Cancer,1998,34(8):1274-1281.
[8]Waggoner SE.Cervical cancer[J].Lancet,2003,361(9376):2217-2225.
[9]潘才住,潘建基,陈传本.放射诱导鼻咽癌细胞凋亡的研究现状[J].中华肿瘤防治杂志,2007,1(14):61-70.
[10]Balcer-Kubiczek EK,Attarpour M,Jiang J,et al.Cytotoxicity of docetaxel(Taxotere)used as a single agent and in combination with radiation in human gastric,cervical and pancreatic ca-ncer cells[J].Chemotherapy,2006,52(5):231-240.
[11]孙宝刚.5-FU在大剂量放疗中诱导人胰腺癌细胞株细胞凋亡的实验研究[J].中国冶金工业医学杂志,2006,23(2),127-129.
[12]Pervan M,Pajonk F,Sun JR,et al.Molecular pathways that modify tumor radiation respon-se[J].Am JClin Oncol,2001,24(5):481-485.
[13]杨滨,阎华,王欣彦,等.卡培他滨与放射联合对子宫颈腺癌抗肿瘤效果的实验研究[J].中国医科大学学报,2009,38(10)︰751-754.
[14]杨滨,阎华,邹华伟,等.X线照射对HeLa细胞TP和DPD酶表达影响及其意义的研究[J].中华肿瘤防治杂志,2008,15(21):1639-1642.
(编辑 武玉欣,英文编辑 郑华川)
Effect of 5-Fluorouracil and Radiotherapy on the Apoptosis of Human Cervical Adenocarcinoma HeLa Cells
YANGBin1,CAIMin1,YANHua2,ZHOUHua-wei1,YANGFan1,LIUYuan1
(1.Department of Obstetrics and Gynecology,Shengjing Hospital,China Medicial University,Shenyang 110004,China;2.Department of Gynecology,Family Planning Research Institute,Affiliated Hospital of Liaoning Province,Shenyang 110031,China)
ObjectiveTo investigate the effect of 5-fluorouracil(5-FU)combined with radiotherapy(RT)on the apoptosis of human cervical cancer HeLa cells.MethodsThe HeLa cells were divided into four groups treated with chemotherapy(ChT),RT,RT+ChT,and control groups.The non-cytotoxic concentration (48h IC50) of HeLa cells treated with 5-FUwas determined by methyl thiazolyl tetrazolium(MTT)and the apoptosis rates of HeLa cells detected by flow cytometry with annexinⅤ-FITCand PIdouble labeling.The morphologic changes of the apoptosis cells were observed under fluorescence microsope.ResultsChT,RTand RT+ChTtreatment could induce the apoptosis of HeLa cells with the strong induction of the combined treatment (P<0.05).Conclusion5-FUcombined with RTcan obviously enhance the apoptosis of HeLa cells,which provides a reliable experimental evidence for clinical use of 5-FUcombined with RTin the intervention of human cervical cancer.
5-fluorouracil;radiotherapy;HeLa cells;apoptosis
R711.74
A
0258-4646(2010)01-0024-04
杨滨(1960-),女,教授,博士.E-mail:yangbinfdy@126.com
2009-10-03

