177Lu-DTPA-BIS-BIOTIN的制备及正常鼠体内生物分布
邓新荣,杜 进,罗志福
1.中国原子能科学研究院 同位素研究所,北京 102413;2.中国同位素有限公司,北京 100045
采用生物素和亲和素系统进行肿瘤预定位放射免疫显像及治疗研究已取得令人鼓舞的结果[1-2]。生物素-亲和素预定位系统具有信号放大作用,能够大幅度提高肿瘤/非肿瘤的放射性核素的比值,从而明显提高诊断的灵敏度[3-4]。
亲和素(Avidin)是一种糖蛋白,又称抗生物素蛋白或抗生物素,由4个相同的、含128 个氨基酸的亚基组成,亚基之间通过二硫键连接,每个亲和素分子可以结合4个生物素(Biotin)分子[5]。生物素和亲和素结合显示高度的亲和性与特异性(亲和力Ka=1015L/mol),它们一旦结合后很难分离。但当生物素或亲和素的活性受到损伤时,其结合能力会下降[6-7]。
在肿瘤预定位放射免疫显像中,先引入亲和素化抗体,在体内预先定位于肿瘤,再注入放射性核素标记的生物素,由于生物素-亲和素的高特异性结合和标记生物素的快速体内代谢过程,显著提高了靶比非靶(T/NT)比值,改善了图像质量,提高了显像的灵敏度[8-10]。
177Lu具有适宜的物理半衰期(6.7 d),发射平均能量为133 keV的β-粒子,在组织中的平均射程为670 μm,适合杀死肿瘤组织;同时发射能量为113(6.4%)和208(11.0%) keV的γ射线用于显像,可监测和指导治疗过程,对患者造成的辐射剂量也较少[3]。177Lu较长的半衰期不但为其生产、产品的QA/QC和对远离核素生产地点的供应提供了方便,还可以减少多次注射给病人带来的痛苦。177Lu可以通过反应堆辐照生产,其低成本和易得性的特点使其适用于生产放射性药物[4]。因此,177Lu 是近年来受到广泛关注的可用于肿瘤治疗的放射性核素。177Lu 标记的放射性药物主要用于治疗骨转移癌疼痛和原发灶癌,其中177Lu-EDTMP(乙二胺四甲撑膦酸)和177Lu-DOTA-TATE(1,4,7,10-四氮杂环十二烷-奥曲肽衍生物)已经进入临床研究[11-12]。
本研究旨在采用177Lu标记DTPA-BIS-BIOTIN,优化标记反应条件,并对标记物在正常小鼠体内生物分布进行研究,为进一步采用177Lu-DTPA-BIS-BIOTIN进行肿瘤预定位显像及治疗研究提供实验基础。
1 实验材料
1.1 主要仪器与装置
BP211D型电子天平,德国Sartorius公司,感量为10-5g;AR2000 放射性薄层扫描仪,美国Bioscan公司;Mili-Q超纯水系统,美国Millipore公司;RM-905A型活度计,中国计量科学研究院;快速薄层纸层析纸(ITLC-SG),美国PALL公司;GAMMA C12 γ计数器,美国DPC公司。
1.2 主要材料与试剂
177LuCl3溶液,放射性浓度为1 840 GBq/L,北京原子高科股份有限公司。DTPA-BIS-BIOTIN,美国SIGMA公司产品,其结构示于图1。醋酸钠,美国SIGMA公司;醋酸、生理盐水等其它化学试剂,分析纯,北京试剂公司。昆明小白鼠,雄性,18~20 g ,二级,购自北京大学医学部实验动物部。
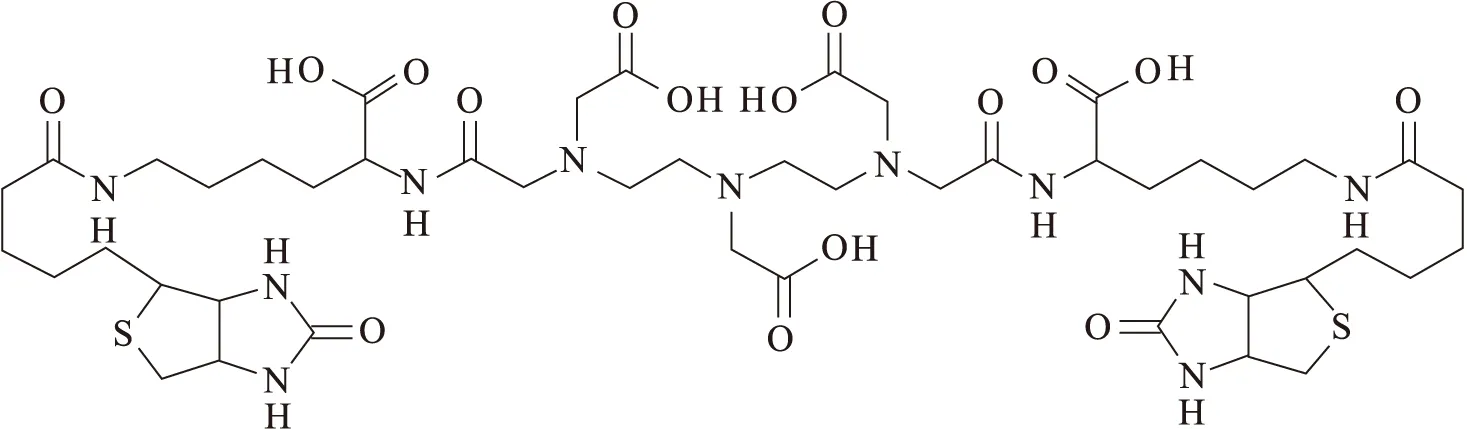
图1 DTPA-BIS-BIOTIN的化学结构Fig.1 Structrure of DTPA-BIS-BIOTIN
2 实验方法
2.1 177Lu-DTPA-BIS-BIOTIN的制备
在Eppendorf(EP)管中加入15 μL DTPA-BIS-BIOTIN(1.0 g/L,溶于0.2 mol/L NaOAc-HOAc缓冲溶液,pH=4.5),加入相同醋酸盐缓冲溶液125 μL,再加入10 μL177LuCl3(18.4 MBq),混匀,在80 ℃反应8 min,取样进行快速薄层层析法(ITLC)检测分析。
用上述类似的标记方法,在其它条件相同的情况下,分别考察不同pH值(3.0、3.8、4.1、4.3和4.5)对标记率的影响,DTPA-BIS-BIOTIN含量分别为5、10、15、20、25 μg时对标记率的影响以及不同反应时间对标记率的影响。
2.2 177Lu-DTPA-BIS-BIOTIN的分析
取标记液点样于ITLC滤纸(10 mm×200 mm)上,以生理盐水为展开剂,上行展开,晾干后用放射性薄层扫描仪扫描,计算标记率或放射化学纯度。
2.3 标记物的体外稳定性
将标记物(放射化学纯度大于99%)于室温放置96 h,并于期间不同时间点取样,使用ITLC法检测标记物的放射化学纯度。
2.4 标记物在正常小鼠体内生物分布实验
取体重为18~20 g的正常昆明小鼠30只,随机分成6组(每组5只),经尾静脉注射100 μL177Lu-DTPA-BIS-BIOTIN(0.3 MBq) ,分别于注射后0.5、1、3、6、24 h断头处死,取血及主要脏器,称重并测量放射性计数,经衰变校正后计算每克组织的百分注射剂量率(%ID/g) 。
3 结果和讨论
3.1 177Lu-DTPA-BIS-BIOTIN的制备和分析
在以生理盐水为展开体系的ITLC分析方法中,游离的177Lu3+的Rf=0.0~0.1,177Lu-DTPA-BIS-BIOTIN的Rf=0.8~0.9,本ITLC分析法可用于测定177Lu-DTPA-BIS-BIOTIN的标记率和放射化学纯度。

图2 pH值对177Lu-DTPA-BIS-BIOTIN标记率的影响Fig.2 Effect of pH on labeling yield
3.1.1标记反应pH值对177Lu-DTPA-BIS-BIOTIN标记率的影响 反应体系pH对177Lu-DTPA-BIS-BIOTIN标记率的影响示于图2。当DTPA-BIS-BIOTIN 10 μg,177LuCl318.4 MBq,80 ℃条件下,标记反应液的pH值分别为3.0、3.8、4.1、4.3和4.5时,反应20 min后177Lu-DTPA-BIS-BIOTIN的标记率分别为72.2%、91.2%、91.1%、92.5%和98.0%。177Lu-DTPA-BIS-BIOTIN的标记率依赖于反应体系的pH值,在pH≈4.5时可获得较高的标记率。
3.1.2DTPA-BIS-BIOTIN浓度对177Lu-DTPA-BIS-BIOTIN标记率的影响 DTPA-BIS-BIOTIN浓度对177Lu-DTPA-BIS-BIOTIN标记率的影响结果示于图3。在加入相同量177LuCl3时,DTPA-BIS-BIOTIN质量分别为5、10、15、20、25 μg时,177Lu-DTPA-BIS-BIOTIN标记率分别为93.5%、95.9%、98.3%、99.1%、99.9%。在DTPA-BIS-BIOTIN质量为20~25 μg时,标记率基本不变,可获得高放射化学纯度的177Lu-DTPA-BIS-BIOTIN溶液。

图3 DTPA-BIS-BIOTIN质量对177Lu-DTPA-BIS-BIOTIN标记率的影响Fig.3 Effect of mass of DTPA-BIS-BIOTIN on labeling yield
3.1.3反应时间对177Lu-DTPA-BIS-BIOTIN标记率的影响 反应时间对177Lu-DTPA-BIS-BIOTIN标记率的影响示于图4。在相同量的DTPA-BIS-BIOTIN和177LuCl3条件下,DTPA-BIS-BIOTIN质量为25 μg、反应温度为80 ℃时,反应时间为10 min时177Lu-DTPA-BIS-BIOTIN的标记率为98.5%,随着时间延长到60 min,标记率均可达99.0%以上。

图4 不同反应时间对177Lu-DTPA-BIS-BIOTIN标记率的影响Fig.4 Effect of reaction time of DTPA-BIS-BIOTIN on labeling yield
3.2 177Lu-DTPA-BIS-BIOTIN的体外稳定性
标记物177Lu-DTPA-BIS-BIOTIN(放射化学纯度大于99%)具有良好的体外稳定性,室温放置24 h稳定,放化纯大于99%,放置48 h后放化纯为99%,放置96 h后,放射化学纯度仍都保持在98%以上。
3.3 177Lu-DTPA-BIS-BIOTIN在小鼠体内的生物分布
177Lu-DTPA-BIS-BIOTIN在正常小鼠体内分布列于表1。由表1可以看出,经尾静脉注射后,177Lu-DTPA-BIS-BIOTIN在小鼠血液中清除迅速,30 min 时血中滞留(0.454±0.115)%ID/g,24 h后几乎全部代谢。177Lu-DTPA-BIS-BIOTIN在肾中有较高的摄取,30 min 时肾的摄取为(2.470±0.375)%ID/g,提示177Lu-DTPA-BIS-BIOTIN主要经肾脏排泄;但在正常组织如肝、脾等有非特异性摄取,这与文献报道153Sm-DTPA-BIS-BIOTIN在小鼠体内的代谢情况相似[5]。在注射后24 h胫骨摄取为(0.681±0.164)%ID/g,可能是由于经过体内的生物素激酶作用后,177Lu被释放浓集于骨骼组织的缘故。这与177Lu-DTPA-BIS-BIOTIN的体内稳定性相关,导致其不稳定的途径主要有2种:一是在血清中蛋白激酶如生物素激酶作用下使放射性核素从DTPA-BIOTIN复合物上脱落;另一途径是由于此类放射性核素与双功能螯合剂结合稳定性高,使双功能螯合剂与生物素之间的键断裂。对于DTPA-BIS-BIOTIN更倾向标记核素从复合物上脱落[13],本实验也得到与文献中报道类似的结果。

表1 177Lu-DTPA-BIS-BIOTIN在正常小鼠体内分布Table 1 Biodistribution of 177Lu-DTPA-BIS-BIOTIN in normal mice
注(Note):n=5
4 结 论
在最佳标记条件下(DTPA-BIS-BIOTIN 25 μg,标记介质pH=4.5,80 ℃反应20 min),177Lu-DTPA-BIS-BIOTIN标记率大于99.0%,室温下放置96 h,标记物体外稳定性良好。正常小鼠体内分布实验结果表明,177Lu-DTPA-BIS-BIOTIN在血液中清除快,主要浓集于肝、脾和肾,经肾脏排泄。本研究为进一步采用177Lu-DTPA-BIS-BIOTIN进行肿瘤预定位显像及治疗研究提供了实验基础。
致谢:感谢樊彩云、叶肇云等科研人员的帮助。
[1] Lesch H P, Kaikkonen M U, Pikkarainen J T, et al. Avidin-Biotin Technology in Targeted Therapy[J]. Expert Opin Drug Deliv, 2010, 7(5): 551-564.
[2] Boerman O C, van Schaijk F G, Oyen W J G, et al. Pretargeted Radioimmunotherapy of Cancer: Progress Step by Step[J]. J Nucl Med, 2003, 44: 400-411.
[3] Stella M, de Nardi P, Paganelli G, et al. Avidin-Biotin System in Radio Immunoguided Surgery for Colorectal Cancer, Advantages and Limits[J]. Dis Colon Rectum, 1994, 37: 335.
[4] Sharkey R M, Karacay H, Cardillo T M, et al. Improving the Delivery of Radionuclides for Imaging and Therapy of Cancer Using Pretargeting Methods[J]. Clin Cancer Res, 2005(11): 7 109s-7 121s.
[5] Goodwin D A, Meares C F. Pretargeted Peptide Imaging and Therapy[J]. Cancer Biother Radio-pharm, 1999, 14: 145-152.
[6] Goldenberg D M. Targeted Therapy of Cancer With Radiolaleled Antibodies[J]. J Nucl Med, 2002, 43: 693-713.
[7] Rosebrough S F, Hartley D F. Biochemical Modification of Streptavidin and Avidin:inVitroandinVivoAnalysis[J]. J Nucl Med, 1996, 37(8): 1 380-1 384.
[8] Meredith R F, Buchsbaum D J. Pretargeted Radioimmunotherapy[J]. Int J Radiation Oncology Biol Phys, 2006, 66: S57-S59.
[9] Graves S S, Dearstyne E, Lin Y, et al. Combination Therapy With Pretarget CC49 Radioimmunotherapy and Gerncitabine Prolongs Tumor Doubling Time in Amurine Xenograftmod Elofcolon Cancermore Effectively Than Either Monotherapy[J]. Clin Cancer Res, 2003, 9(10 Pt 1): 3 712-3 721.
[10] Gasparri A, Moro M, Curnis F, et al. Tumor Pretargeting With Avidin Improves the Therapeutic Index of Biotinylated Tumor Necrosis Factor α in Mouse Model[J]. Cancer Research, 1999, 59: 2 917-2 923.
[11] Liepe K, Runge R, Kotzerke J. The Benefit of Bone-Seeking Radiopharmaceuticals in the Treatment of Metastatic Bone Pain[J]. J Cancer Res Clin Oncol, 2005, 31(1): 60-66.
[12] Ando A, Ando I, Tonami N, et al.177Lu-EDTMP: A Potential Therapeutic Bone Agent[J]. Nucl Med Commun, 1998, 19(6): 587-591.
[13] Hainsworth J, Harrison P, Mather S J. Preparation and Characterization of a DOTA-Lysine-Biotin Conjugate as an Effector Molecule for Pretargeted Radionuclide Therapy[J]. Bioconjugate Chem, 2005, 16: 1 468-1 474.

