不育男性无精子因子基因检测分析*
孙华宾 刘 燕 刘雅峰
(1.中山大学附属第五医院,广东 珠海 519000; 2.中山大学附属第一医院,广东 广州 510080)
男性不育是男科常见病,其原因除了营养不良、内分泌疾病、环境毒物等因素外,仍有11%患者属于特发性不育。研究发现特发性不育多与遗传因素有关,其中Y染色体无精子因子(azoospermia factor,AZF)微缺失是除Klinefelters综合征外导致男性不育的第二大原因[1]。卵浆内单精子注射技术(intracytoplasmic sperm injection,ICSI) 治疗男性不育效果满意,由于Y染色体微缺失可能通过该辅助生殖方式传给后代[2],因此,无精子症患者在ICSI治疗前进行Y染色体的微缺失筛查很有必要。本研究对202例原发无精、严重少精子症患者和66例正常生育男性进行了Y染色体微缺失筛查和分析,报告如下。
1 材料和方法
1.1临床资料 2005年1月~2009年6月在我院男科门诊就诊的男性不育患者202例, 年龄24~45岁,平均28.6岁,平均不育年限4.8年。全部患者排除精索静脉曲张、隐睾、附睾损伤以及阻塞性无精子症(结合精液pH值、精浆果糖、α-糖苷酶) 等疾病,且无特殊病史及家族史;按照WHO标准连续3次精液常规分析确诊为无精子症118例,严重少精子症(<5×106/ml ) 84例;常规染色体核型分析均为46,XY;血清性激素浓度均在正常范围。正常对照组选择有生育史男性共66 例,年龄22~36岁,平均25.8岁,其精子密度>5×106/ml,快速前向运动和前向运动精子比率>60%。签署知情同意书。
1.2检验方法
1.2.1DNA的抽提 抽取研究对象外周血2 ml加入含EDTA抗凝管,DNA抽提试剂盒购自中山大学达安基因诊断中心,按照试剂盒说明步骤进行操作,最后将DNA稀释成100 ng/μL的工作浓度。
1.2.2PCR扩增及电泳检测 选择AZF区域的6个序列标签点(sequence targeted sites,STS) 位点作为检测目标[3],分别是AZFa区sY86、sY84;AZFb区sY134、sY127;AZFc区sY255、sY254。内对照选择位于Y染色体短臂(Yp)的睾丸决定基因(SRY)和锌指蛋白基因(ZFX/ZFY)。AZF微缺失筛查引物序列见表1。所有DNA样品均经2次多重PCR完成,分别为Multiplex A和B,每次多重PCR均包括AZFa、b、c区域的STS和对照基因引物。在Multiplex A中完成ZFX/ZFY、SRY、sY86、sY127、sY254的扩增;在Multiplex B中完成ZFX/ZFY、SRY、sY84、sY134、sY255的扩增。PCR反应总体积25 μl。反应条件为:基因组DNA100 ng,10×缓冲液2.5 μl,引物各1 μl (10 μmol/L),dNTP2 μl,DNA聚合酶1 U,用灭菌蒸馏水补至25 μl,扩增条件:95℃3 min,95℃30 s,59℃30 s,72℃30 s,35个循环,最后72℃延伸10 min。经3%琼脂糖凝胶电泳检测扩增结果,电泳电压100 V,约45 min完成。

表1 多重PCR引物的基本资料
1.3统计学方法 采用SPSS13.0统计软件处理数据。计数资料组间比较采用χ2检验。P≤0.05为有统计学意义。
2 结 果
202例患者多重PCR扩增后电泳结果显示,25例有Y染色体微缺失,总缺失率12.4%,12例无精症患者和5例少精症患者的缺失发生在AZFc区域,缺失率为8.4%;1例无精症患者和2例少精症患者发生AZFb、AZFc双重缺失,缺失率为1.5%;1例无精症患者发生AZFa、b、c三个区域同时微缺失,缺失率为0.5%。空白对照组泳道未见电泳条带,女性对照组泳道仅见ZFY扩增片段,正常男性对照和未发生缺失患者泳道可见5条电泳条带,结果见图1。生精障碍组与正常生育男性组比较Y染色体AZF区域微缺失率差异具有显著性(χ2=9.01,P=0.0027)。
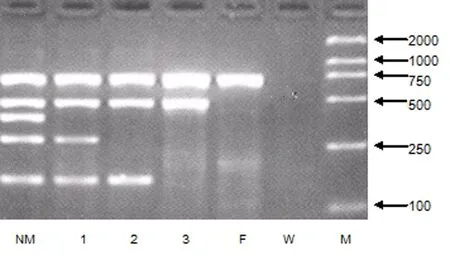
图1 AZF区域微缺失筛查电泳例图
注:NM.正常男性(阳性对照);1. sY254缺失;2. sY254、sY127缺失;3. sY254、sY127、sY86缺失;FM.正常女性(阴性对照);W.空白对照;M .DNA分子量标准(Marker)。
3 讨 论
男性不育的遗传原因越来越受到重视,尤其是男性原发性无精症和少精症的研究报道很多,无精子因子的微缺失是无精子和严重少精子男性常见的基因改变之一。AZF微缺失主要分布在Y染色体长臂近中远三个非重叠区域,分别称为AZFa、AZFb、AZFc 3个区域。Simoni等[3]在总结大量AZF微缺失分子流行病学调查资料的基础上,提出了欧洲标准化的临床AZF微缺失筛查方案,进一步推动了AZF区域微缺失检测的临床应用。男性不育者发生AZF微缺失的比例文献报道不同,比例从1%~55%[4-6]。可能原因:(1)研究对象的选择标准不同;(2)选用的STS标记位点的密度和位置不同;(3)研究群体的遗传背景和环境不同;(4)PCR的结果不够准确等原因造成的。
本研究中的202例男性不育生精障碍患者中发现AZF微缺失25例,总缺失率为12.4%。从AZF区域微缺失的特点看,AZFc区的缺失率占总缺失的为78.9%,这提示AZFc区是整个AZF区域微缺失的热区,实验组与对照组AZF 区域微缺失率的比较差异有极显著性,显示男性原发无精症与AZF 微缺失密切相关, 此结果与国内外报道基本一致[7]。因此对原发性无精症患者进行常规AZF 检测发现不育男性基因改变是十分必要的。
AZF微缺失筛查最好采用多重PCR技术体系,每个位点设置2个STS,所设计的引物应该包括:sY14(SRY )、ZFX/ZFY、sY84、sY86、sY127、sY134、sY254、sY255。采用上述位点可以检测到目前已知
的95%以上的Yq微缺失。本研究采用多重PCR技术对无精子症和重度少弱精症患者常规筛查上述6个位点,收到了良好的效果。本研究显示 AZF 区域微缺失与无精子症之间存在因果关系, AZFc 区的缺失支持精子发生受Y 染色体上的多个基因控制理论。为避免遗传缺陷的垂直传递,为患者的治疗及遗传咨询提供依据,在男性原发性无精和少精症辅助生育精子质量筛查非常必要。本研究提供了一套完整的应用临床PCR 反应检测Y染色体微缺失的筛查方法,在一定程度上明确了无精症与AZF 区域微缺失的各种缺失特点,为开展临床AZF 微缺失检测奠定了基础。
国内近年辅助生育技术广泛开展,增加了相关基因缺陷遗传的机会。因此,开展临床AZF微缺失检测显得尤为重要,可以筛选出相关的缺陷基因。对男性不育症患者开展AZF区域微缺失基因诊断,为男性不育的治疗及辅助生殖技术的临床开展,具有重要的理论和指导意义。
[1] Vogt PH. Human chromosome deletions in Yq11, AZF candidate genes and male infertility: history and update[J]. Mol Hum Reprod,1998, 4(8):739-744.
[2] Kent-First MG, Kol S, Muallem A, et al. The incidence and possible relevance of Y-linked microdeletions in babies born after intracytoplasmic sperm injection and their infertile fathers[J]. Mol Hum Reprod,1996,2(12):943-950.
[3] Simoni M, Bakker E, Eurlings MC,et al. Laboratory guidelines for molecular diagnosis of Y chromosomal microdeletions[J].Int J Androl,1999,22(5):292-299.
[4] 蔡志明, 肖晓素, 刘晓笠, 等.无精症、严重少精症患者Y染色体无精子因子微缺失的遗传学研究[J]. 中华医学遗传学杂志,2005, 22(1): 85-87.
[5] 蒲春林, 阿曼古丽. 新疆本地和来自四川地区汉族不育症患者Y染色体长臂微缺失分析[J]. 中华男科学杂志,2009, 15(1): 74-77.
[6] 刘雅峰, 周灿权, 欧建平, 等. 多重聚合酶链反应检测Y染色体无精子因子微缺失[J]. 临床泌尿外科杂志,2008, 23(5): 359-361.
[7] 杨元, 张思仲, 彭黎明, 等. 中国人原发无精与严重少精症Y染色体AZF区域微缺失的分子流行病学的研究[J].中华医学遗传学杂志, 2003; 20(5): 385-389.

