结核菌素皮试和全血γ干扰素测定对儿童结核病诊断准确性的研究
孙 琳 肖 婧 李惠民 焦伟伟 冯卫星 吴喜荣 苗 青 焦安夏 郭雅洁 申阿东
结核感染是引起发展中国家儿童死亡的重要原因之一[1]。全世界每年约有100万新发儿童结核病病例, 约有40万儿童因此而死亡[2]。第4次全国结核病流行病学抽样调查显示,中国0~14岁儿童结核感染率为9.0%[3]。结核感染的早期诊断和治疗是降低儿童结核病病死率的关键。因此,加强儿童结核感染的实验室诊断,及早筛查出潜伏性结核感染者和活动性结核病,已成为当前控制结核菌感染的重中之重。
结核菌素(PPD)皮试是目前筛查儿童潜伏感染及诊断结核病的重要辅助手段,但由于纯蛋白衍生物是多种抗原的混合物,所含抗原为致病性分枝杆菌、环境分枝杆菌及卡介苗(BCG)菌株所共有,其结果受到BCG接种及其他分枝杆菌感染的影响,常可导致假阳性结果[4]。当患儿出现免疫功能低下,如结核性脑膜炎、全身播散性结核病时可出现假阴性结果。PPD皮试诊断结核病的特异度和敏感度还受其阳性判断标准的影响,然而目前国内PPD皮试在儿童结核感染诊断中的标准尚不统一,在儿童结核感染诊断中仍存在一定的局限性。第4次全国结核病流行病学抽样调查以硬结平均直径≥6 mm或有水疱作为筛查成人和儿童潜伏结核感染的标准。中华医学会儿科学分会呼吸学组制定的“儿童肺结核的临床诊断标准和治疗方案(试行)”[5]认为PPD皮试硬结直径﹥15 mm多见于结核杆菌自然感染,而因BCG接种引起的很少见。
全血IFN-γ测定以结核分枝杆菌特异性抗原早期分泌靶蛋白ESAT-6(early-secreted antigenic target-6) 和培养滤液蛋白(culture filtrate protein-10),刺激活化T细胞产生IFN-γ为原理建立。一方面,该试验结果不受BCG接种的影响,因此尤其适用于BCG接种率较高的人群[6],具有较高的敏感度(75%~97%)和特异度(﹥95%)[7]。全血IFN-γ测定已在欧美等国广泛应用于结核病的常规诊断和疗效评估[8~10]。另一方面,该试验受机体免疫状态的影响较小,只有当患者的CD4+T细胞数每微升﹤100时,其敏感度才会有所降低[11],因此在结核和HIV双重感染或免疫抑制人群[12,13]、免疫力较低的婴幼儿和儿童[14]中也有较好的应用价值。孟成艳等[15]研究认为全血IFN-γ测定辅助诊断疑似结核病患者,具有较高的诊断价值。乐军等[16]研究表明,全血IFN-γ测定在快速诊断结核感染中具有较高的敏感度和特异度。
然而,目前关于全血IFN-γ测定在结核感染患儿中诊断价值的研究较少,特别是在结核病高发、BCG接种率较高中国的数据更为缺乏,同时基于目前国内PPD皮试在儿童结核感染诊断中的标准尚不统一,本研究试图通过不同结核病实验室诊断方法的比较,寻求适合中国国情的、经济的和高效的实验室诊断方案,为儿科临床结核感染的诊断提供依据。
1 方法
1.1 研究设计 2006年7月前瞻性地设计了PPD皮试不同阳性判断标准、PPD皮试和全血IFN-γ测定对结核病诊断的准确性研究,并参照文献[17,18],以年龄(<3岁和≥3岁)、居住地(城区和郊区)、BCG接种史作为本研究诊断性试验的影响因素,观察上述影响因素对PPD皮试和全血IFN-γ诊断结核病的敏感度、特异度、阴性预测值、阳性预测值和似然比等[19]。
1.2 纳入标准 首都医科大学附属北京儿童医院2个呼吸科病房以结核病和呼吸系统疾病住院的所有患儿为观察对象,2个呼吸科病房的医生均了解本研究的设计和实施要求。PPD皮试在取得患儿及其监护人同意的情况下为2个呼吸科病房住院患儿的常规检查,由于全血IFN-γ测定为有创性检查,在2个呼吸科病房的医生尽可能详细说明本研究的目的和免费全血IFN-γ测定的前提下、在患儿及其监护人在理解本研究目的的情况下,自愿参与本研究者,作为数据收集的基本要求。存在呼吸系统疾病同时伴有肺外感染或自身免疫性疾病或内分泌系统疾病或HIV感染的患儿不建议行全血IFN-γ测定。在结束本研究观察的时点后,通过查阅病史,能提取本研究计划观察项目的病例,如入院年龄、有明确的PPD直径数值(不仅以阳性或阴性表示者)、BCG接种史明确者作为本研究的纳入对象。
1.3 排除标准 符合以下任一项者被排除:①行PPD皮试和全血IFN-γ测定前使用糖皮质激素及其他免疫抑制剂患儿的数据;②本次入院前已接受抗结核治疗1个月以上,尽管也进行了PPD皮试和全血IFN-γ测定的病例也被排除。
1.4 分组设计 根据患儿所暴露的危险因素分为5组:A组:无结核病密切接触史的非结核病的呼吸系统疾病患儿;B组:有活动性结核病患者密切接触史的非结核病的呼吸系统疾病患儿;C组:无结核病密切接触史的临床诊断结核病患儿;D组:有活动性结核病患者密切接触史的临床诊断结核病患儿;E组:病原学或病理学确诊的活动性结核病患儿。
1.5 诊断标准 结核病的诊断依据美国胸科协会制定的“成人和儿童结核病诊断和分级标准”[20]和中华医学会儿科学分会呼吸学组制定的“儿童肺结核的临床诊断标准和治疗方案(试行)”[5]。其中具有典型的临床症状和影像学证据,同时存在病原学检测或组织病理学检测阳性者,为确诊病例(E组);具有典型的临床症状和影像学证据,同时具有以下4项中任意2项者即为临床诊断病例(C、D组):①活动性结核病接触史;②PPD皮试阳性;③抗结核治疗有效;④排除其他肺部疾病。
潜伏结核感染诊断标准参照《实用小儿结核病学》[21],选取PPD皮试阳性除外BCG接种后反应,无影像学或临床无活动性结核病证据,可能A、B组病例存在潜伏结核感染。
1.6 伦理 本研究取得了首都医科大学附属北京儿童医院伦理委员会的批准。
1.7 PPD皮试方法 患儿于入院当天,前臂皮下注射0.1 mL(含5 U的PPD),注射后48~72 h测量硬结大小。记录硬结平均直径=(横径+ 纵径) /2 ,反应大小以mm记录。
1.8 PPD皮试阳性结果标准 无硬结或硬结平均直径<5 mm为阴性;~10 mm为阳性;~20 mm为中度阳性;≥20 mm为强阳性;局部除硬结外还有水泡、破溃、淋巴管炎及双圈反应为极强阳性。
1.9 全血IFN-γ测定
1.9.1 血样采集 患儿于入院后1~7 d内采集外周静脉血2 mL,肝素抗凝,标本采集后室温放置,并于6 h内进行测定。
1.9.2 外周血单核细胞(PBMC)的分离和培养 用无菌Ficoll液分离PBMC,加入细胞培养液AIM-V重悬细胞。吸取10 μL预温培养液进行活细胞计数,将培养液的PBMCs浓度调整到每毫升2.5 ×105个。T细胞酶联免疫斑点法(TSPOT)-TB试剂盒(英国Oxford Immunotec Ltd)中预包被抗IFN-γ抗体的96孔微孔板设阴性对照孔,阳性对照孔(A和B检测孔),分别加入50 μL AIM-V细胞培养液,植物血凝素,结核菌特异抗原ESAT-6和CFP-10。将分离的PBMC悬液加入各孔中,每孔100 μL。将微孔板置于37℃ 5%CO2孵箱16~20 h后,用PBS洗板4次,加入碱性磷酸酶标记的小鼠抗人IFN-γ单抗,4℃温育1 h。PBS洗板4次。加入50 μL底物显色溶液至所有孔中。室温孵育7 min。用蒸馏水充分洗涤孔的内部终止反应。
1.9.3 PBMC 释放IFN-γ检测和结果判断 以放大镜或计算机辅助成像分析系统进行斑点计数。
TSPOT-TB阳性标准:阴性对照孔斑点数为0~5个,任何一个检测孔计数减去阴性孔计数≥6判断为阳性。如阴性对照斑点数≥6,检测孔斑点数≥2倍阴性对照孔斑点数,也判定为阳性(图1)。
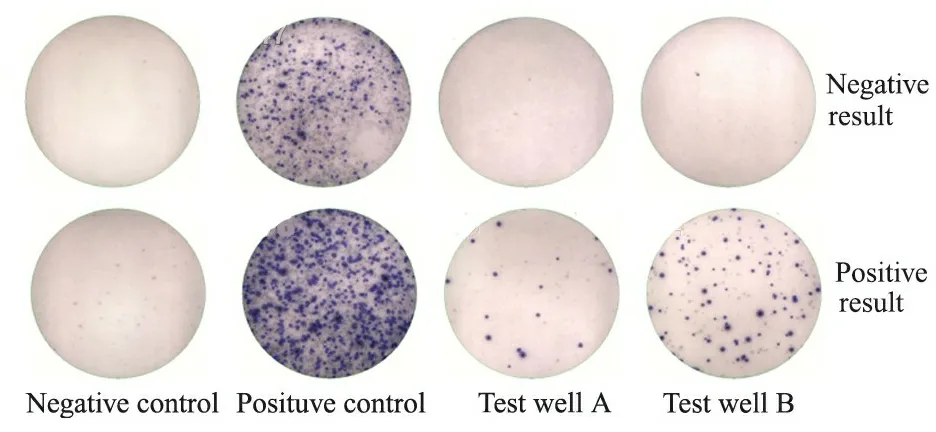
图1 全血IFN-γ测定阴性和阳性结果
Fig 1 The negative and positive results of whole blood IFN-γ assay using TSPOT-TB
1.10 统计学方法 计数资料以百分比表示,率的显著性采用χ2检验。PPD皮试和全血IFN-γ测定阳性率与结核感染暴露程度的相关性采用等级相关分析。P<0.05为差异有统计学意义。采用SPSS 11.5软件进行统计分析。
2 结果
2.1 一般资料 本研究从2006年7月开始收集病例,研究截止时间为2010年3月。在首都医科大学附属北京儿童医院2个呼吸科病房4 400例结核病和呼吸疾病患儿中,由于绝大部分患儿及其监护人不同意行免费全血IFN-γ测定,致使符合纳入和排除标准的患儿仅有125例。A组40例、B组11例、C组29例、D组27例和E组18例进入分析,各组一般资料见表1。E组病原学确诊6/18例(33.3%),病理学诊断12/18例(66.7%);C~E组共计74例患儿中,15例(20.3%)有发热、盗汗、纳差和消瘦等结核病中毒症状,24例(32.4%)有结核病密切接触史;53例(71.6%)有BCG接种史。BCG接种率由A组至E组逐渐降低。
表1 各组研究对象的一般资料
Notes M/F:Male/Female
2.2 两种方法诊断结核病的准确性 各组患儿PPD皮试和全血IFN-γ测定阳性结果见表。A组28/40例(70.0%)PPD皮试硬结<4 mm,2例(5.0%)全血IFN-γ测定阳性且PPD皮试硬结≥15 mm;B组6/11例(54.5%)PPD皮试硬结<4 mm,1例全血IFN-γ测定阳性且PPD皮试硬结≥15 mm。C~E组20/74例(27.0%)PPD皮试硬结在10~14 mm,PPD皮试硬结<15 mm的37例患儿中15例为全血IFN-γ测定阳性。
如表3所示,随着PPD皮试阳性判断标准逐渐升高,PPD皮试诊断活动性结核病的敏感度逐渐降低,阴性预测值逐渐减小,特异度逐渐升高。取硬结≥10 mm为阳性判断标准时的敏感度为77.0%,可用于结核病诊断;取硬结≥15 mm为阳性判断标准时的特异度为88.2%,可用于结核筛查。
全血IFN-γ测定敏感度为85.1%,特异度为94.1%,均高于PPD皮试,提示在诊断活动性结核病和筛查潜伏结核感染者中均具有较好的诊断价值。
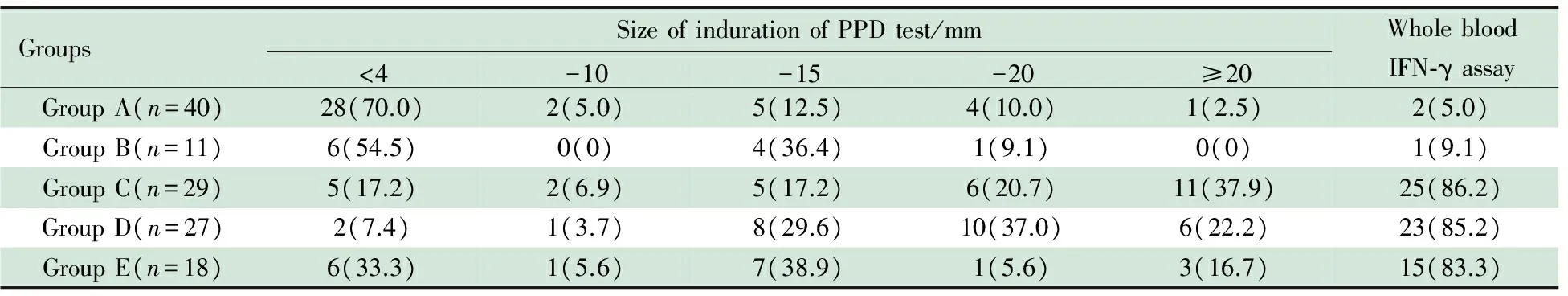
表2 各组患儿PPD皮试和全血IFN-γ测定阳性结果[n(%)]
表3 PPD皮试和全血IFN-γ测定诊断结核病的准确性
Tab 3 The indexes of PPD test and whole blood IFN-γ assay in diagnosis of pediatric TB
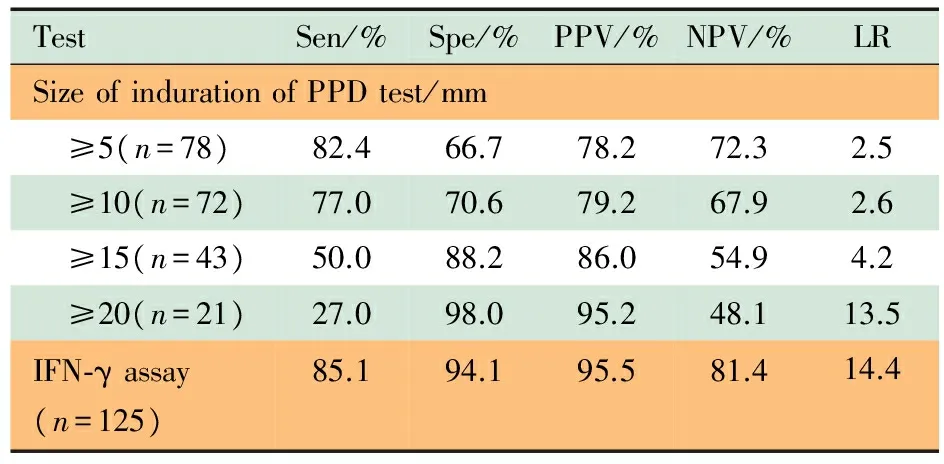
TestSen/%Spe/%PPV/%NPV/%LRSizeofindurationofPPDtest/mm ≥5(n=78)82.466.778.272.32.5 ≥10(n=72)77.070.679.267.92.6 ≥15(n=43)50.088.286.054.94.2 ≥20(n=21)27.098.095.248.113.5IFN⁃γassay(n=125)85.194.195.581.414.4
Notes Sen:sensitivity;Spe:specificity;PPV:positive predictive value;NPV:negative predictive value;LR:likelihood ratio
2.3 两种方法敏感度和特异度影响因素的分析 分别计算PPD皮试(硬结≥10 mm为阳性判断标准)和全血IFN-γ测定在不同年龄(<3岁和≥3岁)、居住地(城区和郊区)和BCG接种史(无和有)时诊断结核病的敏感度和特异度。结果显示,<3岁患儿PPD皮试的敏感度和特异度均显著低于≥3岁患儿(P=0.001,P=0.037);在未接种BCG的2例非结核病患儿中1例为PPD阴性,故PPD皮试的特异度为50%;居住地对PPD皮试的敏感度和特异度无显著影响。全血IFN-γ测定的敏感度和特异度在不同年龄、居住地和BCG接种史间差异均无统计学意义(表4)。
表4 PPD皮试和全血IFN-γ测定诊断结核病敏感度和特异度影响因素的分析
Tab 4 Evaluation of the effect of influencing factors of PPD test and whole blood IFN -γ assay in diagnosis of pediatric TB
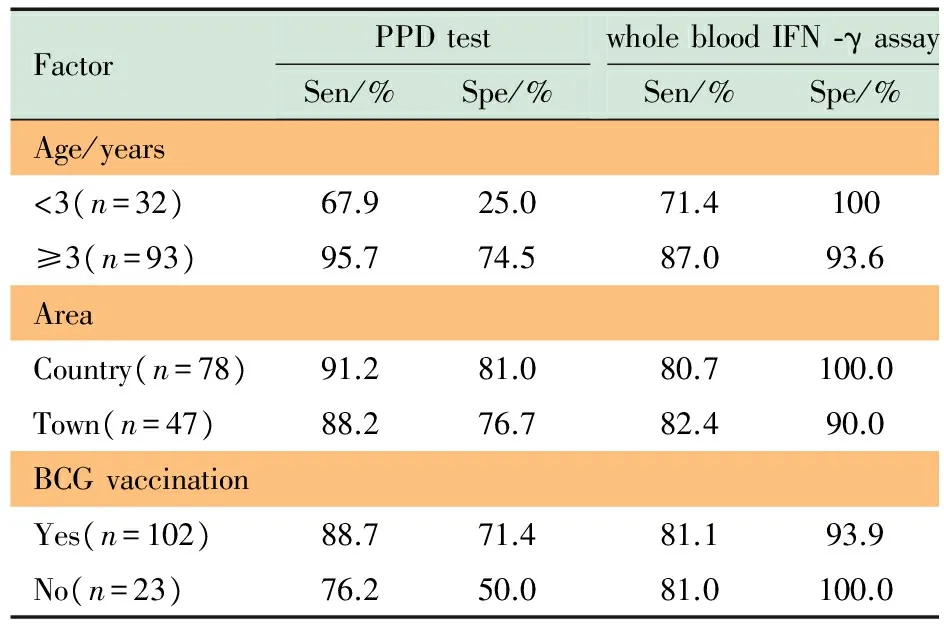
FactorPPDtestSen/%Spe/%wholebloodIFN⁃γassaySen/%Spe/%Age/years<3(n=32)67.925.071.4100≥3(n=93)95.774.587.093.6AreaCountry(n=78)91.281.080.7100.0Town(n=47)88.276.782.490.0BCGvaccinationYes(n=102)88.771.481.193.9No(n=23)76.250.081.0100.0
Notes Sen:sensitivity;Spe:specificity
2.4 两种方法阳性率与结核菌感染暴露因素的相关性 以PPD皮试取≥10 mm为阳性判断标准时,PPD皮试阳性率与结核感染暴露因素的等级相关系数为0.425,P=0.000;当PPD皮试取≥15 mm为阳性判断标准时,PPD皮试阳性率与结核感染暴露因素的等级相关系数为0.256,P=0.004。全血IFN-γ测定阳性率与结核感染暴露因素的等级相关系数为0.676(P=0.000),相关性高于PPD皮试。
3 讨论
本研究从2006年7月至2010年4月2个呼吸科病房住院的4 400例患儿中,由于排除了绝大部分患儿及其监护人不同意行全血IFN-γ测定的病例,致使4年来本研究仅纳入125例患儿。病原学检查作为目前结核病诊断的金标准。但由于患儿痰标本不易获取且常合并肺外结核感染,因此本研究中PPD皮试和全血IFN-γ测定的敏感度评价以最终确诊和临床诊断为活动性结核病为金标准;特异度评价在A和B组患儿中进行。基于目前国内PPD皮试在儿童结核感染诊断中的标准尚不统一,本研究同时评价了不同阳性判断标准对PPD皮试诊断价值的影响。
BCG接种是中国儿童常规免疫接种项目,但对于其在预防结核病的作用结论不一致。BCG抗结核分枝杆菌感染的作用在0~80%,且易引起BCG播散性疾病,美国等国家也相继取消了新生儿的BCG常规接种。本研究发现,结核病患儿中BCG接种率明显低于非结核感染呼吸系统疾病患儿(表1),结果提示BCG对中国儿童抗结核分枝杆菌感染有一定的作用。
本研究显示,随着PPD皮试阳性判断标准逐渐升高,特别是当PPD皮试以硬结≥15 mm为阳性判断标准时,其敏感度明显降低。PPD皮试在C~E组患儿中出现假阴性结果,增加了漏诊率。分析原因,发现在C~E组的74例患儿中,15例(20.3%)为全血IFN-γ测定阳性而PPD皮试阴性,20例(27.0%)PPD皮试硬结在10~14 mm,考虑C~E组患儿出现较重的结核病症状时,如结核性脑膜炎等,由于机体免疫状态降低而导致迟发型免疫反应减弱。因此,本研究提示在结核病患儿以PPD皮试硬结≥10 mm为诊断标准,可提高诊断的敏感度,可能会减少机体免疫状态对结果的影响。
本研究结果显示,PPD皮试筛查潜伏结核感染时,以硬结≥10 mm作为诊断标准其特异度较低。考虑是由于BCG接种[17]或非结核分枝杆菌感染[22]导致的假阳性结果有关。A和B组PPD皮试阳性率分别为25.0%(10/40例)和45.5%(5/11例),远高于中国儿童潜伏结核感染率(4.6%~14.4%),同时两组患儿BCG接种率分别为97.5%和90.9%。该结果提示,较高的PPD皮试阳性率可能是由于PPD与BCG的交叉反应而导致的假阳性结果。A和B组全血IFN-γ测定阳性率分别为5.0%(2/40例)和9.1%(1/11例),提示该方法受BCG接种的影响较小,具有较高的特异度[23]。目前对于非结核分枝杆菌感染所致PPD皮试阳性的研究结果尚不统一。Bahrmand等[24]和von Reyn等[25]认为非结核分枝杆菌感染导致的PPD皮试硬结一般在5~14 mm;而Haimi-Cohen[22]等认为50%非结核分枝杆菌感染患儿的PPD皮试硬结﹥15 mm。
为进一步排除BCG接种和非结核分枝杆菌对PPD皮试结果的影响,本研究分析了PPD皮试硬结≥15 mm作为筛查结核感染的价值,结果显示,A和B组PPD试验阳性率分别为12.5%(5/40例)和9.1%(1/11例),该结果与中国儿童潜伏结核感染率较为一致,PPD皮试的特异度增加。提示,以PPD皮试硬结≥15 mm为阳性判断标准,可提高诊断的特异度,避免BCG和非结核分枝杆菌感染的干扰。在非结核呼吸系统疾病的A和B组患儿中,有3例患儿全血IFN-γ测定阳性且PPD皮试硬结≥15 mm,其中仅1例具有活动性结核病患者接触史,考虑其为潜伏结核感染患儿。但由于目前尚无潜伏结核感染诊断的金标准,该结果尚需进一步的验证。
多项研究指出,BCG接种可影响PPD皮试诊断结核病的准确性,可使特异度降低。本研究虽显示相反的结论,但由于病例数较少,需扩大样本量进一步分析。机体的免疫状态也是影响PPD皮试诊断准确性的重要因素,由于儿童的免疫功能尚不健全,且随年龄增长而改变,3岁前后机体的T细胞亚群存在差异(相关数据另文发表),因此本研究分析了年龄因素对PPD皮试和全血IFN-γ测定诊断准确性的影响。结果显示,<3岁患儿PPD皮试诊断结核病的敏感度和特异度显著低于≥3岁患儿,究其原因可能为<3岁患儿免疫系统尚不完善,且BCG接种导致的机体记忆性保护作用仍较强。由于当前结核感染率仍存在城乡差异,但本研究未发现城乡因素对两种试验准确性产生影响,可能考虑与本研究纳入的125例患儿郊区与城区样本量间有较大差异有关。
本研究同时对两种方法的阳性率与结核感染暴露因素的相关性进行研究,结果显示,PPD皮试和全血IFN-γ测定均与结核感染暴露因素呈正相关,但全血IFN-γ测定相关程度高于PPD皮试,提示全血IFN-γ测定试验具有更好的诊断价值。
全血IFN-γ测定诊断结核病虽具有较高的敏感度和特异度,但其仍存在操作技术要求高、费用昂贵等因素,限制了其在中国儿童中的广泛应用。因此,考虑在以下情况下可将全血IFN-γ测定作为PPD皮试初筛后的辅助诊断工具应用于临床诊断:①疑似结核病患儿PPD试验结果阴性;②患儿无结核病接触史等危险因素存在前提下,PPD皮试阳性无法除外潜伏性结核感染;③当患儿PPD皮试硬结在10~14 mm;④患儿年龄<3岁。
总之,全血IFN-γ测定是当前结核感染筛查和诊断的重要辅助手段,可有效弥补PPD皮试在BCG接种率高、结核病负担重的国家或地区应用的局限性。
本研究的不足之处和局限性:①由于儿童结核病病原学诊断较为困难,C和D组为临床诊断病例,缺乏病原学金标准;②因伦理原因,本研究对照组选取的呼吸科病房住院的呼吸系统疾病患儿,未设健康儿童对照组;③部分结核病患儿为接受抗结核治疗1~7 d后进行的全血IFN-γ测定,但有研究表明抗结核治疗1个月内,全血IFN-γ测定阳性率下降较前无统计学意义[26];④由于本研究纳入病例有限,且诊断准确性影响因素(年龄、居住地和BCG接种史)的各组患儿病例数不均衡,可能会对结果产生一定影响。
[1]Zar HJ. Tuberculosis in the developing world. Pediatr Pulmonol Soppl, 2004, 26(1): 53-54
[2]Starke JR. Tuberculosis in children. Respir Crit Care Med, 2004 , 25(3) :353-354
[3]National Technic Steering Group of the Epidemiological Sampling Survey for Tuberculosis. Report on fourth national epidemiological sampling survey of tuberculosis. Chin J Tuberc Respir Dis , 2002 , 25( 1):3-7
[4]Lein AD, von Reyn CF, Ravn P, et al. Cellular immune responses to ESAT-6 discriminate between patients with pulmonary disease due to Mycobacterium avium complex and those with pulmonary disease due to Mycobacterium tuberculosis. Clin Diagn Lab Immunol, 1999, 6(4):606-609
[5]Pediatric Chapter of Chinese Medical Association. Clinical diagnostic criteria and therapeutic scheme of pediatric pulmonary tuberculosis. Chin J Pediatr(中华儿科杂志),2006,4(44):249-251
[6]Diel R, Nienhaus A, Lange C,et al. Tuberculosis contact investigation with a new, specific blood test in a low-incidence population containing a high proportion of BCG-vaccinated persons. Respir Res, 2006, 7(1): 77-84
[7]Pai M, Kalantri S, Dheeda K. New tools and emerging technologies for the diagnosis of tuberculosis: part I. Latent tuberculosis. Expert Rev Mol Diagn, 2006, 6(3):413-422
[8]Kumar M, Meenakshi N, Sundaramurthi JC,et al. Immune response to Mycobacterium tuberculosis specific antigen ESAT-6 among south Indians. Tuberculosis (Edinb), 2010 ,90(1):60-69
[9]Iguchi M, Maruyama K, Tsutsumi Y,et al. QuantiFERON: an early diagnostic tool for cerebral tuberculosis. Rinsho Shinkeigaku, 2008, 48(4):259-262
[10]Aiken AM, Hill PC, Fox A,et al. Reversion of the ELISPOT test after treatment in Gambian tuberculosis cases. BMC Infect Dis, 2006, 6:66-71
[11]Brock I, Ruhwald M, Lundgren B,et al.Latent tuberculosis in HIV positive, diagnosed by the M.tuberculosis specific interferon-γ test. Respir Res, 2006, 7(1):56-64
[12]Mardani M, Tabarsi P, Mohammadtaheri Z,et al. Performance of QuantiFERON-TB Gold test compared to tuberculin skin test in detecting latent tuberculosis infection in HIV- positive individuals in Iran. Ann Thorac Med, 2010, 5(1):43-46
[13]Zhang B, Lun WH, Cheng J,et al. Specific T-cell responses to Mycobacterium tuberculosis protein ESAT-6 in Chinese HIV positive individuals. Chin J Exp Clin Virology, 2008, 22(2):124-126
[14]Starke JR. Interferon-g release assays for diagnosis of tuberculosis infection in children. Pediatr Infect Dis J ,2006, 25(10):941-942
[15]Meng CY(孟成艳), Zhang S, Jin JL, et al. Utility of TSPOT-TB for the diagnosis of tuberculosis. J Micro Infect(微生物与感染),2006,1(3):190-192
[16]Le J(乐军), Liang L, Li SH, et al. Clinical application of enzyme-linked immunospot assay for rapid diagnosis of active tuberculosis. Chin J Lab Med(中华检验医学杂志),2006,29(11):1005-1008
[17]Zellweger JP,Zellweger A,Ansermet S, et al.Contact tracing using a new T-cell-based test: better correlation with tuberculosis exposure than the tuberculin skin test. Int J Tuberc Lung Dis, 2005, 9(11):1242-1247
[18]Dewan PK, Grinsdale J, Kawamura LM.Low sensitivity of a whole-blood interferon-gamma release assay for detection of active tuberculosis.Clin Infect Dis, 2007 ,44(1):69-73
[19]马斌荣,陈卉,主编. 医学科研中的统计方法.第3版. 北京,科学出版社,2005,152-155
[20]American Thoracic Society. Diagnostic standards and classification of tuberculosis in adults and children. Am J Res Crit Med J ,2000 , 161 (4) :1376-1395
[21] 江载芳,主编. 实用小儿结核病学.北京:人民卫生出版社,2007
[22]Haimi-Cohen Y, Zeharia A, Mimouni M, et al. Skin indurations in response to tuberculin testing in patients with nontuberculous mycobacterial lymphadenitis. Clin Infect Dis, 2001, 33(10):1786-1788
[23]Casas I, Latorre I, Esteve M,et al. Evaluation of interferon-gamma release assays in the diagnosis of recent tuberculosis infection in health care workers. PLoS One, 2009,4(8):6686
[24]Bahrmand AR, Madani H, Samar G, et al. Detection and identification of non-tuberculous mycobacterial infections in 6,472 tuberculosis suspected patients. Scand J Infect Dis,1996,28(3):275-278
[25]von Reyn CF, Horsburgh CR, Olivier KN, et al. Skin test reactions to Mycobacterium tuberculosis purified protein derivative and Mycobacterium avium sensitin among health care workers and medical students in the United States. Int J Tuberc Lung Dis,2001,5(12):1122-1128
[26]Goletti D, Parracino MP, Butera O, et al. Isoniazid prophylaxis differently modulates T-cell responses to RD1-epitopes in contacts recently exposed to Mycobacterium tuberculosis: a pilot study. Respir Res, 2007, 8(1):5-10

