靶向GLI1基因增强卵巢癌细胞化疗敏感性的实验研究
巩向玲, 宋彩霞, 刘世松, 王 平
近年来,以顺铂为基础的联合化疗使卵巢癌患者的生存时间明显延长,但其5年生存率却无明显提高,主要原因是随着化疗时间的延长,肿瘤细胞逐渐对各种化疗药物尤其是顺铂产生了耐药性。目前有学者认为GLI1的过表达与原发性卵巢癌的发生发展密切相关[1]。近几年RNA干扰成为肿瘤基因治疗研究中极有潜力的应用技术[2]。我们对RNA干扰GLI1基因能否逆转卵巢癌耐药细胞SKOV3/DDP的耐药性进行了探讨,以进一步阐明卵巢癌的耐药机制及提供新的治疗方案。
1 材料和方法
1.1 材料
1.1.1 细胞株和菌株 人卵巢癌耐药细胞株SKOV3/DDP购自广西医科大学附属肿瘤医院,其亲本细胞株SKOV3和大肠杆菌DH5a由四川大学华西医院妇科学教研室保存。
1.1.2 主要试剂及来源 空质粒pSilencer2.1-U6 neo购自Ambion公司,E.Z.N.A无内毒素大提质粒试剂盒购于Omega公司,Reverse Transcriptin System试剂盒购自Promega公司,阳离子脂质体转染试剂盒Lipofectamine 2000购自普利莱公司,Trizol RNA提取试剂盒购自Invitrogen公司,Taq DNA聚合酶、dNTP均购自上海生工公司,兔抗人GLI1一抗、SABC(兔IgG)-POD试剂盒购自武汉博士德生物工程有限公司,RPMI-1640培养基、胎牛血清购于GIBCO 公司,顺铂为齐鲁制药生产的冻干制剂(NO:20081107),MTT(四甲基偶氮唑盐)为Sigma公司产品。
1.2 方法
1.2.1 siRNA的构建 利用Ambion公司在线设计程序,选取GLI1基因cDNA序列起始点280个核苷酸之后的连续19nt作为RNA干扰的特异性序列,并经Blast同源性比较分析。设计为能表达其小发卡结构的RNA(shRNA)的DNA序列,两端加上BamHI、HindⅢ酶切位点。顺义链:5-GATCCGCA CAGTGGAGCGAATTCCTTTCAAGAGA-AGGAATTCGCTCCACTGTGTTTTTTGGAAA-3,反义链:5-AGCTTTTCCAAAAAACACAGTGGA-GCGAATTCCTTCTCTTGAAAGGAATTCGCTCCACTGTGCG-3。
1.2.2 重组质粒pGLI1-shRNA鉴定和纯化 已构建好的两条寡核苷酸链退火形成双链,与质粒pSilencer2.1-U6 neo连接为pGLI1-shRNA转化大肠杆菌DH5a,用含氨苄青霉素的LB平板筛选,挑选阳性克隆并提取质粒,经BamH I、HindⅢ双酶切鉴定,并测序证实插入序列为所设计的发卡序列。按E.Z.N.A无内毒素大提质粒试剂盒的步骤提取并纯化质粒待转染。
1.2.3 细胞培养 SKOV3/DDP、SKOV3细胞于含10%胎牛血清的RPMI-1640培养液中,置于37℃、5%CO2、95%湿度培养箱中培养。SKOV3/DDP细胞于对数生长期时,即细胞密度达80%时,加入顺铂使其终浓度为20 μg·mL-1,作用1 h,更换正常培养液,间歇作用诱导细胞耐药,连续诱导3次。
1.2.4 细胞转染 SKOV3/DDP细胞分3组进行转染:空质粒转染组(转染pSilencer2.1-U6 neo)、非特异性转染组(转染Ambion公司质粒试剂盒所提供的非特异性质粒)和特异性转染组(转染pGLI1-shRNA质粒),对正常对照组细胞不进行任何干预。转染前24 h进行细胞计数,接种于6孔板,每孔2×105个细胞,细胞达90%融合时进行转染,具体转染步骤按lipofectamine 2000说明书进行操作。转染GLI1-siRNA后48 h收集细胞分别进行RT-PCR和免疫细胞化学实验。
1.2.5 RT-PCR检测转染前后SKOV3/DDP细胞中GLI1 mRNA的表达 未转染和转染48 h后的细胞,按Trizol试剂说明书的要求提取细胞总RNA,按Reverse Transcription System说明书采用特异性下游引物法反转录成cDNA。聚合酶链(PCR)反应,GLI1上游引物:5-AACACAGTGGAGCGAATTCCTTT-3;GLI1下游引物:5-GGAAGTCCATCGACATGTTGCT-3,扩增产物长262 bp。以β-actin为内参照,94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min 45 s,循环30次后,72℃延伸10 min,4℃保存。1.5%琼脂糖凝胶电泳,紫外线透射观察仪观测、照相,用Band Scan图像分析软件对结果进行分析,以GLI1与β-actin相对比值比较各组细胞GLI1 mRNA的表达差异。
1.2.6 免疫细胞化学法(ICC)检测转染前后SKOV3/DDP细胞GLI1蛋白的表达变化 未转染及转染48 h后的细胞爬片,4%多聚甲醛室温固定15~30 min,0.01M PBS洗涤5 min/次,共3次;0.2% triton孵育20 min,新鲜配制体积分数为3%的H2O2溶液,室温10~20 min,封闭内源性过氧化物酶,0.01 M PBS洗涤5 min/次,共3次;正常羊血清(1∶20)孵育室温30 min,加兔抗人GLI1一抗(1∶100稀释)4℃反应过夜,0.01 M PBS洗涤5 min/次,共3次;滴加生物素化二抗IgG 37℃反应20 min,PBS洗涤5 min/次,共3次,滴加试剂SABC,7℃反应20 min,PBS洗3次;DAB显色、苏木精复染、脱色、二甲苯透明后中性树胶封片,在显微镜下观察并照相。
1.2.7 MTT(四甲基偶氮唑蓝比色法)检测细胞对顺铂的半数抑制浓度(IC50) 实验分4组:未转染对照组、转染空质粒组、转染非特异性质粒组及转染特异性质粒组。取对数生长的SKOV3/DDP,制成1×105个/mL细胞悬液,接种96孔板,每孔100 μL培养液,约含2×103个细胞,37℃、5% CO2培养过夜;转染组细胞在细胞90%融合时开始转染,转染24 h后设6个加药孔,分别加入不同浓度的DDP(终浓度1.25 μg·mL-1至40 μg·mL-1),药物浓度按两倍比增加,每样本设4个平行孔,对照组不加药物,另设调零孔加RPMI-1640培养液,每孔200 μL。转染72 h后加入20 μL MTT(5 mg·mL-1)37℃孵育4~6 h,弃孔中液体,每孔加DMSO 150 μL,脱色摇床上低速震荡10 min,使结晶充分溶解,在酶标仪上570 nm和630 nm(参照)波长处测定吸光度(A)值,应用DAS软件以Bliss法计算出药物的半数抑制浓度(IC50)。以未经转染的SKOV3/DDP细胞及SKOV3细胞作为阴性对照,进行3次独立实验,取平均值。
1.2.8 流式细胞技术(FCM)检测细胞周期和凋亡
细胞分组:SKOV3/DDP、SKOV3/DDP+顺铂、非特异转染组+顺铂和特异性转染组+顺铂。将SKOV3/DDP细胞接种于6孔板中,转染后48 h后加0.01 mol/L顺铂。24 h后收集细胞,用PBS洗涤2次,再用-20℃预冷的75%乙醇固定18 h,流式细胞仪检测,重复检测3次。
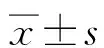
标准差表示,P<0.05判断为有统计学意义。
2 结果
2.1 GLI1-siRNA的鉴定和定量
GLI1-siRNA经BamHⅠ、HindⅢ双酶切,其产物在1.5%琼脂糖凝胶电泳出现两条带,条带的位置与设计相符。质粒的测序结果证明插入片段的序列完全正确。将合成的siRNA稀释后测定260 nm的吸光度值提示合成的siRNA产量在200~380 μg·mL-1之间。
2.2 RNA干扰前后SKOV3/DDP细胞中GLI1基因的转录水平
RT-PCR结果显示,各组细胞在相对于262 bp处均见扩增条带 (见图1)。正常对照组、空质粒转染组与非特异性转染组相比差异无统计学意义(P>0.05),特异性转染组与前3组相比差异有显著性(P<0.01)。与正常对照组相比,特异性转染组细胞GLI1 mRNA的抑制率达45.5%。
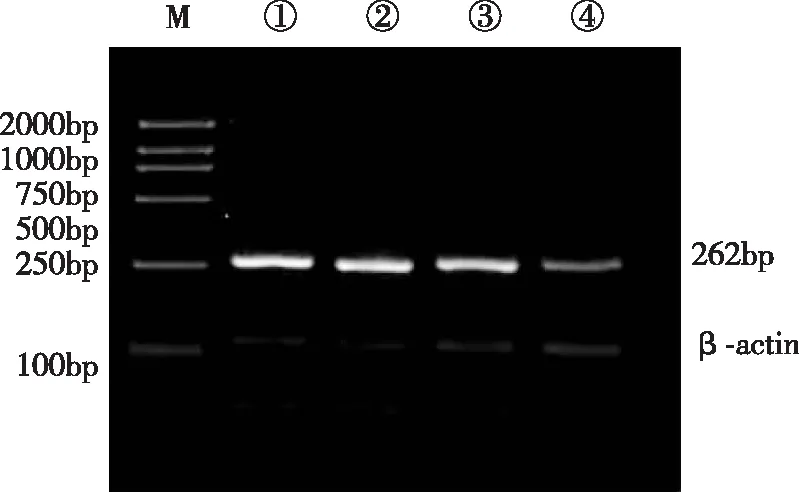
图1 RT-PCR电泳检测各组SKOV3/DDP细胞GLI1 mRNA表达①正常对照组; ②空质粒转染组; ③非特异性转染组; ④特异性转染组
2.3 pGLI1-shRNA 对细胞GLI1蛋白质表达的影响
SKOV3/DDP细胞胞膜和胞核中有GLI1蛋白表达,显微镜下见胞膜和胞核有棕褐色颗粒沉着,利用Image Plus图像分析软件对结果进行分析,特异性转染组细胞GLI1蛋白表达明显比其他2组下降(P<0.01),而空质粒转染组、非特异性转染组与正常对照组相比未见明显减弱(P>0.05,见图2)。
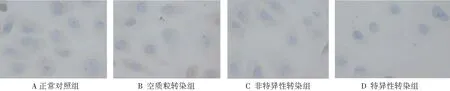
图2 免疫细胞化学检测不同组SKOV3/DDP细胞GLI1蛋白的表达(400×)
2.4 MTT检测各组细胞对顺铂的半数抑制浓度
不同质粒转染入各组细胞,并暴露于顺铂48 h后,各组细胞存活率均随顺铂浓度的增加而降低,其中特异性转染组降低最为显著(见图3)。转染前正常对照组SKOV3/DDP的IC50(16.54±1.23) μg·mL-1,其亲本细胞SKOV3为(6.04±0.11)μg·mL-1,测其耐药指数约为2.8(见表1),与该耐药细胞株所属医院提供的数值相符;pGLI1-shRNA转染后的SKOV3/DDP细胞对顺铂的敏感性提高了约2.5倍,特异性转染组细胞与其他2组相比差异具有显著性(P<0.01),而空质粒转染组、非特异性转染组与正常对照组相比无明显差异 (P>0.05)。
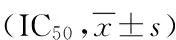
表1 MTT检测各组细胞对顺铂的半数抑制浓度
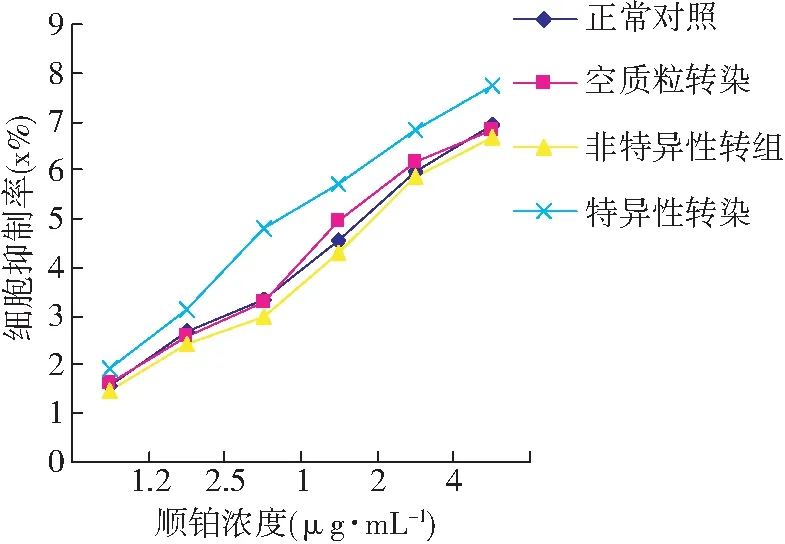
图3 GLI1-siRNA作用下各组细胞对顺铂敏感性的变化
2.5 pGLI1-shRNA对SKOV3/DDP周期和凋亡的影响
各期细胞在总细胞中所占的比例见表2。经顺铂作用后,特异性转染组的细胞凋亡率、G0/G1期细胞比例都明显高于空白对照组、未转染细胞组、非特异转染组(P<0.01),而S期细胞所占比例显著低于后三者(P≤0.001),差异有统计学意义。对照组、未转染细胞组、非特异转染组之间的细胞周期分布及凋亡率差异均没有统计学意义(P>0.05)。
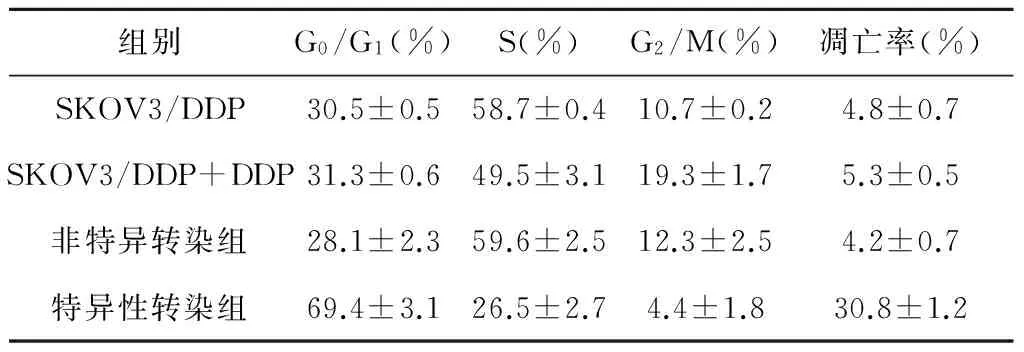
表2 各期细胞在各种细胞总数中所占的比例及凋亡率
3 讨论
卵巢恶性肿瘤是女性生殖系最常见的三大恶性肿瘤之一,恶性程度高,极易发生浸润和远处转移。尽管进行肿瘤细胞减灭术和术后联合化疗等综合治疗在一定程度上延长了晚期卵巢癌患者的生存时间,但其5年生存率也只有20%~30%,死亡率居妇科癌症首位。卵巢癌细胞对化疗药物,尤其是一线化疗药顺铂、紫杉醇等产生多药耐药是导致综合治疗失败的重要原因。而耐药性的产生与肿瘤细胞对凋亡的敏感性降低有关[3]。
近来研究发现,GLI1的过表达与恶性肿瘤的发生、发展及化疗药物耐药密切相关,GLI1作为靶基因可抑制肿瘤生长并增强化疗敏感性。如Mori等[4]发现,GLI1表达与食管癌肿瘤发生和淋巴结转移有关;Tsuda等[5]发现,干扰GLI1基因表达可抑制体外胰腺癌细胞凋亡;Chen等[6]发现,干扰GLI1基因表达可抑制肝癌细胞生长并增强肝癌细胞对5-Fu的化疗敏感性。上述系列研究均为我们将GLI1基因作为基因治疗靶,特异性诱导卵巢癌耐药细胞凋亡,逆转其化疗耐药性提供了有力的理论依据。
本实验选取GLI1基因cDNA 序列起始点280个核苷酸之后的连续19nt作为RNA干扰的特异性序列,设计为能表达其发卡结构的小RNA(shRNA)的DNA序列,两端加上BamHI、HindⅢ酶切位点,两条寡核苷酸链退火形成双链,与线性化质粒pSilencer2.1-U6 neo连接,取名为pGLI1-shRNA。克隆后重新提取质粒pGLI1-shRNA,经BamHⅠ、HindⅢ双酶切后测序,其序列与所设计的特异性序列相符,证明特异性质粒重组成功。
为研究GLI1基因抑制后对卵巢癌凋亡和耐药性的影响,本实验将重组质粒pGLI1-shRNA转染入卵巢癌耐药细胞株SKOV3/DDP。结果发现,GLI1 shRNA转染组细胞GLI1mRNA的表达与其他2组相比明显减弱,GLI1蛋白表达明显下调,同时促进卵巢癌耐药细胞的凋亡,并有效恢复其对顺铂的敏感性。
综上所述,RNA干扰技术有效抑制SKOV3/DDP细胞中GLI1基因的表达,逆转了卵巢癌耐药细胞对化疗药物的耐药性,成为抗肿瘤基因治疗的新方法。
[1] Chan LY, Leung TN, Chan KC,et al. Serial analysis of fetal DNA concentrations in maternal plasma in late pregnancy[J]. Clin Chem, 2003, 49(4):678-679.
[2] Scherr M, Eder M. Gene silencing by small regulatory RNAs in mammalian cells[J]. Cell Cycle, 2007,6(4):444-449.
[3] 陈爱平, 彭芝兰, 王和, 等. Bcl-xl、p53蛋白在上皮性卵巢肿瘤中的表达及其临床意义[J]. 实用癌症杂志, 2000, 15(6): 607-609.
[4] Mori Y, Okumura T, Tsunoda S, et al. Gli-1 expression is associated with lymph node metastasis and tumor progression in esophageal squamous cell carcinoma[J]. Oncology,2006,70(5):378-389.
[5] Chen XL, Cao LQ, She MR, et al. Gli-1 siRNA induced apoptosis in Huh7 cells[J]. World J Gastroenterol,2008,14(4):582-589.
[6] Tsuda N, Ishiyama S, Li Y,et al. Synthetic microRNA designed to target glioma-associated antigen 1 transcription factor inhibits division and induces late apoptosis in pancreatic tumor cells[J]. Clin Cancer Res,2006,12(21):6557-6564.

