慢性乙型肝炎及肝炎肝硬化患者sICAM-1水平临床观察
张艳兰,李 群,周 宁
潍坊医学院传染病学教研室(山东 潍坊 261042)
就我国现有的肝硬化患者分析,绝大部分患者由慢性乙型肝炎(慢性乙肝)发展而来。如何监测慢性乙肝的病变进程,及时发现并纠正肝纤维化状态,减少肝硬化的发生,成为临床所关注的焦点。近年来,可溶性细胞间粘附分子-1(sICAM-1)在肝脏疾病中的作用日益受到重视。本文观察了41例慢性乙肝、肝硬化病人血清中可溶性细胞间粘附分子-1(sICAM-1)水平,以探讨其在慢性乙肝、肝硬化疾病进展过程中的临床意义。
1 材料和方法
1.1 材料
1.1.1 病例来源 本组41例病人为潍坊医学院附属医院及潍坊市人民医院自2009年3月~2009年10月住院病人。
1.1.2 实验试剂 sICAM-1酶联免疫吸附分析药盒购自上海锐聪科技发展有限公司,均按说明书严格操作。HA、PCⅢ、CⅣ试剂由南京建成生物工程研究所提供,均按说明书严格操作。血清ALT、AST及TBIL均由生化自动分析仪检测。
1.2 方法
1.2.1 实验分组 ①观察组:慢性乙肝病人30例(其中轻度12例,中度10例,重度8例),肝炎后肝硬化病人11例。男24例,女17例,年龄18~60(41±10)岁。均符合2000年全国传染病与寄生虫病学术会议修订的诊断标准。②对照组:10例,均为未感染乙肝病毒及无其他肝脏疾病的健康人群。男6例,女4例,年龄15~51(37±10)岁。全部病例均排除高血压病、糖尿病等以及其它炎性疾病。
1.2.2 标本收集及检测方法 抽取新入院病人空腹静脉血3 ml离心 (4℃,3 500 r/min,10 min),置-20℃保存待测。血清sICAM-1检测采用酶联免疫吸附试验(ELISA),按人血清sICAM-1检测试剂盒说明书操作,计算各标本浓度。
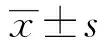
2 结果
慢性乙肝、肝硬化患者及健康对照组血清sICAM-1水平(见表1)。正常对照组血清sICAM-1水平为207.05±38.77 ng/ml,慢性乙肝轻、中、重度患者血清sICAM-1水平分别为428.74±74.35 ng/ml、759.86±57.21 ng/ml、1084.23±41.23 ng/ml,肝硬化患者血清中sICAM-1水平为933.59±55.69 ng/ml,两组观察组患者血清sICAM-1水平显著高于健康对照组人群(P<0.01)。

表1 慢性乙肝、LC患者血清sICAM-1水平
**与对照组比较P<0.01,*P<0.01。
3 讨论
ICAM-1于1991年首次从正常人血清中检出[1,2],研究发现ICAM-1在静息肝星状细胞(HSC)中并不表达或微量表达,并能及时清除,避免其对机体产生生物学损害[3,4]。而在活化的HSC中,ICAM-1基因以及其所表达的产物均有明显增加。通过实验发现在慢性乙肝组及肝硬化组sICAM-1水平均显著高于正常对照组(P<0.01),这与Bruno等的实验结果相符合[5],其中,慢性乙肝组内比较显示,重度>中度>轻度,符合慢性乙型肝炎是由于炎症细胞因子较高表达sICAM-1的结论[6]。当肝功能低下,肝细胞受到损伤时,肝细胞上同样强烈表达ICAM-1,对其清除作用也随之下降[2],便可能引起sICAM-1水平的升高,这也可能是慢性乙肝及肝硬化患者血清中sICAM-1水平升高的原因之一。因此通过检测患者血清中sICAM-1水平,可监测肝脏炎症病变活跃程度,或反映肝纤维化严重程度,对判断治疗效果有一定价值。
正常肝组织受到病毒等侵犯造成炎症损伤时,机体免疫应答开始启动,炎症细胞因子如TNF-α、IL-1等刺激肝窦内皮细胞、受损肝细胞等高水平表达sICAM-1,同时膜型ICAM-1被分解,产生大量sICAM-1与LFA-1结合,并诱导淋巴细胞聚集,但不能正确粘附受损细胞表面,因此在受损肝组织内可见大量炎症细胞浸润。除此之外,sICAM-1能够与细胞毒性T细胞(CTL)相互作用,进而发挥由CTL介导的细胞毒作用。随着肝炎病情的加重,肝内表达sICAM-1的范围也随之扩大,并与转氨酶、胆红素等肝功能指标变化成正相关,说明sICAM-1在一定程度上能够代表肝脏受损程度,反映慢性乙肝的病情进展,sICAM-1的强表达,诱导免疫细胞杀灭靶细胞,但同时损伤了正常肝细胞,从而加快慢性乙肝向重型肝炎或者肝硬化方向进展,
随着肝细胞损伤程度的增加,肝星状细胞开始活化,并大量分泌ECM,沉积在组织间隙,造成肝脏纤维化,同时活化的肝星状细胞也开始高表达sICAM-1基因及其产物[7],加重免疫损伤,与ECM机制共同推进肝纤维化程度加深,逐渐演变为不可扭转的肝硬化。极迟抗原-4(Very late antigen-4,VLA-4)能够诱导炎症细胞的游走和浸润过程,而肝脏炎症浸润时主要的淋巴细胞即为VLA-4+肝T细胞,VLA-4/VCMA-1之间的粘附作用能够帮助这些细胞跨过窦状隙内皮迁徙至实质炎症部位,血小板内皮细胞粘附分子-1(PECAM-1)同样可以帮助淋巴细胞渗出并且趋化到门脉区域,然后侵入周围实质[8],整合而形成整体,也参与细胞之间的黏附。肝纤维化早期,整合素受体的表达能促进ECM在局部的沉积和排列,因而这种黏附分子表达增强的现象不仅是机体对细胞微环境改变的被动适应,而且有可能在启动纤维化本身的过程中起主导作用[9,10]。由于炎症损伤加重,多途径诱导肝硬化患者体内的sICAM-1水平大幅度升高,并同HA、PCⅢ、CⅣ、LN等指标有很好的相关性,而这些指标能够很好的反映患者肝纤维化的程度。这提示,sICAM-1能够间接判断肝硬化患者病情,指导临床诊疗。
综上所述,血清中sICAM-1及TNF-α水平在慢性乙肝及肝硬化患者体内明显升高,且与疾病活动程度呈正相关,这表明该因子对于判断肝脏疾病的活动程度及病情演变有一定的临床指导意义,同时为在细胞因子的微观领域指导慢性肝病的治疗提供了研究依据。
[1] Seth R,Raymond FD,Mkgoba MW,et al.Circulating ICAM-1 isoforms:diagnostic prospects for inflammatory and immune disorders[J].The Lancet, 1991,338:83284.
[2] Rothein R, Mainolfi EA, Czajkowki M, et al. A form of circulating ICAM1 in human serum [J].J Immunol,1991,147:3 788-3 793.
[3] 陆伦根,曾民德,李继强,等.细胞间粘分子-1表达与肝纤维化关系的研究[J].胃肠病学,1998,3(3):144-145.
[4] Helierbrand C,Wang SC,Tsukamoto H, et al. Expression of intercellular adhesion molecule-1 by activated hepatic stellate cells[J].Hepatology,1996,24(3):670-676.
[5] Bruno CM,Sciacca C,Cilio D,et al.Circulating adhesion molecules in patients with virus-related chronic diseases of the liver[J].World J Gastroenterol,2005,11(29):4 566-4 569.
[6] Satoh S, Nussler AK, Liu ZZ,et al.Proinflammatory cytokines and endotoxin stimulate ICAM-1 gene expression and secretion by notmal human hepatocytes[J].J Immunology,1994,82(4):571-576.
[7] Berg T,Johansson SG.Immunoglobulin levels during childhood with special regard to IgE[J].Acta Paediatrica Scandinarica,1969,58:513-524.
[8] 骆抗先.乙型肝炎-基础和临床[M].北京:人民卫生出版社,2001:128.
[9] Van Eyken P,Sciot R,Desmet VJ,et al.Expression of the novel extracellular matrix component tenascin in normal and diseased human liver[J].J Hepatol,1990,11(1):43-52.
[10] 陈显兵.慢性乙型肝炎患者肝脏局部免疫与外周血免疫关系研究[J].湖北民族学院学报(医学版),2008,25(1):22-26.

