2006至2009年复旦大学附属儿科医院呼吸道感染患儿5种常见细菌构成比和耐药性分析
付 盼 何磊燕 王爱敏 薛建昌 宋建明 王传清
化脓性链球菌、肺炎链球菌、金黄色葡萄球菌、流感嗜血杆菌和卡他莫拉菌是儿童呼吸道感染常见的细菌。目前细菌抗生素耐药情况日益严重,耐药菌的出现给临床治疗带来严重挑战。上述5种常见细菌的耐药率呈现地域和人群差异,不同国家或地区的耐药率也有较大差别;不同年代耐药率亦有所不同。本研究收集4年呼吸道标本上述5种细菌连续不间断的药敏实验结果,分析耐药率的变化趋势,为临床合理选择抗生素提供依据。
1 方法
1.1 研究对象 2006年1月至2009年12月在复旦大学附属儿科医院诊断为呼吸道感染的门诊及住院患儿为研究对象,其中上呼吸道取咽部分泌物、下呼吸道取痰标本进行细菌学培养。诊断标准依据参考文献[1]:咽炎诊断主要依据临床表现,如咽痛、咽痒,体检可见咽部充血或白色分泌物,严重可伴发热,可单独起病,也可继发于上呼吸道病毒感染。急性支气管炎可先表现为上呼吸道感染症状,3~4 d后出现咳嗽, X线胸片显示肺部正常。支气管肺炎一般有发热、咳嗽、气促或呼吸困难,肺部可闻及较固定细湿啰音,X线胸片可见片状阴影。需要说明的是,2006年上述5种常见细菌中除金黄色葡萄球菌外的4种细菌分离率和耐药率已经发表[2],本研究再次收录2006年的数据时,对细菌耐药的判别部分有别于文献[2]的标准,即更新了耐药判别标准。
1.2 呼吸道标本采集方法 采用气管插管结合负压吸引方法采集痰液标本,即将无菌吸痰管从鼻腔进入下呼吸道,打开负压吸引器开关收集支气管分泌物。合格痰液标本低倍镜下上皮细胞应≤25个。咽部感染患儿用咽拭子采集咽部充血部位或化脓灶。所有痰液及咽拭子标本接种于哥伦比亚血平板及巧克力平板(上海祥和科学技术有限公司),35℃、5%CO2孵箱培养24~48 h。
1.3 细菌鉴定方法 采用API 鉴定系统及VIETEK60自动分析仪(microsan) 鉴定细菌种类。细菌鉴定参照微生物学检验诊断常规进行。结果判断依据NCCLS/CLSI 2006至2009年版标准,卡他莫拉菌结果判断参照英国BSAC标准。结果分析采用WHONET 5分析系统。
1.4 药物敏感实验 抗菌药物敏感实验采用琼脂扩散法,肺炎链球菌青霉素药物敏感实验采用E-test法。卡他莫拉菌和金黄色葡萄球菌的药物敏感实验采用MH培养基,肺炎链球菌和化脓性链球菌采用MH培养基添加5%脱纤维羊血,流感嗜血杆菌采用HTM培养基。上述培养基均由OXOID公司提供。培养环境均为35℃培养24 h。所有药敏纸片及E-test试剂均为OXOID公司产品。结果判断按NCCLS/CLSI 2006至2009年版标准;卡他莫拉菌结果判断参照英国BSAC标准,氨苄西林:抑菌圈≥33 mm为敏感,<33 mm为耐药;氨苄西林/舒巴坦:抑菌圈≥24 mm为敏感,<24 mm为耐药;环丙沙星:抑菌圈≥21 mm为敏感;红霉素,抑菌圈≥21 mm为敏感。肺炎链球菌青霉素敏感实验判定结果以最小抑菌浓度(MICs)为参考,统一采用2008年 CLIS标准:MICs≤2 mg·L-1为敏感,2~4 mg·L-1为中介,≥8 mg·L-1为耐药。
1.5 药物敏感实验质量控制 质量控制菌株采用金黄色葡萄球菌ATCC25923、流感嗜血杆菌ATCC49766和肺炎链球菌ATCC49619,均由上海市CDC提供。判断标准参考NCCLS/CLSI 2006至2009年版质量控制的部分判断标准。药物敏感实验质量控制每周进行1次。
1.6 β-内酰胺酶(OXD)检测 OXD溶液40 μL与被测菌混匀,室温下变成红色为阳性,不变色(黄色)为阴性。
1.7 统计学方法 计数资料以百分比表示,率的显著性采用χ2检验,采用SPSS 13.0软件进行统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 2006至2009年共分离到细菌3 169株,其中化脓性链球菌、肺炎链球菌、金黄色葡萄球菌、流感嗜血杆菌和卡他莫拉菌分别为1 225株(38.7%)、341株(10.8%)、297株(9.4%)、248株(7.8%)和224株(7.1%)。上呼吸道细菌中,流感嗜血杆菌(χ2=9.06,P=0.029)和卡他莫拉菌(χ2=8.24,P=0.041)构成比有小幅度上升趋势(表1)。下呼吸道细菌中,肺炎链球菌(χ2=39.07,P<0.001)、流感嗜血杆菌(χ2=16.80,P=0.001)和卡他莫拉菌(χ2=37.99,P<0.001)构成比有明显上升趋势(表2)。其他细菌在上下呼吸道细菌中构成比变化不显著(均P>0.05)(表1、2)。
表1 2006至2009年上呼吸道5种细菌构成比[n(%)]
Tab 1 Proportion of 5 pathogens isolated from the upper respiratory tract from 2006 to 2009[n(%)]
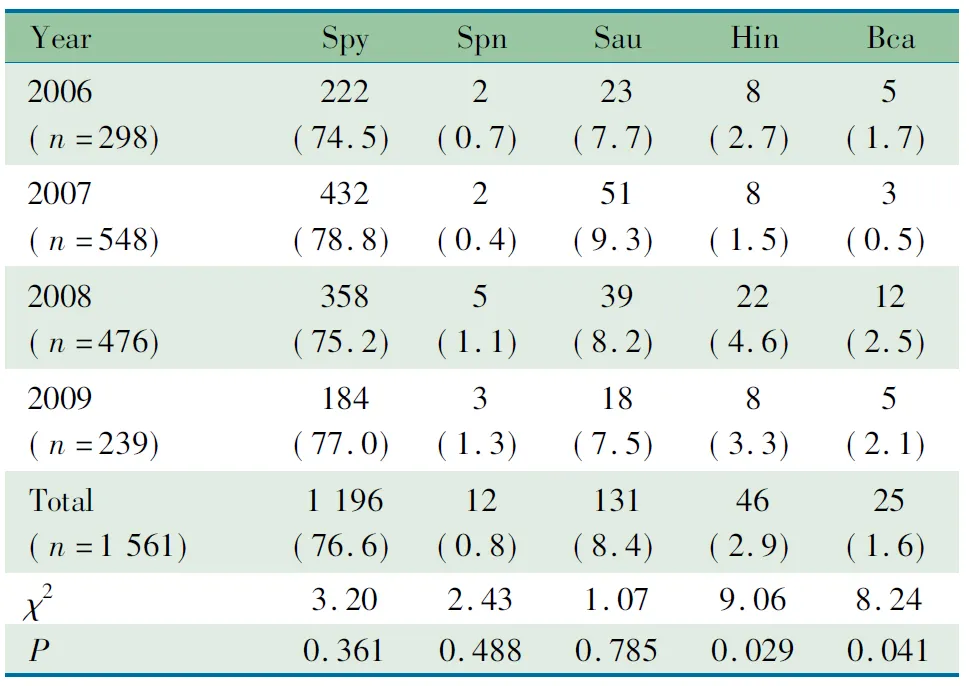
YearSpySpnSauHinBca2006(n=298)222(74.5)2(0.7)23(7.7)8(2.7)5(1.7)2007(n=548)432(78.8)2(0.4)51(9.3)8(1.5)3(0.5)2008(n=476)358(75.2)5(1.1)39(8.2)22(4.6)12(2.5)2009(n=239)184(77.0)3(1.3)18(7.5)8(3.3)5(2.1)Total(n=1561)1196(76.6)12(0.8)131(8.4)46(2.9)25(1.6)χ23.202.431.079.068.24P0.3610.4880.7850.0290.041
Notes Spy:S.pyogenens; Spn:S.pneumoniae; Sau:S.aureus; Hin:H.influenzae; Bca:M.catarrhalis
表2 2006至2009年下呼吸道5种细菌构成比[n(%)]
Tab 2 Proportion of 5 pathogens isolated from the lower respiratory tract from 2006 to 2009[n(%)]

YearSpySpnSauHinBca2006(n=375)3(0.8)71(18.9)39(10.4)39(10.4)32(8.5)2007(n=400)3(0.8)43(10.8)37(9.3)40(10.0)24(6.0)2008(n=179)10(5.6)43(24.0)26(14.5)21(11.7)30(16.8)2009(n=654)13(2.0)172(26.3)64(9.8)102(15.6)113(17.3)Total(n=1608)29(1.8)329(20.5)166(10.3)202(12.6)199(12.4)χ24.0439.074.1416.8037.99P0.2570.0000.2460.0010.000
Notes Spy:S.pyogenens; Spn:S.pneumoniae; Sau:S.aureus; Hin:H.influenzae; Bca:M.catarrhalis
2.2 化脓性链球菌耐药率的变化 2006至2009年化脓性链球菌对克林霉素耐药率分别为85.8%(193/225株)、75.4%(328/435株)、71.5%(263/368株)和68.5%(135/197株),4年间差异有统计学意义(χ2=20.838,P<0.000 1) .对红霉素耐药率分别为88.4%(199/225株)、94.7%(412/435株)、89.7%(330/368株)和86.8%(171/197株),4年间差异有统计学意义(χ2=13.761,P=0.003)。对左氧氟沙星耐药率分别为0.4%(1/225株)、0.2%(1/435株)、0、1.0%(2/197株),4年间差异无统计学意义(χ2=4.297,P=0.231)。未发现青霉素、头孢克洛和万古霉素耐药菌株(图1)。

图1 2006至2009年化脓性链球菌耐药监测结果
Fig 1 The drug resistant rates ofS.pyogenensisolates to antimicrobial agents from 2006 to 2009
2.3 肺炎链球菌耐药率的变化 2006至2009年肺炎链球菌对红霉素耐药率分别为94.5%(69/73株)、91.1%(41/45株)、97.9%(47/48株)和93.7%(164/175株),4年间差异无统计学意义(χ2=2.064,P=0.593)。对克林霉素的耐药率依次为94.5%(69/73株)、95.6%(43/45株)、97.9%(47/48株)和94.3%(165/175株),4年间差异无统计学意义(χ2=1.115,P=0.821)。按2008年以后CLSI标准, 青霉素不敏感肺炎链球菌(PNSP)所占比例分别为1.4%(1/73株)、8.9%(4/45株)、20.8%(10/48株)和12.0%(21/175株),4年间差异有统计学意义(χ2=12.412,P=0.007),其中耐青霉素肺炎链球菌(PRSP)在2008和2009年出现,其比例分别为8.3%(4/48株)和4.6%(8/175株)。2006至2009年青霉素MIC50及MIC90分别为0.5和2 μg·mL-1,1和2 μg·mL-1,1和4 μg·mL-1,1和3 μg·mL-1。肺炎链球菌对万古霉素100%敏感。对左氧氟沙星少量耐药,耐药率分别为0、2.2%(1/45株)、0和0.6%(1/178株),4年间差异无统计学意义(χ2=2.779,P=0.373)(图2)。
2.4 金黄色葡萄球菌耐药率的变化 2006至2009年金黄色葡萄球菌对青霉素耐药率分别为98.4%(61/62株)、93.2%(82/88株)、93.8%(61/65株)和91.5%(75/82株),4年间差异无统计学意义(χ2=3.127,P=0.372)。

图2 2006至2009年肺炎链球菌耐药监测结果
Fig 2 The drug resistant rates ofS.pneumoniaeisolates to antimicrobial agents from 2006 to 2009
对红霉素耐药率分别为54.8%(34/62株)、50.0%(44/88株)、53.8%(35/65株)和54.9%(45/82株),4年间差异无统计学意义(χ2=0.532,P=0.909)。耐甲氧西林金黄色葡萄球菌(MRSA)比例分别为9.7%(6/62株)、11.4%(10/88株)、7.7%(5/65株)和8.5%(7/82株),4年间差异无统计学意义(χ2=0.879,P=0.696)。对克林霉素耐药率分别为29.0%(18/62株)、30.7%(27/88株)、30.8%(20/65株)和25.0%(22/88株),4年间差异无统计学意义(χ2=0.393,P=0.942)。对左氧氟沙星耐药率分别为6.5%(4/62株)、9.1%(8/88株)、9.2%(6/65株)和9.8%(8/82株),4年间差异无统计学意义(χ2=0.546,P=0.909)。未出现对万古霉素和利奈唑胺耐药的菌株(图3)。

图3 2006至2009年金黄色葡萄球菌耐药率监测结果
Fig 3 The drug resistant rates ofS.aureusisolates to antimicrobial agents from 2006 to 2009
2.5 流感嗜血杆菌耐药率的变化 2006至2009年流感嗜血杆菌OXD阳性率分别为17.0%(8/47株)、31.3%(15/48株)、20.9%(9/43株)和17.3%(19/110株),4年间差异无统计学意义(χ2=4.449,P=0.231)。对氨苄西林耐药率分别为17.0%(8/47株)、33.3%(16/48株)、20.9%(9/43株)和13.6%(15/110株),4年间差异有统计学意义(χ2=8.546,P=0.038)。对氯霉素耐药率依次为17.0%(8/47株)、10.4%(5/48株)、11.6%(5/43株)和5.5%(6/110株),4年间差异无统计学意义(χ2=5.321,P=0.147)。对头孢呋辛耐药率较低,仅在2008和2009年检测到耐药菌株,耐药率分别为2.3%(1/43株)和2.7%(3/110)。未发现对阿奇霉素耐药的菌株(图4)。

图4 2006至2009年流感嗜血杆菌耐药率监测结果
Fig 4 The drug resistant rates ofH.influenzaeisolates to antimicrobial agents from 2006 to 2009
2.6 卡他莫拉菌耐药率的变化 2006至2009年卡他莫拉菌耐药率监测结果见图5。

图5 2006至2009年卡他莫拉菌耐药率监测结果
Fig 5 The drug resistant rates ofM.catarrhalisisolates to antimicrobial agents from 2006 to 2009

3 讨论
本研究2006至2009年5种呼吸道常见细菌监测结果表明,化脓性链球菌主要是上呼吸道的细菌,在上呼吸道分离菌的构成比为74.5%~77.0%,构成比变化不显著。而肺炎链球菌、流感嗜血杆菌和卡他莫拉菌是下呼吸道的主要细菌,构成比分别为10.8%~26.3%、10.0%~15.6%和6.0%~24.0%。流感嗜血杆菌和卡他莫拉菌在上下呼吸道细菌中的构成比均呈上升趋势,肺炎链球菌在下呼吸道细菌中的构成比呈上升趋势。金黄色葡萄球菌在上下呼吸道细菌中构成比变化趋势不明显。
对青霉素不过敏者首选青霉素治疗化脓性链球菌感染,目前,国内外均未检测出耐青霉素的临床菌株[3],而作为同一链球菌属的肺炎链球菌,对青霉素的耐药性备受关注。β-内酰胺类抗菌药物,特别是青霉素是治疗肺炎链球菌感染的主要药物,然而随着PNSP的出现和快速传播, 给肺炎链球菌感染的治疗带来困难[4]。本研究显示,2006至2009年PNSP占1.4%~20.8%,呈现明显上升趋势(P=0.007),并在2008和2009年出现PRSP菌株,我院之前曾报道2000至2006年PNSP比例呈现明显上升趋势[2],可见10年来PNSP的比例不断上升,肺炎链球菌对青霉素耐药日益严重。2007年,中国14家医院链球菌属耐药监测结果表明[5],PNSP总体比例为11.8%,均明显高于德国、捷克及大部分北欧国家的水平(耐药率<1%)。可见中国PRSP的比例依然处于较高水平。
链球菌对大环内酯类抗生素的耐药性世界范围内差异较大。Hoenigl等[6]研究表明,肺炎链球菌对红霉素耐药率从1997年3.5%升至2008年的14.7%,本研究分离到的肺炎链球菌和化脓性链球菌对红霉素耐药率分别为91.1%~97.9%和86.8%~94.7%。2007年,中国14家医院链球菌耐药监测结果表明,该2种细菌耐药率高达81.5%~100%和92.7%[7],均明显高于韩国(51%)、日本(70%)、美国(9.6%)、加拿大(14.1%)和意大利(35.8%)等国的监测结果[8~13],提示中国分离的化脓性链球菌对红霉素耐药现状已比较严峻,该现象可能与中国红霉素等大环内酯类抗生素的广泛使用有关。
近年来,肺炎链球菌对红霉素等其他非β-内酰胺类抗生素产生耐药性,甚至对万古霉素耐药也有报道[14],而且对喹诺酮类耐药的肺炎链球菌中国香港监测结果为14.3%,韩国为2.9%,美国为1.8%[15,16]。本研究结果表明,肺炎链球菌及化脓性链球菌对左氧氟沙星的耐药率分别为0~2.2%和0~1.0%,对万古霉素均100%敏感,提示喹诺酮类抗生素和万古霉素可用于治疗链球菌引起的感染。
中国分离到的金黄色葡萄球菌产青霉素酶的比例接近100%,苏州地区2006至2008年1项耐药监测结果表明,金黄色葡萄球菌对青霉素耐药率已达86.4%~97.7%[17], 宁波地区产OXD的金黄色葡萄球菌株数占94.3 %[7],上海地区2001年报道OXD阳性率为95.5 %[18]。2007年,中国14家医院葡萄球菌属耐药监测结果显示[19],金黄色葡萄球菌对青霉素耐药率已达90.9%~100%。本研究金黄色葡萄球菌对青霉素耐药率为91.5%~98.4%,变化趋势不显著(P=0.156),与2001年上海地区报告(95.5%)[18]相比无明显变化,提示中国目前金黄色葡萄球菌对青霉素已高度耐药,青霉素已失去对其治疗作用。
本研究从呼吸道标本中分离到的MRSA比例为7.7%~11.4%,明显低于中国文献报道的儿童和成人总比例(58.3%)[19]。MRSA对红霉素和克林霉素的耐药率分别为50.0%~54.9%和25.0%~36.8%,对喹诺酮类抗菌药物仍保持较高的敏感性,其对左氧氟沙星的耐药率为6.5%~9.8%。万古霉素和利奈唑胺依然是治疗MRSA的首选药物,本研究未检测出对两者耐药的菌株。自1997 年日本报道了首例对万古霉素中度敏感的金黄色葡萄球菌(VISA )后,美国、法国、英国和德国等也陆续发现VISA;对万古霉素耐药的金黄色葡萄球菌(VRSA)于2002 年首次在美国分离到,但中国大陆尚未发现VISA和VRSA[20]。国外有学者认为利奈唑胺可以取代万古霉素治疗儿童金黄色葡萄球菌感染,尤其是对万古霉素不敏感的金黄色葡萄球菌治疗[21,22],然而最近国外已有报道出现利奈唑胺耐药的金黄色葡萄球菌[23],这无疑为治疗带来极大挑战。
1979年报道首例产OXD的卡他莫拉菌,产酶率为3.8%,以后产酶率不断上升[24]。流感嗜血杆菌产OXD率有地区差异,欧洲国家中产OXD率较高的国家有法国(29.1%)和葡萄牙(38.2%),较低的国家有德国(2.0%),意大利(3.3%),荷兰(5.9%),波兰(5.7%),土耳其(5.0%)和西班牙(13.9%)[25]。本研究2006至2009年流感嗜血杆菌和卡他莫拉菌OXD阳性率分别为17.0%~31.3%和83.1%~100%,对氨苄西林耐药率分别为13.6%~33.3%和96.3%~99.2%,与我院之前报道相比变化不大[2],其中流感嗜血杆菌对氨苄西林耐药率有下降趋势(P=0.038)。2007年,中国14家医院资料显示,流感嗜血杆菌OXD阳性率为27.4 %,对氨苄西林耐药率为30.1%[26],与本研究流感嗜血杆菌对氨苄西林耐药率处于同一水平。同期印度、埃及、日本和英国的资料显示耐药率在15.4%~45%[27~30],与本研究监测结果也较为一致。而卡他莫拉菌的OXD阳性率国内外均超过90%[2,30]。
本研究的不足之处和局限性:①未统计4年间呼吸道感染患儿行细菌培养的例数,无法计算分离率;②因是回顾性研究,缺少患儿就诊前是否进行抗菌药物治疗的资料。
[1]薛辛东,主编.儿科学.北京:人民卫生出版社.2005
[2]Wang CQ(王传清),Wang Y, Wang XH, et al. Recovery rates and antimicrobial susceptibility of Haemophilus infiuenzae, Streptococcus pneumoniae, Streptococcus pyogenens and Moraxella catarrhalis collected from children with respiratory tract infection in Children′s Hospital of Fudan University from 2000 to 2006. Chin J Evid Based Pediatr(中国循证儿科杂志), 2007, 2(3):197-204
[3]Rowe RA, Stephenson RM, East DL, et al.Mechanisms of resistance for Streptococcus pyogenes in northern Utah.Clin Lab Sci, 2009,22(1):39-44
[4]Chawla K, Gurung B, Mukhopadhyay C, et al,Reporting Emerging Resistance of Streptococcus pneumoniae from India.J Glob Infect Dis,2010, 2(1):10-14
[5]Wang CQ(王传清), Xue JC, Zhang H, et al. Distribution and antibiotic resistance of Streptococcus spp.: Results of National CHINET Program 2007. Chin J Infect Chemother(中国感染与化疗杂志), 2009, 9(3):180-184
[6]Hoenigl M, Fussi P, Feierl G, et al.Antimicrobial resistance of Streptococcus pneumoniae in Southeast Austria, 1997-2008.Int J Antimicrob Agents, 2010,36(1):24-27
[7]Huang MH(黄明海), Chen QY. Oxacillin resistance in 175 clinical staphylococcus aureus strains. Chinese Journal of Nosocomiology(中华医院感染学杂志), 2009,19(8):982-983
[8]Kim SJ, Lee NY. Epidemiology and antibiotic resistance of group A streptococci isolated from healthy schoolchildren in Korea.J Antimicrob Chemother, 2004, 54(2):447-450
[9]Maruyama S, Yoshioka H, Fujita K, et al. Sensitivity of group A streptococci to antibiotics: prevalence of resistance to erythromycin in Japan. Am J Dis Child, 1979, 133(11):1143-1145
[10]Ho PL, Johnson DR, Yue AW, et al. Epidemiologic analysis of invasive and noninvasive group A streptococcal isolates in Hong Kong. J Clin Microbiol, 2003, 41(3):937-942
[11]Green M, Martin JM, Barbadora KA, et al. Reemergence of macrolide resistance in pharyngeal isolates of group A streptococci in southwestern Pennsylvania. Antimicrob Agents Chemother, 2004, 48(2):473-476
[12]Katz KC, McGeer AJ, Duncan CL, et al. Emergence of macrolide resistance in throat culture isolates of group A streptococci in Ontario, Canada, in 2001. Antimicrob Agents Chemother, 2003, 47(7):2370-2372
[13]Dicuonzo G, Fiscarelli E, Gherardi G, et al. Erythromycin resistant pharyngeal isolates of Streptococcus pyogenes recovered in Italy. Antimicrob Agents Chemother, 2002, 46(12):3987-3990
[14]Jacobs MR, Felmingham D, Appelbaum PC, et al.The Alexander Project 1998-2000: susceptibility of pathogens isolated from community-acquired respiratory tract infection tocommonly used antimicrobial agents.J Antimicrob Chemother, 2003,52(2):229-246
[15]Canton R, Morosini M, Enright MC, et al. Worldwide incidence, molecular epidemiology and mutations implicated in fluoroquinolone-resistant Streptococcus pneumoniae: data from the global PROTEKT surveillance programme. J Antimicrob Chemother, 2003, 52(6):944-952
[16]Garcia-Rey C, Louie A, Deziel M, et al. Antibiotic consumption and generation of resistance in Streptococcus pneumoniae: the paradoxical impact of quinolones in a complex selective landscape. Clin Microbiol Infect, 2006, 12:55-66
[17]吴军华, 季伟, 吕勤. 连续三年金黄色葡萄球菌急性呼吸道感染儿童的分布及耐药. 第六届江浙沪儿科学术会议暨儿科学基础与临床研究进展学术班论文汇编
[18]Lai AD(赖爱娣), Cheng YZ. 新生儿败血症132 例葡萄球菌β-内酰胺酶检测与耐药分析. Shanghai Journal of Medical Laboratory Sciences(上海医学检验杂志),2001, 16 (5):313
[19]Zhu DM(朱德妹), Hu FP, Wang F, et al. CHINET 2007 surveillance of antibiotic resistance in Staphylococcus isolates in China. Chin J Infect Chemother(中国感染与化疗杂志),2009,9(3):168-174
[20]De Azavedo JCS, Yeung RH, Bast DJ, Duncan CL, Norgia SB,Low DE. Prevalence and mechanisms of macrolide resistance in clinical isolates of group A streptococci from Ontario, Canada. Antimicrob Agents Chemother, 1999, 43(9):2144-2147
[21]Kaplan SL, Patterson L, Edwards KM, et al. Linezolid for the treatment of communityacquired pneumonia in hospitalized children. Pediatr Infect Dis J, 2001, 20(5):488-494
[22]Munoz P, Rodríguez-Creixéms M, Moreno M, et al.Linezolid therapy for infective endocarditis.Clin Microbiol Infect, 2007,13(2):211-215
[23]Sánchez García M, De la Torre MA, Morales G,et al. Clinical outbreak of linezolid-resistant Staphylococcus aureus in an intensive care unit. JAMA, 2010, 303(22): 2260-2264
[24]Malmvall BE, Brorsson JE, Johnsson J. In vitro sensitivity to penicillin V and beta-lactamase production of Branhamella catarrhalis. J Antimicrob Chemother, 1977, 3(4): 374-375
[25]Fluit AC, Florijn A, Verhoef J, et al. Susceptibility of European beta-lactamase-positive and -negative Haemophilus influenzae isolates from the periods 1997/1998 and 2002/3. J Antimicrob Chemother, 2000, 45(2): 191-203
[26]Zhang H(张泓), Li WH, Wang CQ, et al. 2007中国国内14家医院流感嗜血杆菌耐药性监测. Chin J Infect Chemother(中国感染与化疗杂志), 2009, 9(3):207-209
[27]Jain A,Kumar P,Agarwal SK,et al.High nasopharyngeal carriage of β-lactamase-negative ampicillin-resistant Haemo-philus influenzae in north Indian school-going children.J infect Chemother, 2008, 14(1):72-74
[28]Afifi S,Wasfy MO,Azab MA,et al.Labory-based surveillance of patients with bacterial meningitis in Egypt(1998-2004). Eur J Clin Microbiol Infect Dis, 2007, 26(5):331-340
[29]Hasegawa K,Kobayashi R,Takada E,et al.High prevalence of type β-lactamase non-producing ampicillin-resisitant Haemo-philus influenzae in meningitis :the situation in Japan where Hib vaccine has not been introduced. J Antimicrob Chemother, 2006, 57(6):1077-1082
[30]Morrissey I, Maher K, Williams L, et al.Non-susceptibility trends among Haemophilus influenzae and Moraxella catarrhalis from community-acquired respiratory tract infections in the UK and Ireland, 1999-2007.J Antimicrob Chemother, 2008,62(S2):97-103

