STUB1基因 RNA干扰慢病毒载体的构建与鉴定
赵 虹,张惊宇,徐万海,杨子超,赵庆杰
STUB1基因 RNA干扰慢病毒载体的构建与鉴定
赵 虹1,2,张惊宇1,徐万海3,杨子超1,赵庆杰2
(哈尔滨医科大学 1.附属第四医院神经内科、2.附属第一医院神经内科、3.附属第四医院泌尿外科,黑龙江哈尔滨 150001)
目的:构建人 STUB1基因 RNA干扰 (RNA interference,RNAi)慢病毒表达载体并进行鉴定。方法:针对筛选确定的人 STUB1基因 RNAi有效靶点序列,合成靶序列的Oligo DNA,退火形成双链 DNA,与经 Age I和 EcoR I酶切后的 pMagic 4.0载体连接,产生短发卡 RNA慢病毒载体。PCR筛选阳性克隆,测序鉴定,并包装成慢病毒颗粒。结果:PCR鉴定与 DNA测序证实,合成的含STUB1 shRNA慢病毒载体寡核苷酸链插入正确。STUB1 shRNA慢病毒载体在 293T细胞中成功包装成慢病毒颗粒。结论:成功构建人 STUB1基因 RNA i慢病毒载体以及包装成功慢病毒颗粒,为研究 STUB1在胶质瘤发生发展过程中相关信号通路的作用,提供了稳定感染细胞的载体。
慢病毒属 /遗传学;遗传载体;RNA干扰;神经胶质瘤;聚合酶链反应;慢病毒载体;STUB1;RNAi
[J Zhejiang Univ(Medical Sci),2010,39(6):623-627.]
CHIP(carboxy terminusof Hsc70 interacting protein)是 1999年被 Ballinger等从心脏 cDNA文库中发现的新蛋白,由 STUB1(STIP homologous and U box containing protein 1)基因编码,定位于人 16p13.3,编码的 CHIP蛋白质分子量为 34.5 kDa。该蛋白 N端存在 3个TPR(tetratricopepdide repeat)结构,C端有 1个U-Box结构,具有 E3泛素连接酶的功能。CH IP在人体内主要表达在代谢活动旺盛、蛋白质容易发生错误折叠的区域,在肌肉、心脏、脑等器官 CHIP表达较高,而胰腺、肝脏、肾脏等器官则表达较低。目前已经证明,CH IP在多种生理和病理过程中发挥重要作用,可参与多个信号传导通路的调节,对其机理及调控方式的研究,将有助于进一步阐明其在疾病预防和治疗中的意义。
RNAi(RNA interference)是 21~23个核苷酸的小分子干扰 RNA(small interferingRNA,siRNA)诱导细胞同源基因 mRNA降解,从而特异性抑制基因表达的过程,其作为一项可以高效、特异地降解靶基因 mRNA的实验技术,已被广泛应用于基因功能的研究[2]。慢病毒载体来源于人类免疫缺陷病毒Ⅰ型 (humanimmunodeficiency virusⅠ,HIV-Ⅰ),既能感染分裂活跃的细胞,又能高效率感染分裂缓慢或分裂期的细胞。因此,本研究通过构建 STUB1基因的小发夹 RNA(short hairpin RNA,shRNA)慢病毒载体并进行包装鉴定,为研究 STUB1沉默后对胶质瘤等神经系统疾病的影响提供稳定的感染细胞载体。
1 材料和方法
1.1 材料 混合包装载体质粒、pMagic 4.0慢病毒载体、293T细胞株购于上海生博公司;大肠杆菌 DH-5α为本实验室保存;限制性内切酶Age I EcoR I、T4 DNA连接酶、PrimeSTARTM HS DNA多聚酶,均购自 New England Biolabs(NEB)公司;1 kb Ladder购自上海新百诺公司;胶回收试剂盒、质粒抽提试剂盒购自Qiagen公司。
1.2 方法
1.2.1 载体的构建和鉴定 pMagic 4.0为RNA干扰慢病毒专用载体。针对人类 STUB1基因 mRNA序列 (NCB I GenBank,基因编号:NM_005861),利用 GenScrip t公司网站上提供的“siRNA Target Finder Tool”设计软件 ,设计靶向 STUB1基因 siRNA寡核苷酸,序列为 5′-GAAGAGGAAGAAGCGAGACAT-3′,并 构 建 到shRNA的发夹结构中,序列为 5′-CcggGAAG AGGAAGAAGCGAGACATCTCGAGATGTCTCGC TTCTTCCTCTTCTTTTTg-3′;5′-aattcaaaaaGAAG AGGAAGAAGCGAGACATCTCGAGATGTCTCGC TTCTTCCTCTTC-3′。将以上两合成片段 5′端磷酸化,互补片段退火,与经 Age I和 EcoR I双酶切的 pMagic4.0片段进行连接反应。用氯化钙制备新鲜的大肠杆菌感受态细胞,然后用一步法转化 DH5α菌,挑选阳性克隆,用 PCR的方法进行鉴定,鉴定正确的克隆送测序证实。
1.2.2 慢病毒的包装与感染 将测序正确的pMagic 4.0-STUB1 shRNA载体进行大量抽提,与慢病毒包装质粒混合后按照操作说明书进行共转染,48 h以后收集慢病毒上清液体,并进行胶质瘤 U251细胞的感染。MOI=10的条件下感染效率在 90%以上,证明病毒包装成功。
2 结 果
2.1 鉴定与测序结果 阳性克隆的 PCR鉴定STUB1基因的 shRNA寡核苷酸序列,经退火形成双链 DNA,与经 Age I和 EcoR I双酶切后的pMagic 4.0载体连接,连接产物转化大肠杆菌感受态细胞 DH5α,挑选重组阳性克隆进行PCR鉴定和测序。STUB1基因干扰的重组细菌克隆 PCR产物 343 bp(插入片断为 37 bp),经双酶切后没有插入片断的 pMagic 4.0载体PCR产物 306 bp为对照,鉴定结果和预期一致(图 1)。测序结果表明,合成的 STUB1-shRNA核苷酸序列插入正确,中间为产生针对靶基因的 shRNA寡核苷酸 (图 2)。
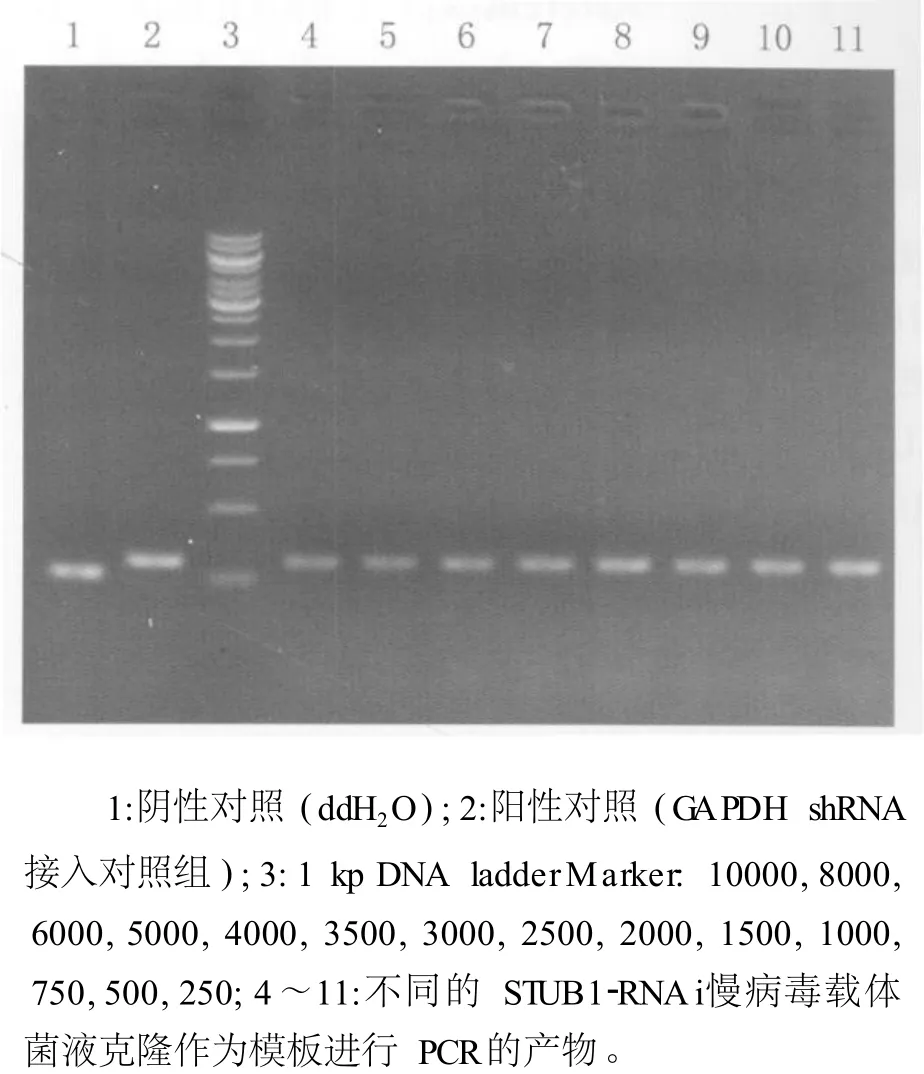
图1 阳性克隆 PCR鉴定Fig.1 STUB1-shRNA was identified by PCR
2.2 包装结果 将测序正确的 pMagic 4.0-STUB1 shRNA载体与慢病毒包装质粒共转染构建病毒,进行胶质瘤 U251细胞的感染。MOI=10的条件下感染效率在 90%以上,证明病毒包装成功 (图 3)。
3 讨 论
CHIP是 E3泛素连接酶家族中重要分子,与分子伴侣 Hsc70、Hsp90等发生协同作用,通过调节重要蛋白的泛素化与降解,参与到细胞蛋白的质量控制。近年来最新的研究表明,CHIP在凋亡相关通路、TGF-beta相关通路及调节 Runx转录因子家族在生理过程中发挥着重要作用,CHIP正在成为一个新的研究热点[3-5]。Kajiro等发现:CH IP表达水平与乳腺癌组织的恶性程度呈负向相关。在裸鼠荷瘤模型中,过表达 CH IP能显著抑制肿瘤的生长和转移,而利用 RNAi技术敲除 CH IP后,肿瘤细胞增殖加快,转移也增加。这些结果暗示着 CHIP可能在癌症发生的过程中发挥重要的调节作用。

图2 STUB1-shRNA的测序结果Fig.2 Sequencing result of STUB1-shRNA

图3 STUB1-shRNA的慢病毒颗粒感染 U251细胞Fig.3 Transfection efficiency was counted in U251 cells transfected by lentiviral vector of STUB1-shRNA(Fluorescencemicroscope,×40)
RNA i技术作为一项新的基因沉默技术,具有较强的序列特异性,在恶性肿瘤的研究中具有很好的应用前景[7]。本实验采用基于慢病毒载体介导的 shRNA方法,由 U6启动子控制转录,随后再连上 5~6个 T,作为 RNA聚合酶Ⅲ的转录终止子的结构达到 RNAi的目的[8]。慢病毒介导的 shRNA可以作为干扰工具引起特异性地降解相同序列的 mRNA,从而阻断相应基因表达[9-10]。慢病毒载体是在 HIV-Ⅰ病毒基础上改造成的病毒载体系统,能高效地将目的基因 (或 RNA i)导入动物和人的原代细胞或细胞系。慢病毒介导的基因表达或 RNAi干扰作用持续且稳定,目的基因可整合到宿主细胞基因组中,随细胞基因组的分裂而分裂,能有效感染并整合到非分裂细胞中。与其他病毒载体,如不整合的腺病毒载体、整合率低的腺相关病毒载体、只整合分裂细胞的传统逆转录病毒载体相比,慢病毒可将目的基因整合至靶细胞基因组长期表达,同时扩大了载体感染细胞的范围,适于体内基因治疗。将其作为 siRNA的携带者,不但具备特异性地使基因表达沉默的能力,还可以充分发挥病毒载体自身所具备的优势,为研究基因功能提供了更强有力的工具[11-14]。
在本研究中,我们成功构建了 STUB1的RNAi慢病毒载体,并包装成为慢病毒颗粒,可以很有效地感染胶质瘤细胞系。这为更深入地研究 STUB1沉默后对其在胶质瘤相关信号通路中的作用奠定了基础。另外,将 RNA干扰技术和慢病毒技术完整结合后,应用于筛选和验证脑胶质瘤其他靶标基因中,为快速、准确获得脑胶质瘤增殖侵袭的基因靶标和明确信号通路的功能作用提供了工具。
[1] BALL INGER C A,CONNELL P,WU Y,et al. Identification of CHIP,a novel tetratricopep tide repeat-containing protein that interacts with heat shock proteins and negatively regulates chaperone functions[J].M ol Cell Biol,1999,19(6):4535-4545.
[2] ARZIMAN Z,HORN T,BOUTROS M.E-RNAi:a web application to design op timized RNA i constructs[J].Nucleic Acids Res,2005;33:W582-W588.
[3] L I L,XIN H,XU X,et al.CHIP mediates degradation of Smad proteins and potentially regulates Smad-induced transcription[J].M ol Cell Biol,2004,24(2):856-64.
[4] L I R F,SHANG Y,L IU D,et al.Differential ubiquitination of Smad1 mediated by CHIP:implications in the regulation of the bone morphogenetic protein signaling pathway[J].J M ol Biol,2007,374(3):777-790.
[5] XIN H,XU X,L I L,et al.CHIP controls the sensitivity of transforming growth factor-beta signaling by modulating the basal level of Smad3 through ubiquitin-mediated degradation[J].J Biol Chem,2005,280(21):20842-20850.
[6] PUSHPARAJ PN,AARTHIJ J,MANIKANDAN J,et al.siRNA,miRNA,and shRNA:in vivo applications[J].JDent Res,2008,87:992-1003.
[7] NOGUCHIK,ISHITU Y,KUROSAKIN M,et al.Expression of shRNA using intro sp licing[J].Nucleic Acids Symposium Ser ies,2007,51:490-410.
[8] L IX,HUANGM,ZHENG H,et al.CHIP p romotes Runx2 degradation and negatively regulates osteoblast differentiation[J].J Cell Biol,2008,181(6):959-972.
[9] HEROLD M J,van den BRANDT J,SEIBLER J,et al.Inducible and reversible gene silencing by stable integration of an shRNA-encoding lentivirus in transgenic rats[J].Proc Natl Acad Sci U S A,2008,105:18507-18512.
[10] DINGX,GOLDBERGM S.Regulation of LRRK2 stability by the E3 ubiquitin ligase CHIP[J].PL oSOne,2009,4(6):e5949.
[11] NESCHADIM A,MCCART J A,KEATING A,et al.A roadmap to safe,efficient,and stable lentivirusmediated gene therapy with hematopoietic cell transp lantation [J].Biol Blood M arrow Transplant,2007,13:1407-1416.
[12] L IF,XIE P,FAN Y,et al.C terminus of Hsc70-interacting protein p romotes smooth muscle cell p roliferation and survival through ubiquitin-mediated degradation of FoxO1 [J].J Biol Chem,2009,284(30):20090-20098.
[13] LAKSHMANAN M,BUGHAN I U,DURA ISAM Y S,et al.Molecular targeting of E3 ligases-a therapeutic approach for cancer[J].Exper t Op in Ther Targets,2008,12(7):855-870.
[14] SHA Y,PANDITL,ZENG S,et al.A critical role for CH IP in the aggresome pathway[J].M ol Cell Biol,2009,29(1):116-128.
Construction and identif ication of len tiv iral vector for RNA in terference targeting STUB1 gene
ZHAO Hong1,2,ZHANG Jing-yu1,XU Wan-hai3,YANG Zi-chao1,ZHAO Qing-jie2
(1.Department of Neurology,The Fourth Affiliated Hospital;2.Department of Neurology,The First Affiliated Hospital;3.Department of Urology,The Fourth Affiliated Hospital,Harbin M edical University,Harbin 150001,China)
Objective:To construct and identification of a lentiviral vector for RNA interference(RNA i)targeting STUB1 gene.M ethod s:A pair of comp lementary small hairp in RNA (shRNA)oligonucleotides targeting STUB1 gene was designed,synthesized and inserted into linearized pMagic 4.0 vector.The recombinantplasmid was identified by double restriction digestion with Age I/EcoR Iand DNA sequencing.Results:PCR and DNA sequencing showed that the shRNA sequence was successfully inserted into pMagic 4.0 vector.The pMagic 4.0 vector was successfully packaged into lentivirus particles.Conclusion:A lentiviral shRNA expression vector and particles targeting STUB1 gene hasbeen successfully constructed for the further study of the STUB1 gene.
book=39,ebook=65
Lentivirus/genet;Genetic vectors;RNA interference;Glioma;Polymerase chain reaction;Lentiviral vector;STUB1;RNA interference
R 739.4
A
1008-9292(2010)06-0623-05
http:∥www.journals.zju.edu.cn/med DO I:10.3785/j.issn.1008-9292.2010.06.012
2010-05-04
2010-08-25
黑龙江省自然科学基金面上资助项目 (D200980)
赵 虹 (1966-),女,博士,副主任医师,研究方向:脑血管病、癫痫.
张惊宇 (1979-),女,博士,副主任医师,研究方向:脑血管病;E-mail:yang.dh@163.com
[责任编辑 张荣连 ]
