围术期肿瘤患者红细胞免疫功能的变化
兰培丽
RBC免疫功能的研究自 siegel[1]以来又进入了一个新时代。其对机体的防御作用、自身稳定、免疫监视都有着重要作用[2]。国内外学者对红细胞免疫做了深入大量的研究,目前已进展到分子和基因水平[3];建立了测定RBC免疫功能的实验方法,本测定拟采用郭氏方法[4]以 RBC-C3bRR及 RBCICR为指标测定肿瘤患者围手术期RBC免疫功能(EIF)的变化,进一步揭示RBC在抗肿瘤的作用及其不同阶段变化趋势对预后的影响。
1 材料与方法
1.1 临床资料 选取 40例肿瘤切除术患者(良性 16例,恶性 24例)。其诊断标准均符合肿瘤诊断标准,排除并存其他肿瘤的患者,年龄在 37~71岁间,体重在 43~73 kg间,ASA分级Ⅰ-Ⅲ级。其中乳癌 10例,直肠癌 6例、甲状腺癌 2例、胃癌 6例、甲状腺癌 8例、乳房良性 8例,以上患者均无免疫、血液疾病史。除良性包块局麻或颈丛麻醉外,其他全部采用气管内全身麻醉方法。
1.2 实验方法 所有患者入室后立即采集外周静脉血,再分别采集患者术中、术后第 5天的外周静脉血,肝素抗凝后待检。
1.3 RBC免疫功能的测定 采用郭峰设计的酵母菌RBC免疫花环法以酵母菌冻干试剂(上海第二军医大学长海医院血液免疫研究所提供)测定红细胞 C3b受体花环率(RBCC3bRR)红细胞免疫复合物花环率(RBC-ICR)。
1.4 统计方法 采用 spss11.5软件进行统计分析。计量资料以均数加减标准差(±s)表示,同一患者不同时点比较采用自身配对t检验,单因素方差分析,两组间比较采用t检验。P<0.05为有统计学差异。
2 结果
各组术前、术中、术后第五天的 RBC免疫复合物功能指标见表1。
2.1 术前 除 2例乳房包块(乳腺腺叶增生)RBC免疫黏附活性稍有降低,无统计学差异(P>0.05)外,其余各组患者红细胞免疫指标均有不同程度下降,即 RBC-C 3bRR%下降而RBC-ICR%升高,尤以恶性肿瘤最显著((P<0.01))提示:肿瘤患者EIF受到抑制。
2.2 术中各组患者 RBC免疫活性与术前比较无显著性差异(P>0.05)
2.3 术后第 5天各组患者 RBC免疫指标如下:提示:在解除肿瘤刺激后,各组患者EIF均有不同程度恢复,其中良性组恢复最快,最早,预后最好;而程度愈恶如血行转移比局部淋巴转移和种植转移患者的 EIF更为低下,恢复愈慢,预后不良。
表1 不同类型肿痛患者在不同时期的RBC免疫指标(±s,%)
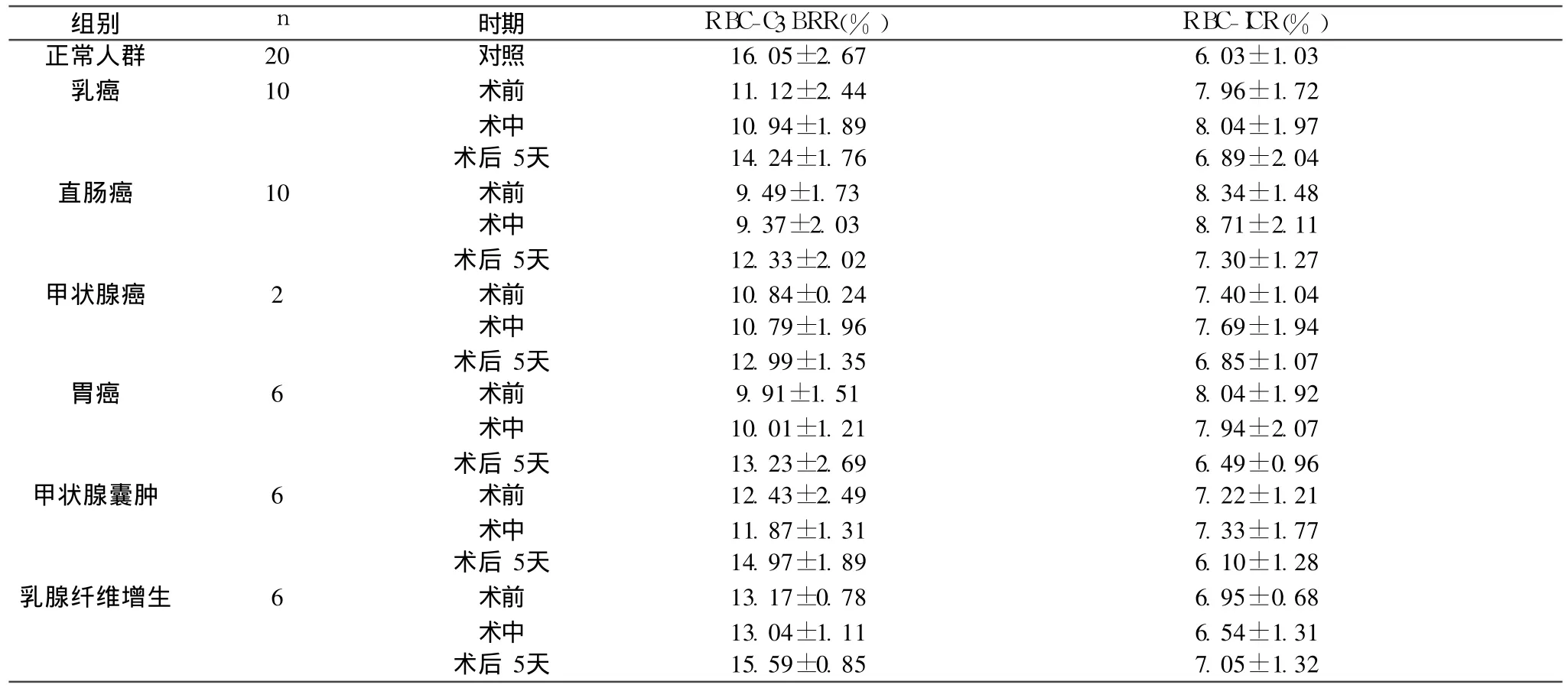
表1 不同类型肿痛患者在不同时期的RBC免疫指标(±s,%)
组别 n 时期 RBC-C3BRR(%) RBC-ICR(%)正常人群 20 对照 16.05±2.67 6.03±1.03乳癌 10 术前 11.12±2.44 7.96±1.72术中 10.94±1.89 8.04±1.97术后 5天 14.24±1.76 6.89±2.04直肠癌 10 术前 9.49±1.73 8.34±1.48术中 9.37±2.03 8.71±2.11术后 5天 12.33±2.02 7.30±1.27甲状腺癌 2 术前 10.84±0.24 7.40±1.04术中 10.79±1.96 7.69±1.94术后 5天 12.99±1.35 6.85±1.07胃癌 6 术前 9.91±1.51 8.04±1.92术中 10.01±1.21 7.94±2.07术后 5天 13.23±2.69 6.49±0.96甲状腺囊肿 6 术前 12.43±2.49 7.22±1.21术中 11.87±1.31 7.33±1.77术后 5天 14.97±1.89 6.10±1.28乳腺纤维增生 6 术前 13.17±0.78 6.95±0.68术中 13.04±1.11 6.54±1.31术后 5天 15.59±0.85 7.05±1.32
3 讨论
RBC免疫在维持机体内环境的平衡及生物功能的稳定方面发挥着重要作用,越来越多的实验表明它不仅有很强的清除循环免疫复合物、杀灭病原体的功能,还能增强 T、B淋巴细胞及 NK细胞的功能,是机体免疫功能的重要组成部分[5]。肿瘤的发生,发展与机体免疫反应的异常密切相关。而RBC参与机体的多种免疫反应,特别是天然免疫。红细胞免疫参与肿瘤的发生、发展过程。目前对红细胞参与抗肿瘤机制及其意义愈来受到人们重视[6]。
本实验采用酵母菌花环法测定不同肿瘤患者围术期 EIF的变化。结果发现:EIF在肿瘤患者均有不同程度降低;除 2例乳房良性增生早期体检发现的 RBC-C3bRR%下降(P>0.05)RBC-ICR%上升无统计学差异 (P>0.05)外,其余各组均有不同程度下降(P<0.05或 P<0.01)。提示:肿瘤患者红细胞免疫功能全面紊乱与低下。可能的机制为:肿瘤患者血清中存在着肿瘤生长促进因子,即封闭因子;该因子为肿瘤抗原与抗体形成的免疫复合物(IC),IC增高破坏了宿主抗肿瘤免疫功能,造成肿瘤细胞逃逸宿主免疫系统的攻击而得以生长繁殖。郭峰等学者的研究表明:肿瘤患者的RBC免疫抑制因子含量增多,抑制RBC-CR 1活性。恶性肿瘤或晚期患者RBC-C3bRR%降低而RBC-ICR%上升明显,可能为癌细胞分泌或体内大量的肿瘤细胞释放过多的抗原有关,RBC上的CR1被大量IC占用,不能达到防止癌细胞在血液循环中的扩散[7]。本组实验术后第 5天各组肿瘤患者在解除了肿瘤细胞对机体的刺激后,RBC免疫功能均有不同程度变化:良性者及早期恶性者恢复较快,晚恶者变化不明显。提示了 RBC免疫功能测定在判断患者的预后方面的应用价值到一定的作用。其可能的机制为:随着肿瘤的发生,发展,瘤细胞数目增多,分泌免疫抑制物质也随之增多,RBC免疫功能受抑制最为严重。当肿瘤经手术切除,瘤细胞释放免疫抑制因子得到控制,RBC免疫功能虽不能恢复到正常,但会明显上升。晚恶者因癌细胞的转移与繁殖扩散加快,加之肿瘤患者往往伴有的贫血和全身抵抗力的低下,使 EIF恢复较慢甚至更为低下。本实验进一步证实了 RBC在天然免疫方面及在抗肿瘤免疫反应中的作用,对肿瘤患者EIF测定可以判断病情转归,手术疗效及指导放化疗,免疫治疗方案方面提供证据。
[1] SiegelI,Liu TL,Gleicher N.The redcell immune system.Lancet,1981,2:556-559.
[2] 郭峰,张乐之,王海宾.红细胞在免疫治疗中的重要应用价值.中国肿瘤生物治疗杂志,2000,7:1-2.
[3] Bate C,et al.Immunology,1994,83(2):256-261.
[4] 郭峰.红细胞免疫概况研究.中华微生物学和免疫学杂志,1995;15(3)181.
[5] 郭峰,钱宝华,张乐之.现代红细胞免疫学.上海:第二军医大学出版社,2002.
[6] Shau H,Golub SH.Identification of a natural Killer enhancing factor(NKEF)from human erythroid cell.Cell Immunol,1993,147(1):1.
[7] 郭峰,卢培恩,许育,等.新鲜血细胞对癌细胞的天然免疫反应.解放军医学杂志,2001,26(17):826.

