拘束冷应激对大鼠肾脏热休克蛋白表达和血清皮质醇含量的动态影响
吴步猛,林飞燕,赵惠玲,黄卡特,林婷婷,包晶莹,吴军,方舟溪,陈国荣
(温州医学院,浙江 温州 325035,1.实验动物中心;2.生命科学学院;3.附属第一医院 病理科;4.电镜室)
拘束冷应激对大鼠肾脏热休克蛋白表达和血清皮质醇含量的动态影响
吴步猛1,林飞燕2,赵惠玲1,黄卡特3,林婷婷2,包晶莹2,吴军2,方舟溪4,陈国荣3
(温州医学院,浙江 温州 325035,1.实验动物中心;2.生命科学学院;3.附属第一医院 病理科;4.电镜室)
目的:研究拘束冷应激对大鼠肾脏组织热休克蛋白(heat shock protein 70,HSP70)表达和血清中皮质醇(Cortisol,CORT)含量的动态影响及可能的机制。方法:选取50日龄清洁级大鼠77只,随机分为7组,即0、0.5、1.0、1.5、2.0、2.5和3.0 h。采用拘束冷应激法,应激相应时间后,用免疫组织化学方法观察大鼠肾脏组织HSP70的表达,并检测血清中CORT含量。结果:血清中的CORT浓度在1.5 h呈现最高值,其余各时点变化不明显。光镜下可见HSP70在肾小球毛细血管内皮细胞的胞核及肾小管上皮细胞的胞核和胞浆中均有表达。肾脏中HSP70的表达首先呈增加的趋势,1.5~2.5 h HSP70持续高表达(P<0.01),之后下降(P<0.05)。结论:适当强度的拘束冷应激能诱导肾脏组织中HSP70的合成,并且随着时间的延长而增加,但过度的拘束冷应激则可能降低或阻断肾脏HSP70的表达。
拘束冷应激;大鼠;肾脏;热休克蛋白;皮质醇
当动物在各种极端环境因素如雪灾、地震等造成的寒冷束缚的刺激下,机体的组织、器官、细胞内会产生各种类型的应激变化,这些变化能够反映动物的生理状态和健康状态。近年来的研究发现,在热暴露、冷暴露和损伤等应激条件下,一组应激蛋白热休克蛋白家族(heat shock proteins,HSPs)的表达水平会显著增加,HSPs在机体内作为一种分子伴侣而对机体起到保护作用[1-2]。以往相关的实验多基于慢性冷应激,关于急性冷应激对大鼠肾脏组织热休克蛋白(heat shock protein 70,HSP70)表达的动态影响的文献并不多见。本研究拟用饥饿后急性的拘束冷应激法对大鼠进行不同强度的应激,用免疫组化法观察大鼠肾脏组织HSP70的表达,并检测血清中皮质醇(Cortisol,CORT)含量,以期探讨饥饿后拘束冷应激对机体的影响及可能的机制。
1 材料和方法
1.1 实验动物及分组 50日龄清洁级雄性SD大鼠77只,由温州医学院实验动物中心提供[SCXK(浙)2005-0019],质量180~230 g。随机分为7组,即分别应激0、0.5、1.0、1.5、2.0、2.5和3.0 h,每组11只。
1.2 拘束冷应激模型制作及标本制作 大鼠禁食不禁水24 h后,将大鼠四肢束缚于网格板上,限制其活动,置于(5±1)℃冰箱内急性冷应激相应时间后取出,用乙醚深度麻醉,开腹、腹主动脉取血、分离血清备用;并快速取3只大鼠肾脏组织2块,每块体积约0.5 cm×0.5 cm×0.3 cm,置于10%中性福尔马林中固定24 h以上,水洗、常规脱水、石蜡包埋,连续切片5μm备用。
1.3 血清CORT含量的检测 采用免疫放射分析(RIA)法测定大鼠血清CORT含量,由温州医学院迪安医学检验中心检测。
1.4 肾组织HSP70的表达 ABC免疫组化试剂盒购自北京中山生物技术公司。石蜡切片脱蜡水化,新鲜配制的3% H2O2,室温下孵育10 min去除内源性过氧化物酶,0.01 nmol/L 枸橼酸盐缓冲液(pH 6.0)热修复抗原,正常山羊血清封闭20 min;滴加兔多克隆抗体HSP70,稀释度1:100,4 ℃冰箱过夜;滴加山羊抗兔IgG,37 ℃烤箱孵育30 min,加SABC复合物,37 ℃ 30 min,DAB光镜下显色。实验以0 h组作为阴性对照。结果判定以细胞浆或细胞核染成黄色或棕褐色为阳性判定标准。每张切片随机选取10个观察区,采用Image-Pro Plus 5.1图像处理与分析系统分析免疫组化染色图像,根据HSP70阳性反应区域的面积(Area)和累积光密度值(IOD)计算每一张图片HSP70阳性表达量。
1.5 统计学处理方法 组间比较采用单因素方差分析。
2 结果
2.1 血清中CORT含量的变化 前0~1.0 h大鼠血清CORT无明显变化,1.5 h时达到最高值,之后下降但无持续变化现象。1.5 h组与其他各组之间差异都有显著性(P<0.05);其余各组间相比差异都无显著性(P>0.05)。见表1。
表1 各组血清中CORT浓度的比较(n=8±s)
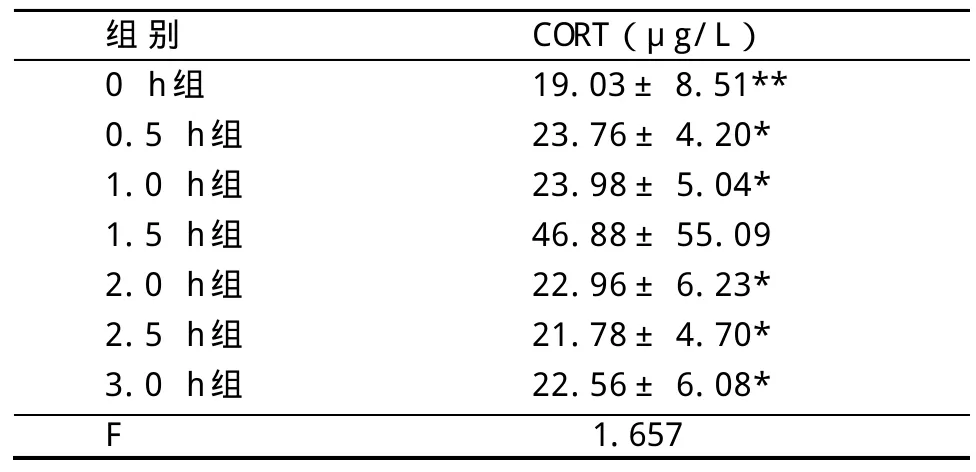
表1 各组血清中CORT浓度的比较(n=8±s)
与1.5 h组比:*P<0.05,**P<0.01
组别0 h组0.5 h组1.0 h组1.5 h组2.0 h组2.5 h组3.0 h组F CORT(μg/L)19.03±8.51**23.76±4.20*23.98±5.04*46.88±55.09 22.96±6.23*21.78±4.70*22.56±6.08*1.657
2.2 肾脏组织中HSP70表达的光镜观察 见图1。HSP70在肾小球毛细血管内皮细胞的胞核及肾小管上皮细胞的胞核和胞浆中均有表达。0 h组大鼠肾脏HSP70也有表达。随着冷应激时间的增加HSP70表达量有所增强:0.5 h组HSP70表达量增强不明显;1.0 h组HSP70的表达量缓慢增强;1.5 h组及2.0 h组HSP70表达量明显增强,几乎每个细胞核都有表达;2.5 h组HSP70表达量有所减弱,肾小管上皮细胞内表达范围有所缩小;3.0 h组HSP70表达量明显减弱,肾小管上皮细胞内呈局灶性表达。
2.3 肾脏组织中HSP70表达的变化 见表2。各实验组肾组织中HSP70表达极显著地高于0 h组(P<0.01);0.5、0.1 h 组升高但差异无显著性(P>0.05),1.5、2.0、2.5和3.0 h组的HSP70表达较0.5、0.1 h组明显升高(P<0.01);1.5、2.0、2.5 h组间比较差异无显著性(P>0.05),但显著高于3.0 h组(P<0.05),即随着拘束冷应激时间持续肾组织HSP70表达持续升高,且至1.5~2.5 h呈高表达稳定状态,到3.0 h时有所下降。
表2 各组肾脏组织HSP70表达的变化(n=3±s)
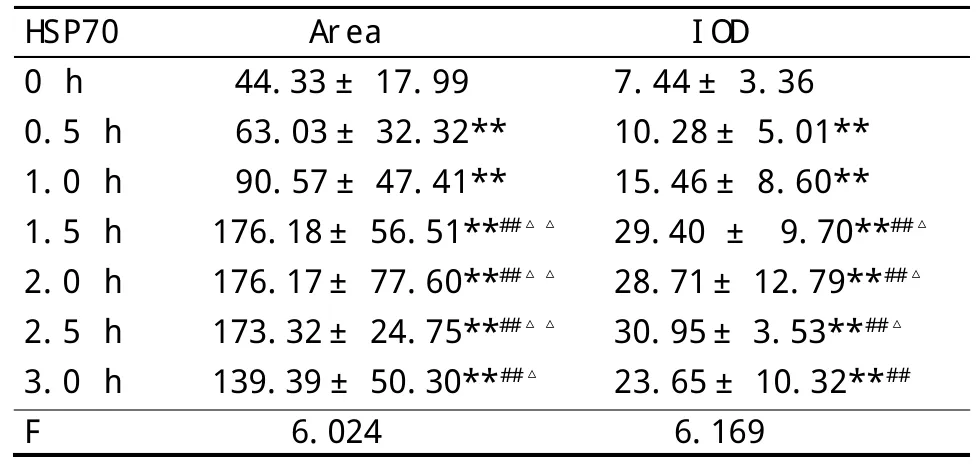
表2 各组肾脏组织HSP70表达的变化(n=3±s)
与0h组比:**P<0.01;与0.5h、1.0h组比:##P<0.01;与3.0h组比:△P<0.05,△△P<0.01
Area 44.33±17.99 63.03±32.32**90.57±47.41**176.18± 56.51**##△△176.17± 77.60**##△△173.32± 24.75**##△△139.39±50.30**##△6.024 HSP70 0 h 0.5 h 1.0 h 1.5 h 2.0 h 2.5 h 3.0 h F IOD 7.44±3.36 10.28±5.01**15.46±8.60**29.40 ± 9.70**##△28.71±12.79**##△30.95±3.53**##△23.65±10.32**##6.169
3 讨论

图1 肾脏组织中HSP70表达的光镜观察(ABC,×100)
CORT是下丘脑-垂体-肾上腺皮质轴(HPA)的终末产物,是由肾上腺皮质分泌的一种糖皮质激素,主要调节体内糖和蛋白质的代谢。人们发现各种应激原均可以导致外周血或者是组织CORT升高[3]。本研究显示,血清中的CORT浓度在1.5 h呈现最高值,其余各时点变化不明显。此结果与早期相关研究相似[4-5]。HSP70几乎在所有生物的应激细胞中都经常高度地被诱导表达,HSP70赋予细胞或生物体从应激状态中恢复的能力,并保护它们免受应激的损害,是对环境和代谢应激综合反应的代表[6]。饥饿是一种强烈的应激原,拘束冷应激实验动物模型的制作过程中大鼠需经24 h饥饿处理[7],导致0 h组也出现HSP70表达。本实验结果发现,肾脏中HSP70的表达首先呈增加的趋势,1.5~2.5 h HSP70持续高表达,之后下降,提示拘束冷应激诱导HSP70的大量表达从而对处于应激状态下的细胞起到一定的保护作用;光镜下也可以发现几乎每个细胞核都有表达。本实验还观察到,随着应激时间达到3 h时,肾脏组织中大鼠HSP70表达呈显著下降,此结果与以往研究并不一致[8]。在实验过程中,我们注意到拘束冷应激3 h后大鼠都出现体温下降、虚脱甚至濒死状态,提示此时组织中HSP70表达量显著降低并不是大鼠的“冷适应”,而是机体的衰竭现象,其可能的机制是当严重的伤害性应激阻断了HSP70的转录和(或)翻译过程,HSP70无法合成,不能发挥保护细胞的作用,从而导致机体出现严重损伤甚至死亡。
CORT与HSP70之间的关系复杂,尚无定论。Blake等[9]的研究证实,HSP70表达与HPA轴之间存在功能性联系,束缚应激后3~6 h,大鼠肾上腺皮质及胸主动脉可见HSP70表达;切除大鼠垂体后,束缚应激后未见HSP70表达;但给予ACTH后,又可以诱导HSP70表达。而Vijayan等[10]研究表明,皮质醇水平增高,对肝脏HSP70 表达没有影响。本实验结果显示,大鼠血清中CORT的含量在应激初期就升高,之后变化不明显,而肾脏HSP70表达量则在应激中后期达到最高,二者间是否存在必然的联系有待进一步的研究。
[1] Fujita J. Cold shock response in mammalian cells[J]. J Mol Microbiol Biotechnol,1999,1(2):243-255.
[2] Witkin SS. Heat shock protein expression and immunity:relevance to gynecologic oncology [J].Eur J Gynaecol Oncol,2001,22(4):249-256.
[3] 吴丽丽,严灿,苏俊芳,等.丹栀逍遥散及其提取物对慢性应激大鼠下丘脑-垂体-肾上腺轴分泌的影响[J].广州中医药大学学报,2006,23(5):413-415.
[4] Yehuda R. Stress and glucocorticoid [J].Science,1997,275(5306):1662-1663.
[5] 孙燕,柳锋霖,宋耿青,等.急性和慢性束缚应激对大鼠内脏敏感性和神经内分泌的影响[J].中华消化杂志,2006,26(1):38-41.
[6] 郑磊,颜晓慧. 热应激时热休克蛋白70及其细胞保护作用[J].国外医学:卫生学分册,1999,26(4):209-212.
[7] 吴步猛,陈锡文,金月玲,等.铜预投对大鼠冷应激性胃溃疡的影响及机制[J].温州医学院学报,2005,35(2):107-110.
[8] 李琦,潘芳,江虹,等.不同应激方式与时程对大鼠海马CA3区HSP70表达及血清皮质醇含量的影响[J]. 山东大学学报:医学版,2005,43(11):1001-1006.
[9] Blake MJ,Udelsman R,Feulner GJ, et al. Stress-induced heat shock protein 70 expression in adrenal cortex: an adrenocorticotropic hormone-sensitive,age-dependent response [J].Pro Nati Acad Sci USA,1991,88(21):9873-9877.
[10]Vijayan MM, Pereira C, Forsyth RB, et al. Handling stress does not affect the expression of hepatic heat shock protein 70 and conjugation enzymes in rainbow trout treated with beta-naphthoflavone[J]. Life Sci,1997,61 (2):117-127.
The dynamic effects of cold restraint stress on heat shock protein expression in kidney tissues and serum corticos-teroid content in rats
WU Bumeng*,LIN Feiyan,ZHAO Huiling,HUANG Kate,LIN Tingting,BAO Jingying,WU Jun,FANG Zhouxi,CHEN Guorong.
*Laboratory Animal Center,Wenzhou Medical College,Wenzhou,325035
Objective:To study the dynamic effects of cold restraint stress on HSP70 expression in kidney and serum corticosteroid content in rats,and explore its possible mechanism.Methods:Seventy-seven 50-day-old SD rats were randomly divided into 7 groups,namely 0 h,0.5 h,1.0 h,1.5 h,2.0 h,2.5 h and 3.0 h group. At corresponding restraint stress time,the expression of HSP70 in kidney tissues were tested by means of immunohistochemistry and the level of CORT in serum was also examined.Results:The level of CORT reached its peak in 1.5 h group,but there was no significant difference in other groups. Under the light microscope, the expressions of HSP70 in the nuclei of renal glomerular capillary endothelial cells,in the nuclei and cytoplasm of renal tubular epithelial cells could be observed. The HSP70 expression in kidney increased continuously first,then it was kept in a high level at stress time of 1.5 h,2.0 h and 2.5 h(P<0.01),and since then it declined gradually(P<0.05).Conclusion:Suitable cold restraint stress can induce the synthetic of HSP70,and it increased with stress time. While excessive cold restraint stress may decreased or block the expressions of HSP70 in kidney.
cold restraint stress;rats;kidney;heat shock protein 70;Cortisol
Q494
A
1000-2138(2010)06-0564-04
2009-10-27
温州市科技局科技计划资助项目(Y20060106);温州医学院科技发展基金资助项目(200801052)。
吴步猛(1971-),男,浙江乐清人,高级实验师。
吴健敏)
·高教研究·
- 温州医科大学学报的其它文章
- 《温州医学院学报》创刊50年载文统计与分析

