肿瘤坏死因子-α和白介素-2对成骨细胞增殖的影响
薛 明,杨 谛,李 任
(中国医科大学口腔医学院牙体牙髓科,辽宁沈阳 110002)
骨组织吸收是根尖周病变和牙周病变中一个重要的病理改变,其治疗的最终目的是诱导成骨细胞增殖,分泌基质从而矿化为骨组织,使缺失的牙槽骨重建。成骨细胞的增殖受多种因素相互作用的影响,包括激素、细胞因子和局部生长因子等,这些因素的存在能够影响骨组织的形成和矿化[1]。本实验研究白介素-2(Interleukin-2, IL-2)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)对成骨细胞增殖的影响,探讨影响成骨细胞增殖的病理机制。
1 材料与方法
1.1 材料
MG63人骨肉瘤细胞系(中国细胞库典藏细
胞中心);DMEM培养基(Gibco,美国);胎牛血清(天津灏洋生物制品);胰蛋白酶(Amresco,美国);白介素-2(长春长生基因,20万国际单位/支,批号20070806);肿瘤坏死因子-α(上海赛达生物药业,500万国际单位/瓶,批号20090612)。
1.2 方法
1.2.1 MG63细胞的培养 从液氮中取出冻存的MG-63细胞,迅速放入37℃温水中,轻轻摇动冻存管令其内容物尽快融化。用吸管吸出细胞悬液至离心管,加入新鲜培养基10 mL,轻吹悬浮细胞,1 000 r/min离心5 min,去上清,再用培养液重复洗1次。将MG-63细胞以5×105个/mL密度接种于含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养基中,置于含5%CO2、37℃、饱和湿度的二氧化碳培养箱中培养,24 h后换液1次。当细胞生长状态良好,至覆盖培养瓶底80%时,以0.25%胰蛋白酶消化,进行传代。
1.2.2 细胞增殖的测定 取生长状态良好、几乎长满瓶底的MG63细胞进行传代,制备成浓度为1×105个/mL的细胞悬液,接种于96孔培养板,分为1个对照组和12个实验组,每组设4个复孔,每孔100μL。37℃、5 mL/L CO2培养箱培养24 h。实验组分别加入100μL终浓度为5、10、50、100、500、1 000 U/mL的 IL-2和TNF-α,对照组加入等体积的DMEM培养基,继续培养48 h。各孔加入MTT 10μL,继续培养4 h。吸出培养液,每孔各加入二甲基亚砜100μL,作用10 min后,酶联免疫检测仪测定各孔的吸光度值(A570nm)。
1.2.3 统计学处理 应用SPSS11.0软件包对实验数据进行统计学分析,组间比较采用单因素方差分析,实验组与对照组比较采用Dunnett-t检验。
2 结 果
随着 IL-2剂量的增加,各组细胞出现不同程度的增殖,以 IL-2浓度为100、500、1 000 U/mL组增殖明显,与未加药物的对照组比较,有统计学差异(P<0.05)。50~1 000 U/mL的TNF-α对成骨细胞的增殖也有促进作用(P<0.05),这种促进作用的峰值在100 U/mL,见表1、图1。

表1 各组成骨细胞的平均吸光度值(A570nm)Table 1 The mean absorbency values of osteoblasts(A570nm)
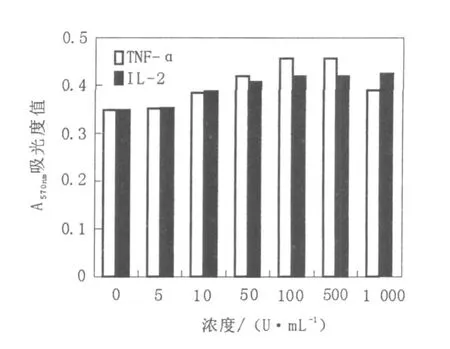
图1 不同浓度I L-2和TNF-α对成骨细胞增殖的影响Fig.1 The effect of I L-2 and TNF-αon the proliferation of osteoblasts
3 讨 论
骨组织的形成需要经过间充质干细胞、骨原细胞、成骨细胞、骨细胞等一系列细胞的增殖、分化。成骨细胞作为骨形成细胞,在成骨过程中经历分裂增殖、分化成熟和基质钙化3个阶段。研究表明,很多细胞因子参与调节成骨细胞的增殖活动,如白介素-1(Interleukin-1, IL-1)、白介素6(Interleukin-6, IL-6)、转化生长因子β1(Transforming growth factorβ1,TGFβ1)以及成纤维细胞生长因子(Fibroblast growth factor,FGF)等[2-3]。 IL-2是体内一种重要的参与免疫调节的细胞因子,目前的研究认为其主要生物学作用是促进T细胞增殖;维护整个NK细胞的活化、分化和增殖,调节NK细胞保持其自然杀伤力;诱导细胞毒性T淋巴细胞产生和增殖;诱导淋巴因子活化淋巴细胞产生;促进B细胞增殖分化作用;以及与其他白介素等的协同作用,用于抗肿瘤、抗病毒感染、抗细菌感染以及提高免疫力的治疗等[4]。 IL-2对成骨细胞增殖的影响研究较少,Reyes-Botella等[5]检测到成骨细胞表达 IL-2受体和CD25分子,推测 IL-2对成骨细胞的行为可能存在影响。本实验将不同浓度的 IL-2作用于MG63细胞后,观察到 IL-2能够促进成骨细胞增殖,随着 IL-2浓度的增加,这种促进增殖作用呈上升趋势,提示IL-2是成骨细胞的一种促分裂原,推测 IL-2通过促进成骨细胞增殖,参与骨吸收疾病的骨组织重建过程。
在骨组织改建过程中,成骨细胞不仅参与成骨过程,也参与破骨细胞的骨吸收过程,是骨代谢的主要功能细胞[6]。骨组织改建受多种细胞因子的调节,其中TNF-α被认为是一种十分重要的破骨细胞激活因子,能够刺激前祖细胞分化为破骨细胞,并能够间接刺激成熟的破骨细胞形成骨吸收陷窝,导致破骨细胞的骨吸收增强[7]。在正常人体液中,TNF-α的水平一般在100 ng/L,在妇女绝经后骨质疏松病例以及2型糖尿病骨质疏松病例中,TNF-α的水平有所升高,这些均提示TNF-α是促进骨吸收的动因[8-9]。关于TNF-α对成骨细胞的作用,目前研究主要集中在TNF-α能够促进成骨细胞的凋亡[10]以及产生骨吸收因子前列腺素-2(Prostaglandin E2,PGE2)、白介素-6(Interleukin-6, IL-6)[11]等方面。本试验将小剂量的TNF-α作用于成骨细胞,观测到其对成骨细胞的促进增殖作用,并且随着TNF-α浓度的增加,这种促进作用逐渐削弱。推测低浓度的TNF-α通过增加成骨细胞的数量,产生炎症因子,参与破骨过程,而高浓度的TNF-α则通过直接诱导成骨细胞凋亡,促进骨吸收。通过对骨组织改建过程中细胞因子作用的探讨,可以为人为干预骨组织改建提供方向,从而提高炎性骨吸收疾病的治疗水平。
[1] Kessler S,Katler S,Mayr-Wohfart U,et al.Stimulation of primary cultures with rh-TGF-beta,rh-bFGF,rh-BMP2 and rx-BMP4 in an in vitro model[J].Orthopade,2000,29(2):107-111.
[2] Dodds RA,Merry K,Littlewood A,et al.Expression of mRNA for IL1beta, IL6 and TGF beta 1 in developing human bone and cartilage[J].J Histochem Cytochem,1994,42(6):733-744.
[3] Mackie EJ,Abraham LA,Taylor SL,et al.Regulation of tenascin-C expression in bone cells by trans for ming growth factorbeta[J].Bone,1998,22(4):301-307.
[4] 郑建华.白介素-2研究进展[J].海峡药学,2006,18(3):1-3.
[5] Reyes-Botella C,MontesMJ,Vallecillo-CapillaMF,et al.Antigenic phenotype of cultured human osteoblast-like cells[J].Cell PhysiolBiochem,2002,12(5-6):359-364.
[6] 赵秀敏,艾红军,常新.成骨细胞和破骨细胞的传导通路和相关因子[J].中国实用口腔科杂志,2009,2(3):176-179.
[7] Kobayashi K,Takahashi N,Jimi E,et al.Tumor necrosis factor alpha stimulates osteoblast diferentiation by a mechanism independent of the ODF/RANKL-RANK interaction[J].Exp Med,2000,191(2):275-286.
[8] Pfeilschifter J,Koditz R,PfohlM,et al.Changes in proinflmmatory cytokine activity after menopause[J].Endocr Rev,2002,23(1):90-119.
[9] Leidig-Bruckner G,Ziegler R.Diabetes mellitus a risk forosteoporosis[J].Exp Clin Endocrinol Diabetes,2001,109(2):493-514.
[10] 王文良,吴岳嵩,杨柳,等.肿瘤坏死因子α诱导人成骨细胞和人成骨细胞系HOS-8603凋亡的作用[J].中国临床康复,2005,9(26):162-164
[11] Vincent C,Findlay DM,Welldon KJ,et al.Pro-inflammatory cytokines TNF-related weak inducer of apoptosis(T WEAK)and TNFalpha induce the mitogen-activated protein kinase(MAPK)-dependent expression of sclerostin in human osteoblasts[J].J BoneMiner Res,2009,24(8):1434-1449.

