温度对短柄樱桃花芽萌发及若干生理指标的影响*
陈 镇, 李永强, 陈文荣, 辛德东, 郭卫东
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
短柄樱桃 (Cerasuspseudocerasuscv. Duanbing) 系中国樱桃的优良栽培品种之一[1].短柄樱桃主产浙江,有自花结实性好、早果性好、丰产性佳、适应性强、果实大、成熟期早而集中等特点,现已成为中国南方樱桃产业发展的重点品种,并于1992年通过省级品种认定,为中国樱桃中通过省级认定的少数品种之一.
设施栽培能够使果树提前开花、结果,调节水果丰淡季、抢占水果市场,极大地提高果品的经济效益.目前设施栽培中还存在很多问题,设施内的温度控制,特别是花期的温度对果树正常开花、坐果的影响显著.为了促进桃树开花,夜温应保持10~15 ℃,最低温不宜低于5 ℃,从扣棚至开花坐果,昼温逐渐升至20~25 ℃,以不超过25 ℃为宜[2].甜樱桃在需冷量得到满足后,棚内温度开始时要求昼温在14~16 ℃,最高不宜超过18~20 ℃,夜温6~7 ℃最为适宜;开花期前后15 d要求昼温16~18 ℃,最高不宜超过20~22 ℃,夜温7~9 ℃最为适宜[3].说明各种果树依照其固有的生物学特性,在各个特定的物候期需要一个适宜的温度才能生长发育良好.短柄樱桃作为中国樱桃的优良品种,在其设施栽培中对花期的温度管理方面还没有进行系统的研究.本实验主要是在人工控制条件下,研究温度对短柄樱桃开花进程及相关酶活性的影响,以确定短柄樱桃花器官发育的适宜温度范围,揭示极限温度对花芽萌发的伤害机理,为科学制定设施栽培中花期温度管理指标提供依据.
1 材料与方法
1.1 材料及其处理
实验材料采自浙江省金华市金东区上汪村.2008年12月17日,短柄樱桃需冷量满足,结束自然休眠.在同一试验田中随机剪取7年生的长果枝(约30 cm),放入盛有9 g/L蔗糖溶液的容器中,将枝条随即分成6份,每份约70根长果枝,分别置于夜温为10 ℃,昼温为10,15,20,25,30和35 ℃的光照培养箱中,光周期昼/夜(12/12 h)光照强度为2 500 lx,相对湿度(RH)控制在50%~70%.
每4 d取不同温度处理的花芽(自顶芽向下第2至第4节位的花芽)测定酶活性和丙二醛含量.由于不同温度下花芽萌发的速度不同,35和30 ℃处理每4 d到达一个开花物候期,在1月6日已经达到初花期;而25,20,15和10 ℃ 4个温度处理还未完全进入开花进程,故采用两阶段分别比较的方法.第1阶段:6个温度处理每4 d取材测定一次.第2阶段:在此阶段中,35和30 ℃处理的开花进程已基本结束,25,20,15和10 ℃ 4个温度处理下各开花进程时间相差较大,为便于比较,此阶段按照开花进程取材测定.
1.2 开花进程的观察
开花进程按照以下标准判断:
花芽膨大期:花芽开始膨大,鳞片错开.
花芽开绽期(开放期):鳞片裂开,露出绿色叶尖.
花序可见期:花芽外层鳞片脱落,中部出现卷曲状莲座叶,花序已可看见.
花序分离期:花梗明显伸长,花蕾彼此分离.
初花期:全树5%的花开放.
盛花期:50%花开放为盛花期.
1.3 POD 酶活性的测定
过氧化物酶(POD)活性按照文献[4]的方法测定.提取液为pH 7.8的磷酸缓冲液(含10 g/L的聚乙烯吡咯烷酮(PVP));反应混合液为50 mL pH 6.0的磷酸缓冲液,其中含28 μL的愈创木酚和19 μL 30%的过氧化氢溶液.根据470 nm波长下吸光度的增加计算酶活性,以在470 nm波长下每分吸光度的增加定义为1个单位酶活性.
1.4 CAT 酶活性的测定
过氧化氢酶(CAT)活性通过测定H2O2在240 nm波长下的分解率[5]来表示.取植物样0.1 g,用提取液(pH 7.8磷酸缓冲液和10 g/L的PVP)冰浴提取,6 000 r/min离心20 min后,取上清液,即为所需测定的酶液.取2个100 mL三角烧瓶,编号为1和2,各加入酶液1 mL和提取液9 mL,马上向2号瓶中加入3.6 mol/L H2SO4溶液5 mL以终止酶活动,作为对照.将各瓶置于20 ℃水浴中保温20 min,加入0.1 mol/L H2O2溶液5 mL,在水浴中保温作用5 min;向1号瓶中加入5 mL 3.6 mol/L H2SO4溶液;再向2个瓶中各加入1 mL 200 g/L KI溶液,3滴100 g/L钼酸铵溶液,5滴10 g/L淀粉指示剂后,用0.02 mol/L Na2S2O3标准溶液滴定至蓝色消失.
1.5 SOD酶活性的测定
超氧化物歧化酶(SOD)活性采用氯化硝基四氮唑蓝(NBT)法[6]测定.称取植物样0.5 g,用5 mL提取液(pH 7.8的磷酸缓冲液和10 g/L的PVP)冰浴提取,6 000 r/min离心20 min后,取上清液,即为所需测定的酶液.在试管中加入3 mL反应混合液(在54 mL 14.5 mmol·L-1的甲硫氨酸溶液中分别加入均以pH 7.8的磷酸缓冲液配制的3 μmol·L-1EDTA溶液、2.25 mmol·L-1NBT溶液和60 μmol·L-1核黄素溶液各2 mL)和20 uL酶液,混合后光照10 min,以反应混合液为对照迅速测定A560.1 U的SOD定义为使NBT光还原速率抑制50%所需要的酶活性.
1.6 丙二醛含量的变化
取不同温度处理下的花芽测定有毒物质丙二醛(MDA)含量的变化.膜脂过氧化程度用丙二醛(MDA)含量表示.测定方法采用硫代巴比妥酸(TBA)比色法[7].称取植物样0.2 g,于液氮中磨成粉末,然后加入100 g/L三氯乙酸(TCA)溶液2 mL研磨至匀浆,再加入8 mL TCA溶液进一步提取,提取物离心后取2 mL上清液与2 mL 6 g/L TBA溶液(用100 g/L TCA溶液配制)混合,混合物在90 ℃水浴加热20 min,冰浴结束反应,反应液离心后取上清液测定在532,600和450 nm波长下的吸光度,MDA的浓度(单位:μmol/L)按
CMDA=6.45(A532-A600)-0.56A450
计算.
1.7 可溶性蛋白含量测定
可溶性蛋白含量的测定采用考马斯亮蓝G-250 法[8].
1.8 数据处理
各项指标重复3次测定,实验数据用DPS数据处理软件进行方差分析和t检验,用Orgin 7.0软件作图.
2 结果与分析
2.1 温度对开花进程的影响
不同温度处理对短柄樱桃开花进程的影响显著(见表1).总体而言,随着处理温度的升高,开花所需的时间逐渐缩短.35 ℃处理4 d后花芽开始膨大,鳞片错开,12 d后到达花序可见期,发育最快,但此后绝大多数花芽停止发育,10%的花芽继续生长至花序分离期,但花柄未露出便停止生长,花蕾和未展开的萼片上有明显的褐色灼伤痕迹,最后全部不能正常开花而脱落.30 ℃处理组与35 ℃处理组比较,在开花进程时间上基本吻合,两者发育到花序可见期所需时间基本相同.在开花进程时间上,25 ℃处理组比20 ℃处理组提早2 d;但15和10 ℃处理组开花所需时间明显长于其他各组,整个开花进程分别耗时66及75 d.

表1 温度对短柄樱桃开花进程的影响
2.2 温度对花芽MDA含量的影响
为揭示极限温度条件下短柄樱桃花芽的生理代谢受胁迫的程度,本实验测定了6个温度处理下短柄樱桃花芽中丙二醛(MDA)含量的变化,探讨了不同温度下膜脂过氧化作用的情况.
MDA是膜脂过氧化作用的产物,其含量可以揭示膜脂过氧化作用的程度,进而反映植物受逆境胁迫的程度.第1阶段(见图1),35和30 ℃处理组基本上每4 d到达一个开花物候期,即12月21日、25日和29日,1月2日和6日分别为花芽膨大期、开绽期、花序可见期、花序分离期及初花期,而其余4个温度处理还未完全进入开花进程.从处理开始至12月29日,6个温度处理组的花芽MDA含量无显著性差异(P>0.05);在处理至12月29日后,30和35 ℃处理下的花芽(处于花序可见期)中MDA含量开始快速上升,而其他4个温度下的花芽MDA含量变化比较平稳,无显著性差异(P>0.05).第2阶段,虽然各处理温度条件下短柄樱桃开花进程所需的时间相差较大,但各进程阶段花芽内MDA含量的变化具有明显的规律性,即25 ℃处理组在花序可见期后MDA含量开始升高,并持续到初花期,而其他3个温度处理组花芽中MDA含量变化平稳,无特殊规律,也无显著性差异(P>0.05).

图1 不同温度下短柄樱桃花芽中MDA含量的变化
2.3 温度对花芽POD,CAT和SOD活性的影响
超氧化物氧化酶(SOD)是植物抗氧化酶系统的主要成员之一,在植物体内负责将O·-2歧化为O2和H2O2,以减缓叶绿素、蛋白质的降解,增强机体的抗逆性.由图2可见,10,30和35 ℃ 3个处理组花芽中SOD的活性均是先上升后下降,35 ℃处理组的SOD活性最高,但高峰以后SOD活性又低于前两者.其他处理组的SOD活性则一直保持着平稳的状态.
由图3可见,在逆境温度下H2O2的积累激发了POD的活性.30和35 ℃处理组花芽中POD活性从12月25日开始持续上升.25 ℃处理组在花序可见期和花序分离状态下POD活性达到高峰.
CAT活性的变化与SOD基本相似,如图4所示,30和35 ℃ 2个处理组花芽的CAT活性前期上升,后期迅速下降;而25 ℃处理组在花序分离期CAT活性达到峰值,而后迅速下降.

图2 不同温度下短柄樱桃花芽SOD活性的变化
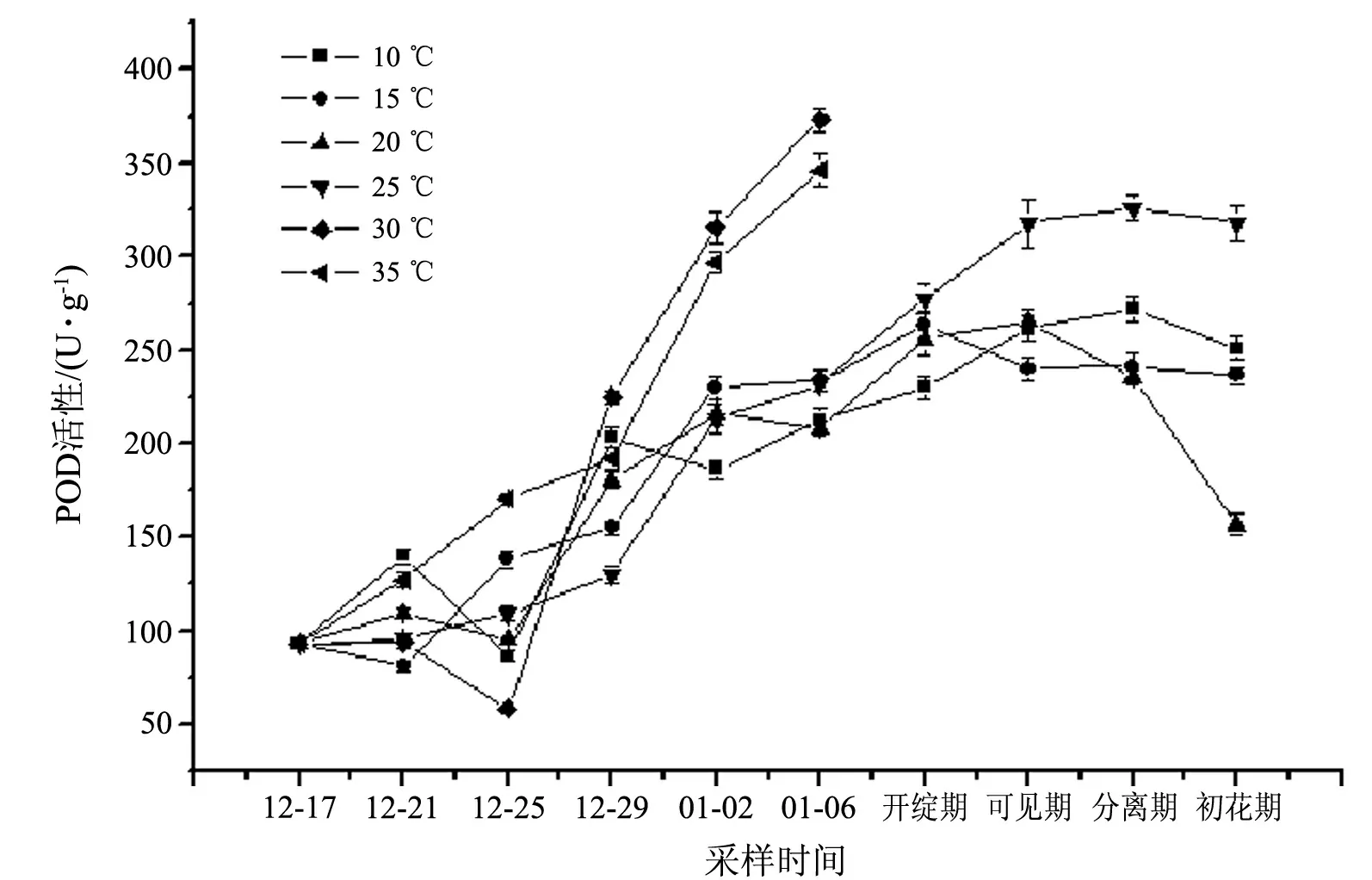
图3 不同温度下短柄樱桃花芽POD活性的变化

图4 不同温度下短柄樱桃花芽CAT活性的变化
2.4 温度对花芽可溶性蛋白含量的影响
不同温度处理下,短柄樱桃花芽中可溶性蛋白含量升高的时间与花芽萌发进程吻合(见图5).在花芽萌发进程中,可溶性蛋白含量一直在升高,主要升高阶段是在花序可见期至初花期.当花芽进入萌动时期,枝条活动旺盛,韧皮部中在休眠期积累的营养输送到花芽中,因此花芽中蛋白含量迅速升高,以保证花芽萌发的正常进行.
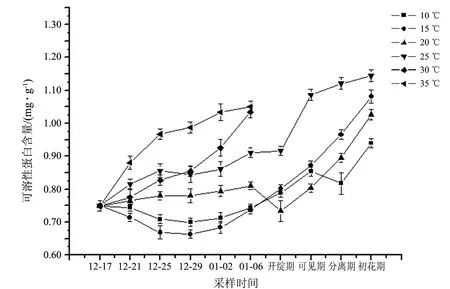
图5 不同温度下短柄樱桃花芽可溶性蛋白含量的变化
3 讨 论
膜的稳定性是维持细胞正常生命活动的基本条件.在高温胁迫下,组织中的氧化物自由代谢失调引起膜脂过氧化作用增强,导致细胞膜透性增加等伤害的发生,MDA含量被广泛用于指示植物细胞膜系统完整性及受胁迫的程度.研究表明:在雄性败育的花器官中,脂膜的破坏比在可育花器中快得多;在育性表达的关键期,H2O2,R-,O2,OH-等含量上升,引起膜脂过氧化加剧,其产物MDA含量上升.在水稻[9]、小麦[10]、玉米[11]及油菜[12]等不育材料中都发现了较高的氧自由基和MDA含量.在处理14 d后,35和30 ℃处理短柄樱桃花芽中MDA含量开始升高,25 ℃处理组在花序可见期MDA含量开始升高,说明极限温度造成的膜脂过氧化作用导致细胞膜透性增加,失去其选择性透过的功能.通过短柄樱桃花芽萌发过程中MDA含量的变化可以看出,35,30和25 ℃处理短柄樱桃均是在花序可见期后MDA含量开始快速上升的.
相关研究表明,高温胁迫引起的膜脂过氧化过程中氧自由基O·-2,H2O2等有毒物质的产生速度与保护酶系统在高温下的活性共同决定着植物的耐热性.植物酶促防御系统,包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT) 等是消除自由基的重要酶,它们可以减轻膜脂过氧化的程度,保持膜系统的稳定性.POD被认为通过自身的消耗清除了因代谢失调引起的过多氧自由基,从而保护了细胞膜的结构,提高植物的耐热性.研究表明,草地早熟禾在热胁迫时过氧化物酶(POD)活性先下降后升高[13];司家钢等研究发现不管是耐热还是热敏大白菜品种,其POD活性在高温下均下降,耐热强的品种POD活性变化较大[14].在正常条件下,SOD 等活性氧清除剂能有效地清除机体内破坏力极强的活性氧;在高温胁迫下,花芽中SOD 活性下降,造成膜脂过氧化作用加剧,使膜系统进一步受到伤害.短柄樱桃在高温胁迫下(35,30和25 ℃处理),花芽中的SOD和CAT活性均在花序可见期升至峰值,然后急剧下降,说明其活性受到抑制,使超氧化物自由基、过氧化氢等活性氧不能有效地清除,过剩的活性氧会攻击大分子和生物膜,使膜脂过氧化作用增强,从而引起伤害.而POD的活性在胁迫发生后迅速上升,说明与伤害的程度呈正相关.
随着昼温的提高,短柄樱桃的花期相应提前,高温处理会对花药发育的特定过程造成伤害.本研究已证明:在昼温35,30和25 ℃条件下,花芽中MDA含量及抗氧化酶活性均在花序可见期变化较大.花序可见期鳞片进一步错开、脱落,小花外层的包片也脱落,此时花刚露出,对外界环境适应性较差,对温度较为敏感.所以,设施栽培中花期温度管理应该从扣棚开始,昼温不超过25 ℃,保持在20~25 ℃为宜,这样能加快物候期的进程,提早开花,增加坐果率.
[1]李建华,戚行江,梁森苗,等.中国樱桃品种诸暨短柄樱桃[J].园艺学报,2007,34(4):1065.
[2]沈元月,郭家选,刘成连,等.温度对桃花器官发育的影响[J].园艺学报,1999,26(1):1-6.
[3]孙维洋.不同温度对保护地甜樱桃花器官发育的影响及促花措施的研究[D].泰安:山东农业大学,2000.
[4]张志良.植物生理学实验指导[M].北京:高等教育出版社,2000.
[5]陈文荣.水稻(OryzasativaL.)锌高效营养生理机制研究[D].杭州:浙江大学,2008.
[6]Liu Peng,Yang Yuesuo,Xu Gendi,et.at.Physiological response of rare and endangered seven-son-flower (Heptacodiummiconioides) to light stress under habitat fragmentation[J].Environ Exp Bot,2006,57(1):32-40.
[7]汤章诚.现代植物生理学实验指南[M].北京:科学出版社,1999:305-306.
[8]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:184-185.
[9]陈贤丰,梁承邺.水稻不育花药中H2O2的积累与膜脂过氧化的加剧[J].植物生理与分子生物学学报,1991,17(1):44-48.
[10]赵会杰,刘华山,林学梧,等.小麦胞质不育系花粉败育与活性氧代谢关系的研究[J].作物学报,1996,22(3):365-367.
[11]段俊,梁承邺,张明永.玉米细胞质雄性不育性与膜质过氧化的关系[J].植物生理学通讯,1996,32(5):331-334.
[12]张明永,梁承邺,段俊.油菜细胞质雄性不育系发育进程中活性氧的代谢[J].植物学报,1997,39(5):480-482.
[13]何亚丽,沈剑,王惠林.冷地型草坪草耐热机理初探I.草地早熟禾在热境胁迫下叶片叶绿素含量和POD酶活性的变化[J].上海农学院学报,1997,15(2):128-132.
[14]司家钢,孙日飞,吴飞燕,等.高温胁迫对大白菜耐热性相关生理指标的影响[J].中国蔬菜,1995,15(4):4-6.
——植物学教材质疑(六)

