浅谈勒夏特列原理的一点应用
张成新
化学平衡知识是中学化学教学中的一个难点,在运用勒夏特列原理判断平衡移动方向时,经常会碰到与勒夏特列原理有矛盾的问题,特别是浓度对化学平衡移动的影响,其判断有时会使学生感到束手无策,请看下面一个例子:
t℃时,在1L密闭容器中加入1 mol PCl5后,反应:PCl5(g)→←PCl3(g)+Cl2(g)达到平衡,当向体系中再加入1 mol PCl5反应物时,对该化学平衡的移动有两种解释:
(1)由勒夏特列原理知,增加反应物的浓度,平衡向正方向移动,所以,增加PCl5的浓度,平衡必然向正方向移动;
(2)由勒夏特列原理知,增大压强,平衡向体积缩小的方向移动。所以,增加PCl5的浓度,相当于增大体系的压强,压强增大,平衡向体积缩小的方向移动,即平衡逆方向移动。
显然,同样一个问题有两个完全相反的答案,肯定只能有一个答案是正确的,那么,为什么用勒夏特列原理解释同一问题时会产生截然不同而且自相矛盾的答案呢?
上述问题之所以出现两种截然不同的答案,是由于在使用勒夏特列原理时忽略了勒夏特列原理的使用条件。
勒夏特列原理是这样表述的:如果改变影响平衡的任一个条件(如浓度、温度、压强等)时,平衡就向减弱这种改变的方向移动。可见,在使用勒夏特列原理判断平衡移动方向时,只能“单一因素”发生改变。如上述问题中,当原来的1 mol PCl5已达到平衡后,再加入1 mol PCl5不仅仅使反应物浓度增加,同时也使整个反应体系的压强增加,在两个因素同时改变时,显然不能单独考虑浓度引起的变化,否则,就会产生错误的判断。
图像解释法:
对这个问题的整个过程可用下图表示:
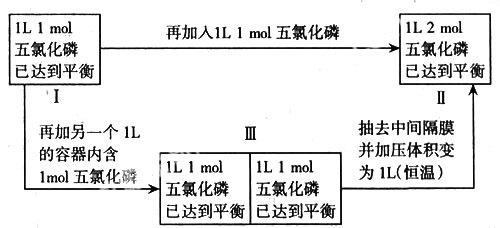
问题中所涉及的过程,就是Ⅰ→Ⅱ的过程,这个过程中等效于经过一个中间过渡状态Ⅲ的Ⅰ→Ⅲ→Ⅱ的整个过程。
平衡移动方向的判断:为使讨论中只有单个因素改变,可以直接讨论等效过程Ⅰ→Ⅲ→Ⅱ的整个过程。其中,在Ⅰ→Ⅲ的过程中,由于另外再加了一个1L含1 mol五氯化磷的容器,对原来一个“旧体系”未改变任何因素,“旧体系”平衡不移动,且两个容器的平衡相同。在Ⅲ→Ⅱ的过程中,抽去中间的隔膜,再使体积减小一半,相当于给体系Ⅲ加压,显然,在Ⅲ→Ⅱ过程中,平衡向逆方向移动;由于Ⅰ→Ⅲ→Ⅱ的整个过程中,过程Ⅰ→Ⅲ不影响平衡移动,只有过程Ⅲ→Ⅱ才影响平衡移动,所以,可以把过程Ⅰ→Ⅱ总的平衡移动影响因素看作就是过程Ⅲ→Ⅱ的平衡移动影响因素,即过程Ⅰ→Ⅱ,相当于过程Ⅰ→Ⅲ→Ⅱ,相当于过程Ⅲ→Ⅱ,也相当于加压对平衡移动的影响。所以,在本问题中,第(2)种解释是正确的。
运用勒夏特列原理时应明确:当改变某个反应条件时,可能会引起多个因素的同时改变,分析平衡移动时就必须单一因素逐个进行分析。
作者单位:山东省临邑县第一中学化学组

