辛伐他汀对钛颗粒刺激人单核细胞形成破骨细胞的影响
王真 高希武 孙克宁 金群华
基础研究
辛伐他汀对钛颗粒刺激人单核细胞形成破骨细胞的影响
王真 高希武 孙克宁 金群华
目的研究体外辛伐他汀对钛颗粒刺激单核细胞形成破骨细胞的影响,探讨辛伐他汀防治人工关节无菌性松动的可能性。方法体外分离培养人外周血单个核细胞并分成5组,A组为钛颗粒刺激组(单核细胞和磨屑混合培养),B组为10-5mol/L辛伐他汀组(单核细胞、磨屑混合培养+10-5mol/L辛伐他汀),C组为10-6mol/L辛伐他汀组(单核细胞、磨屑混合培养+10-6mol/L辛伐他汀),D组为10-7mol/L辛伐他汀组(单核细胞、磨屑混合培养+10-7mol/L辛伐他汀),E组为单核细胞组。各组细胞培养24 h后取上清液,用ELISA法检测上清液中肿瘤坏死因子(TNF-α)、单核细胞趋化蛋白-1(MCP-1)的含量。分别培养10 d、18 d后进行TRAP染色阳性细胞计数,采用扫描电镜检测骨磨片的吸收陷窝,观察钛颗粒对破骨细胞形成的影响。结果磨屑刺激单个核细胞分泌溶骨因子,辛伐他汀抑制磨损颗粒刺激单核/巨噬细胞分泌TNF-α及MCP-1;且破骨细胞数明显减少,骨吸收陷窝数减少,与钛颗粒组刺激组比较,差异均有统计学意义(P<0.05)。结论辛伐他汀通过抑制TNF-α、MCP-1的释放而有效防止磨屑诱导的骨溶解,有望成为防治人工关节无菌性松动的一种有潜力的药物。
辛伐他汀;破骨细胞;单核细胞;钛;骨质溶解
目前,全世界每年开展的关节置换手术超过100万例,其中大约10%的病人在术后10年内可能发生假体周围骨溶解并导致人工关节无菌性松动[1]。目前尚无公认的有效药物能够预防或抑制假体周围骨溶解,而假体远期无菌性松动只能通过关节翻修手术进行治疗。他汀类药物(statins)是临床广泛应用的降低胆固醇的药物。Mundy等[2]研究发现,他汀类药物不仅能够促进成骨,而且可使小鼠破骨细胞减少约25%左右。本文通过体外实验研究探讨辛伐他汀对钛颗粒诱导人单核细胞形成破骨细胞的影响,进一步分析他汀类药物防治人工关节无菌性松动的可能性。
1 资料与方法
1.1 一般资料
外周血来源 本组10例均为成年健康志愿者(均已签署知情同意书),21~35岁,中位年龄32岁。共抽血45 ml,肝素抗凝,其中3 ml标本用于血常规检查,白细胞计数均在正常范围内。
1.2 主要试剂及药品
RPMI-1640培养基(Hyclone公司),胎牛血清(杭州四季青公司),6孔培养板(Corning公司),钛颗粒(Zimmer公司提供,经扫描电镜扫描证实90%颗粒<10 μm,图1),单核细胞分离液(购自天津灏洋);辛伐他汀片(Simvastatin Merk sharp& Dohme Ltd.U.K惠赠),U0126(购自promga公司);ELISA试剂盒(上海船夫生物公司);奈酚AS-BI磷酸钠、酒石酸钾钠(购自sigma公司);骨磨片(解放军301骨研所惠赠);KYKY2800B扫描电镜(宁夏回族自治区能源化工重点试验室提供)。
1.3 方法
1.3.1 细胞培养 无菌采集外周血以RPMI-1640液稀释1倍,分层液梯度离心法分离出单个核细胞(3 000转/min,25 min)。毛细管小心吸取单个核细胞,RPMI-1640液洗涤1 000 r/min,10 min,3次;单核细胞计数用流式细胞染色检测抗CD14+阳性细胞为准。单核细胞加10%小牛血清的RPMI-1640培养液制成细胞悬液,细胞计数,调整细胞至1×106/ml,台盼兰检测细胞活力均>95%。事先将灭菌的6 mm直径的骨磨片和8 mm直径的盖玻片2块分别放入6孔细胞培养板,向培养板中滴加细胞悬液,每孔加3 ml。置37℃、5%CO2恒温恒湿培养箱培养2 h,使细胞贴壁,利用单核细胞的贴壁性,洗去非贴壁细胞,留下单核细胞。每板有1孔加入含10%小牛血清的RPMI-1640培养液3 ml,余4孔中加入浓度为0.1%(W/V%)的钛颗粒悬液1 ml,其中3孔内分别加入浓度为10-5、10-6、10-7mol/L的辛伐他汀。实验分组如下:A组为钛颗粒刺激组(单核细胞和磨屑混合培养),B组为10-5mol/L辛伐他汀组(单核细胞、磨屑混合培养+10-5mol/L辛伐他汀),C组为10-6mol/L辛伐他汀组(单核细胞、磨屑混合培养+10-6mol/L辛伐他汀),D组为10-7mol/L辛伐他汀组(单核细胞、磨屑混合培养+10-7mol/L辛伐他汀),E组为单核细胞组。混匀,同条件培养24 h,留上清液离心后置于-80℃冰箱,用于检测细胞因子。之后每3天更换一次培养液,分别于培养10 d、18 d后进行TRAP染色阳性细胞计数。采用扫描电镜观察骨磨片的吸收陷窝。每组设3个复孔。以上试验均重复2次。

图1 钛颗粒扫描电镜结果(×1 000)
1.3.2 破骨细胞的鉴定及骨磨片扫描电镜观察按文献[3]描述的抗酒石酸酸性磷酸酶(tartrateresistant acid phosphatase,TRAP)孵育液配制及染色方法进行;光镜下计算玻片(1 cm2)TRAP阳性破骨细胞总数,细胞核≥3的TRAP染色阳性细胞为破骨细胞。
骨磨片培养18 d后,弃去培养液,骨片2.5%戊二醛4℃固定10 min,0.5%甲苯胺蓝室温染色3 min,蒸馏水冲洗后在100倍光镜下观察并计数,镜下对骨吸收陷窝(呈圆形、椭圆形和腊肠形等典型形态,边界清楚的蓝紫色异染区)观察计数,取均值。骨磨片清洗后2.5%戊二醛固定2 h,1%锇酸固定2 h,系列酒精脱水,醋酸异戊酯置换酒精,二氧化碳临界点干燥镀金,扫描电镜观察。
1.3.3 细胞因子的检测 上清液解冻后,用ELISA试剂盒检测肿瘤坏死因子(tumor necrosis factor-α,TNF-α)及单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)的含量。
1.3.4 统计学方法 采用SPSS 11.5统计软件包进行统计分析,数据以均数±标准差(x-±s)表示。组间整体比较采用单因素方差分析,组间两两比较采用SNK-q法,比较辛伐他汀药物组间破骨细胞数及TNF、MCP细胞因子的差异,以P<0.05为差异有统计学意义。
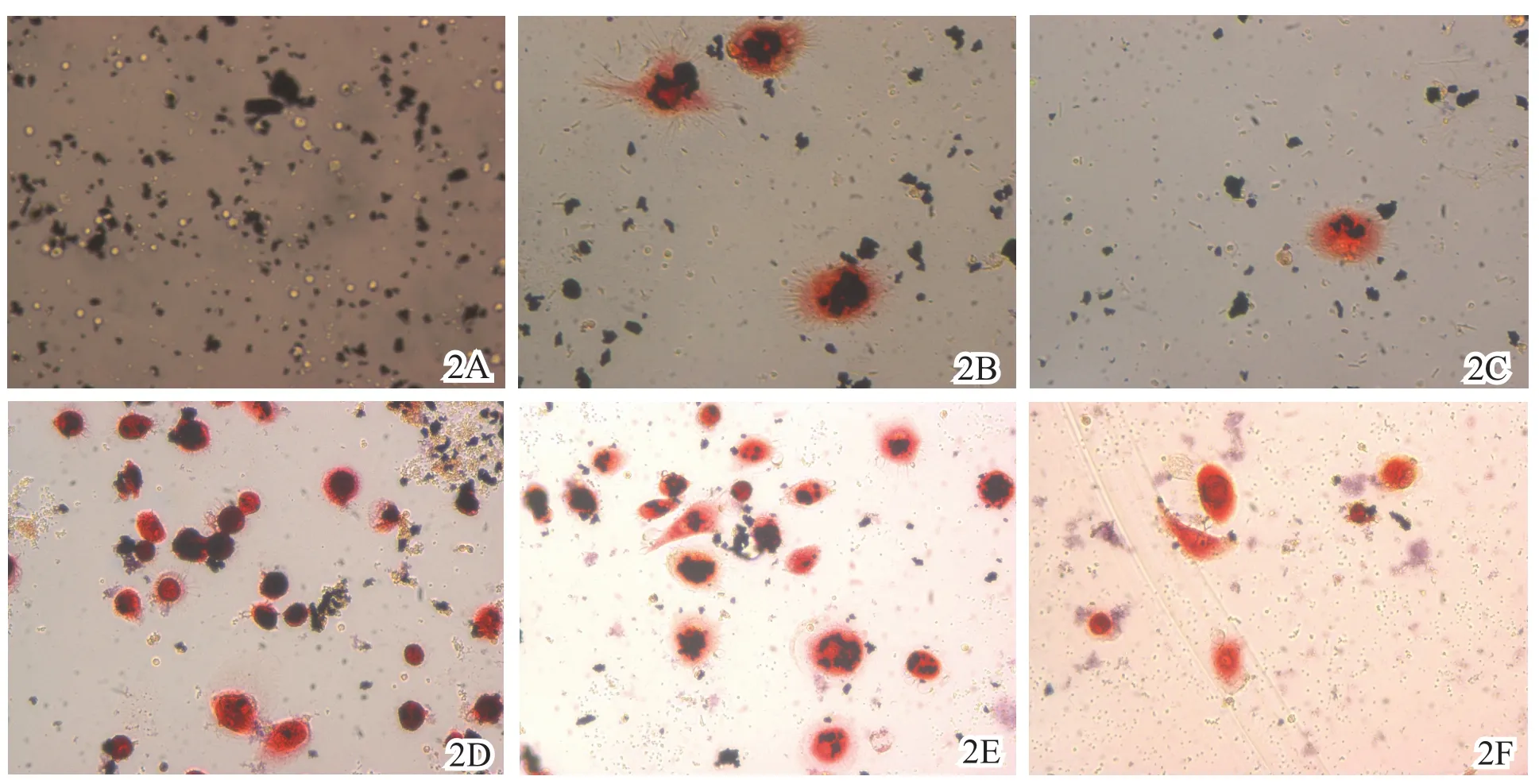
图2 2A 10 d空白对照组 2B 10 d钛颗粒刺激组 2C 10 d 10-7mol/L辛伐他汀干预组 2D 1 8 d钛颗粒刺激组 2E 18 d 10-7mol/ L辛伐他汀干预组 2F 18 d 10-5mol/L辛伐他汀干预组(TRAP染色,×40)

表1 辛伐他汀对钛颗粒刺激单核/巨噬细胞形成破骨细胞的比较(n=10,x-±s)
2 结果
2.1 光镜及扫描电镜观察结果
如图2所示,TRAP染色阳性的破骨细胞胞体大,形态不规则,胞质内可见较多桔红色颗粒,核淡染,可见伪足伸出;细胞培养10 d时,钛颗粒刺激组及10-7mol/L辛伐他汀组均有少量破骨细胞形成,细胞核数目较少;细胞培养至18 d,破骨细胞数和细胞核数目明显增多。各组破骨细胞形成的比较结果(表1)提示,A组的破骨细胞数明显多于B、C、D组(P<0.001),C、D组之间差异无统计学(P=0.078),而B组与C、D组之间有显著性差异(P<0.001);辛伐他汀干预组与钛颗粒刺激组相比骨陷窝数明显减少(图3),差异均有统计学意义(P<0.05)。
2.2 细胞因子检测结果
如表2所示,钛颗粒刺激组TNF-α及MCP-1的含量明显高于其它组,差异具有显著性意义(P<0.001);与其他辛伐他汀组比较,钛颗粒刺激+10-5mol/L辛伐他汀组抑制磨屑刺激人单核/巨噬细胞分泌TNF-α及MCP-1的过程呈剂量依赖性,差异具有统计学意义(P<0.05)。
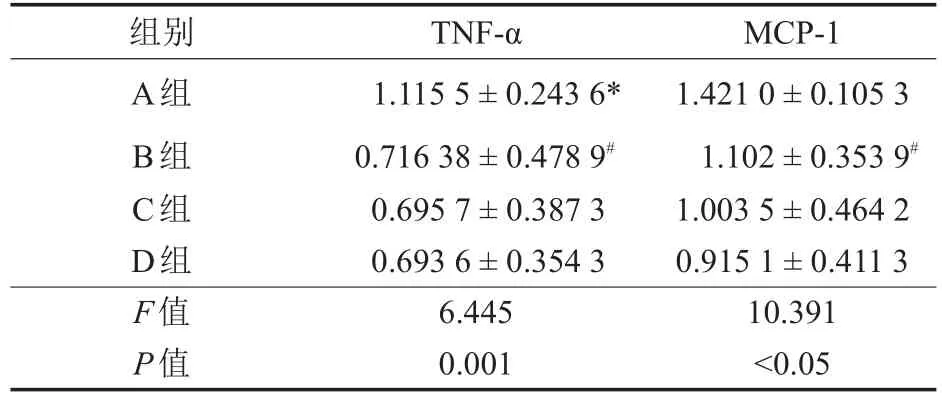
表2 辛伐他汀对钛颗粒刺激单核/巨噬细胞TNF-α及MCP-1的影响,用OD值表示(n=10,x-±s)
3 讨论

图3 骨片扫描电镜结果(×1 000)
手术技术、假体设计工艺的提高以及高耐磨材料的使用,大大降低了人工关节松动的发生率,目前限制该技术发展的主要问题是假体周围磨损微粒诱导的骨溶解所导致的假体松动。随着新一代金属假体的应用,金属磨损产物在人工关节无菌性松动中的作用日益受到重视。人工关节磨损产物刺激人单核巨噬细胞产生大量溶骨性因子,如TNF-α、IL-1β、IL-6等,其中TNF-α被认为是引起骨吸收的最重要的炎性细胞因子之一[4]。我们以往的研究证实,钛颗粒刺激培养的巨噬细胞,可以产生大量的TNF-α、IL-1、IL-6[5]。国外学者的研究显示,在骨质溶解患者的假体周围组织中,MCP-1等趋化因子呈阳性表达。将巨噬细胞、成纤维细胞、聚甲基丙烯酸甲酯、钛颗粒进行共培养,可以发现趋化因子表达增加[6,7]。Kaufman等[8]采用蛋白组学方法检测巨噬细胞分泌的30种细胞因子和趋化因子含量,发现金属颗粒刺激产生的炎性因子最多,而IL-1、TNF-α和MCP-1被认为是骨溶解的始动因子,与人工关节松动假体周围骨吸收密切相关。MCP-1促进单核/巨噬细胞合成和分泌TNF-α的特性在体外实验中也得到证实,反之,TNF-α亦可刺激单核细胞分泌MCP-1[9,10]。体外实验中,激活的淋巴细胞、内皮细胞、巨噬细胞、成纤维细胞、平滑肌细胞等多种细胞均可产生MCP-1,IL-1β、IL-6、TNF-α等炎性细胞因子均可促进MCP-1表达,从而加速破骨细胞形成,参与骨吸收过程。因此,本实验通过抑制TNF-α、MCP-1表达以减少破骨细胞数目,从而达到抑制骨溶解的目的。
他汀类药物即3-羟基-3-甲基戊二酸单酰辅酶A(3-hydroxy-3-methyglutaryl-coenzyme A,HMGCoA)还原酶抑制剂,是广泛应用于临床的降脂药物,可通过抑制HMG-CoA还原酶进而减少甲羟戊酸的合成,而甲羟戊酸通路又是N-二膦酸盐抑制破骨细胞骨吸收的主要途径[11]。由此可见,他汀类药物对破骨细胞形成的抑制主要是通过抑制甲羟戊酸途径而在胆固醇合成途径的早期发挥作用。体外实验已经证明他汀类药物可以影响破骨细胞的骨吸收[12],近期研究亦表明他汀类药物可以明显抑制巨噬细胞产生TNF-α及MCP-1[13,14];本实验的研究结果证实,辛伐他汀可通过抑制外周血单核细胞分泌TNF-α及MCP-1而达到减少破骨细胞的形成进而抑制骨溶解的作用,有望成为防治无菌性人工关节松动的药物。
1 Keener JD,Callaghan JJ,Goetz DD,et al.Twenty-five-year results after Charnley total hip arthroplasty in patients less than fifty years old:a concise follow-up of a previous report[J].J Bone Joint Surg Am,2003,86-A(6):1066-1072.
2 Mundy G,Garrett R,Harris S,et al.Stimulation of bone formation invitro and in rodents by statins[J].Science,1999, 286(5446):1946-1949.
3 van-de-Wijngaert FP,Burger EH.Demonstration of tartrateresistant acid phosphatase in un-decalcified,glycolmethacrylate-embedded mouse bone:a possible marker for(pre) osteoclast identification[J].J Histochem Cytochem,1986,34 (10):1317-1323.
4 Boyce BF,Li P,Yao Z,et al.TNF-alpha and pathologic bone resorption[J].Keio J Med,2005,54(3):127-131.
5 陈志荣,张亮,吴兴临,等.依那西普对磨屑诱导骨溶解影响的实验研究[J].中国矫形外科杂志,2008,16(4):285-287.
6 Fritz EA,Glant TT,Vermes C,et al.Titanium particles induce the immediate early stress responsive chemokines IL-8 and MCP-1 in osteoblasts[J].J Orthop Res,2002,20(3):490-498.
7 Fritz EA,Glant TT,Vermes C,et al.Chemokine gene activation in human bone marrow-derived osteoblasts following exposure to particulate wear debris[J].J Biomed Mater Res A, 2006,77(1):192-201.
8 Kaufman AM,Alabre CI,Rubash HE,et al.Human macrophageresponsetoUHMWPE,TiAlV,CoCr,andalumina particles:analysis of multiple cytokines using protein arrays [J].J Biomed Mater Res A,2008,84(2):464-474.
9 Robinson SC,Scott KA,Balkwill FR.Chemokine stimulation of monocyte matrix metalloproteinase-9 requires endogenous TNF-alpha[J].Eur J Immnol,2002,32(2):404-412.
10 Rovin BH,Yoshiumura T,Tan L.Cytokine-induced production of monocyte chemoattractant protein-1 by cultured human mesangial cells,1992,148(7):2148-2153.
11 Cruz AC,Gruber BL.Statins and osteoporosis:can these lipidlowering drugs also bolster bones?[J].Cleve Clin J Med, 2002,69(4):277-288.
12 Staal A,Frith JC,French MH,et al.The ability of statins to inhibit bone resorption is directly related to their inhibitory effect on HMG-CoA reductase activity[J].J Bone Miner Res, 2003,18(1):88-96.
13 Laing AJ,Dillon JP,Mulhall KJ,et al.Statins attenuate polymethylmethacrylate-mediated monocyte activation[J].Acta Orthopaedica,2008,79(1):134-140.
14丁悦,秦础强,马若凡,等.磨损颗粒刺激巨噬细胞引起人工关节松动的作用机制[J/CD].中华关节外科杂志(电子版), 2008,2(4):435-439.
(本文编辑 陈娜)
Effect of simvastatin on inhibiting osteoclasts cytomorphosis from PBMC stimulated by Ti particles
WANGZhen*,GAO Xi-wu,SUN Ke-ning,JIN Qun-hua.*Graduate school ofNingxia Medical University,Yinchuan 750004,China
JIN Qun-hua,E-mail:jinqunhua@sina.com
Objective To investigate the effect of simvastatin on inhibiting osteoclasts cytomorphosis from PBMC stimulated by Ti particles,and the potential prevention effect on the aseptic loosening of prosthesis. Methods In vitro human peripheral blood mononuclear cells(PBMC)were separated,cultured into five groups,as group A:PBMC and Ti particles,group B:PBMC and Ti particles with 10-5mol/L simvastatin,group C: PBMC and Ti particles with 10-6mol/L simvastatin,group D:PBMC and Ti particles with 10-7mol/L simvastatin,group E:PBMC group.The productions of TNF-α and MCP-1 in the suspension of each group were tested by ELISA.After 10 and 18 days incubation,osteoclasts were counted by TRAP-positive staining and their functions were assessed by absorption laeuna using scanning electron microscope(SEM)on the slice.Results The productions of TNF-α,MCP-1 from PBMC stimulated by Ti particles were inhibited when simvastatin was used, the numbers of osteoclasts and absorption laeuna in the treatment groups were lesser than in the Ti induced group (P<0.05).Conclusion Simvastatin can inhibit bone absorptive factors expression induced by wear particles.As a result,it may be applied to prevent and treat aseptic loosening of prosthesis.
Simvastatin;Osteoclasts;Monocytes;Titanium;Osteolysis
R687.4,R96
A
1674-666X(2009)02-0125-04
10.3969/j.issn.1674-666X.2009.02.012
750004宁夏银川,宁夏医科大学研究生院(王真,高希武,孙克宁);宁夏医科大学附属医院骨三科(高希武,金群华)
金群华,E-mail:jinqunhua@sina.com

