含CPT-11时辰化疗的联合方案治疗晚期恶性肿瘤的临床研究
周兆飞, 陆建伟, 尹必俭, 刘德林, 冯继锋, 林斌勋, 潘良喜
伊立替康(Irinotecan, CPT-11)是拓扑异构酶I的特异性抑制剂,可有效治疗结直肠癌、胃癌、小细胞及非小细胞肺癌、食管癌等多种肿瘤[1]。目前在欧美等国家,以CPT-11为主的联合化疗方案已被批准作为治疗晚期结直肠癌的一线治疗方案。但含CPT-11化疗方案的主要毒副反应是迟发性腹泻与中性粒细胞减少。时辰化疗是根据生物24 h昼夜节律的变化,选择化疗药物合适的用药时间,可以在提高药物疗效的同时减少药物毒性。2004年11月至2008年1月我科应用含CPT-11的时辰化疗方案治疗45例晚期恶性肿瘤患者,现将治疗结果报道如下。
1 资料与方法
1.1 临床资料 2004年11月至2008年1月,我科应用含CPT-11的时辰化疗方案治疗45例晚期恶性肿瘤患者。其中男性32例、女性13例。年龄25~78 岁,中位年龄57岁。所有病例均有病理组织学诊断依据。结肠癌14例、直肠癌9例、胃癌15例、食管癌3例、非小细胞肺癌2例、小细胞癌2例。转移部位包括淋巴结转移21例、肝转移16例、肺转移8例、网膜转移4例、骨转移2例、其他部位转移4例,其中有2个以上脏器转移8例。初次化疗16例,既往接受化疗:22例1个方案、5例2个方案、2例3个以上方案。治疗前血常规、肝肾功能、心电图基本正常。Karnof sky评分≥60。
1.2 治疗方法 使用法国Aguettant公司发明生产的“melodie”四通道程控输液泵,接受电脑编程,选择正弦曲线形式的时辰给药。胃癌及结直肠癌:CPT-11 180 mg/m2给药时间为2:00—8:00,持续输注6 h,给药高峰5:00,第1天;5-Fu 600 mg/m2/d,CF 300 mg/m2/d,给药时间为22:00—次日10:00,不同输液通道同时持续输注12 h,给药高峰4:00,第2—5天。非小细胞肺癌、食管癌及小细胞癌:CPT-11 180 mg/m2给药时间为2:00—8:00,持续输注6 h,给药高峰5:00,第1天;PDD 25 mg/m2/d,常规静脉输注,第2—4天,每21天为1周期。2周期后评价疗效:完全缓解(CR)、部分缓解(PR)、稳定(SD),且无严重不良反应,可继续治疗到6周期。
1.3 疗效和毒副反应评价标准 疗效根据WHO实体瘤近期客观疗效评价标准,分为CR、PR、SD和进展(PD)。肿瘤进展时间(TTP)指化疗开始到肿瘤出现进展的时间。总生存期(OS)指化疗开始至死亡或末次随访的时间。毒副反应按WHO抗癌药物毒性反应分度标准分为0~Ⅳ度。胆碱能综合征分4级:0级,无胆碱能综合征;Ⅰ级,轻微胆碱能综合征,无需治疗;Ⅱ级,胆碱能综合征,需治疗;Ⅲ级,有明显的胆碱能综合征,必须治疗。
2 结果
2.1 客观疗效 45例患者共完成129个周期化疗,每例患者化疗平均周期数为2.9个周期,其中完成6个周期4例,5个周期2例,4个周期7例,3个周期8例,2个周期19 例,1个周期5例。化疗2个周期评价疗效,疗效达PR和SD的病例,继续予以相同方案化疗。22例可评价疗效的晚期结直肠癌患者中, CR 0例,PR 8例(36.4%),SD 9例(40.9%),PD 5例(22.7%);13例可评价疗效的晚期胃癌患者中,CR 0例,PR 5例(38.4%),SD 5例(38.4%),PD 3例(23.1%);小细胞癌2例均PR;食管癌2例PD,1例SD;非小细胞肺癌1例SD,1例PD。
2.2 随访结果 随访至2008年12月,45例患者中36例已死亡,除1例在化疗3个月后不明原因死亡外,其余患者死亡原因均与肿瘤进展有关。所有患者的中位肿瘤进展时间5.0(2~13)个月,中位生存时间为9.0(3~22)个月。其中胃癌和结直肠癌患者的中位肿瘤进展时间分别为5.0(2~11)个月、6.0(2~13)个月,中位生存时间分别为8.0(3~21)个月、13(4~22)个月。
2.3 毒副反应 45例患者均进行毒副反应评价。最常引起的毒副作用为恶心、呕吐,Ⅰ~Ⅱ度75.5%(50.4%周期),Ⅲ度8.9 %(3.1%周期)。血液学毒性主要为中性粒细胞数减少,Ⅰ~Ⅱ度51.1%(40.3%周期),Ⅲ~Ⅳ度13.3%(6.2%周期)。迟发性腹泻Ⅰ~Ⅱ度28.9%(24.8%周期), Ⅲ~Ⅳ度8.9%(3.1%周期)。其他的毒性反应均较轻,多为Ⅰ~Ⅱ度(见表1,表2)。
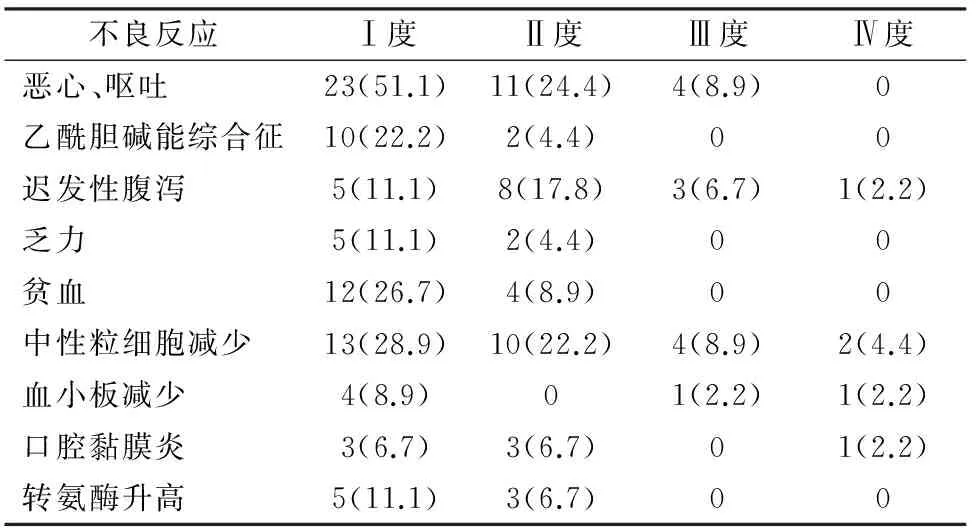
表1 45例患者化疗主要毒副反应[例(%)]
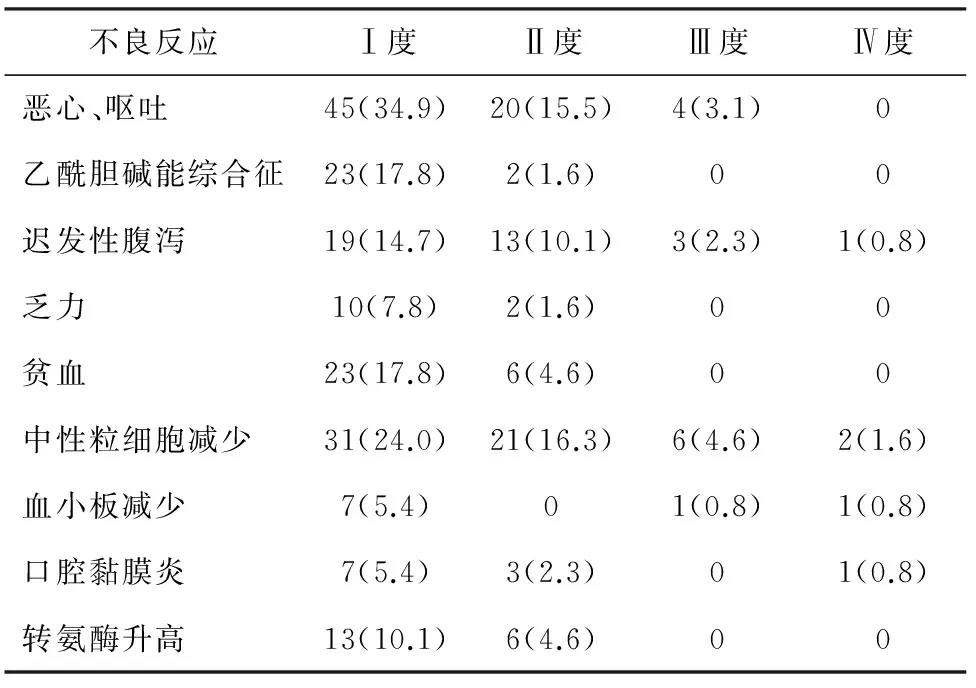
表2 129周期化疗主要毒副反应[周期(%)]
3 讨论
伊立替康(Irinotecan, CPT-11)是拓扑异构酶I的特异性抑制剂。伊立替康在大多数组织中经羧酸酯酶的作用产生活性代谢产物SN-38,SN-38抗肿瘤作用比伊立替康高100~1 000倍,CPT-11和SN-38通过与拓扑异构酶I的特异性反应而抑制DNA的合成。伊立替康在体内和体外研究中均有广谱的、强效的抗肿瘤活性,重要的是伊立替康和它的代谢物对表达多药耐药的肿瘤仍然有效,可有效治疗转移性结直肠癌、胃癌、小细胞及非小细胞肺癌、子宫颈癌、卵巢癌、食管癌等多种肿瘤[1]。剂量限制性毒性主要是迟发性腹泻与中性粒细胞减少。
任何生物体都有内在的生物节律调节中心,哺乳动物细胞昼夜节律调节中枢位于下丘脑基底部的视上核,使人体内在的生理活动随24 h明暗交替呈现昼夜节律变化。至少有9个特异基因(per1、per2、per3、cry1、cry2、tim、clock、bmal1、ckI)参与调节细胞的昼夜活动[2]。细胞的新陈代谢和增殖分化表现出24 h节律性,峰值和谷值在可预测的时间发生。动物试验发现骨髓、小肠、皮肤及口腔黏膜正常细胞的S期比例随24 h周期有超过50%的差异,细胞增殖低谷通常发生于午夜到凌晨,而高峰则在日间[3]。细胞的昼夜节律调节着抗癌药物的代谢动力学,使抗癌药物随给药时间的不同,其不良反应及抗癌活性也产生差异。肿瘤组织本身对细胞毒性药物的敏感性具有节律性[4]。根据生物节律的变化,选择适宜的用药时间, 可以提高药物的疗效, 减少药物的毒性,即“时辰化疗”[5]。5-FU、LV、L-OHP时辰化疗已有较多的文献报道,我们采用奥沙利铂联合5-FU、醛氢叶酸钙时辰治疗晚期胃癌取得了较满意的疗效[6]。但CPT-11时辰化疗临床报道较少。CPT-11是细胞周期特异性药物,延长给药时间可使S期细胞更长时间暴露在药物中, CPT-11更好地转化为活性代谢产物SN-38, SN-38 抗肿瘤作用比伊立替康高100~1 000倍,同时伊立替康与拓扑异构酶Ⅰ和DNA 形成的复合物也更牢固[7]。动物实验显示CPT-11在荷骨肉瘤小鼠休息期的后半部分(相当于凌晨5点左右)给药耐受性最佳[8]。根据动物实验的结果,在临床进行的Ⅰ、Ⅱ期研究也发现CPT-11 时辰给药(6 h连续静脉输注,给药高峰凌晨5点)可以安全提高药物剂量[9]。Carlo Garufi[7]等Ⅱ期随机研究比较CPT-11 6 h时辰给药(给药高峰凌晨5点)及1 h常规静脉输注联合5-FU、LV时辰给药治疗转移性大肠癌,结果有效率25.7% vs 18.2%,肿瘤无进展生存期(PFS)8.0个月vs 6.0个月,中位生存时间(MST)28.0个月vs 18.0个月。
CPT-11 联合5-FU、CF化疗方案治疗晚期胃肠道癌已有较多的文献报道。Saltz等[10]报道, CPT-11 +5-FU/LV方案治疗晚期结直肠癌的有效率为39%, Ⅲ~Ⅳ度中性粒细胞减少发生率为31.4%,Ⅲ~Ⅳ度迟发性腹泻为23%。日本临床肿瘤研究组亦报道采用CPT-11联合5-FU /CF治疗晚期结直肠癌有近80%患者曾有腹泻,其中Ⅲ~Ⅳ度腹泻为18.0%[11]。治疗中中性粒细胞减少很常见,占76.1%,Ⅲ~Ⅳ度中性粒细胞减少为40.0%。Yilmaz等[12]报道CPT-11/5-FU/LV方案治疗晚期胃癌总有效率为36%,Ⅲ~Ⅳ度中性粒细胞减少为20.0%,Ⅲ~Ⅳ度腹泻为16.0%。本研究中我们使用含CPT-11的时辰给药方案治疗晚期肿瘤主要观察毒副反应,结果显示,22例可评价疗效的晚期结直肠癌患者中, 有效率为36.4%;13例可评价疗效的晚期胃癌患者中,有效率为38.4%,均与国外CPT-11联合5-FU/LV方案有效率相近。最常见毒副反应是Ⅰ~Ⅱ度恶心、呕吐,中性粒细胞减少与迟发性腹泻,Ⅲ~Ⅳ度中性粒细胞减少与迟发性腹泻毒副反应相对较低。
综上所述,应用含CPT-11时辰给药方案治疗晚期恶性肿瘤疗效肯定,毒性反应轻,安全性好,值得临床进一步研究。
[1] 王巍.药品行政保护品种介绍:抗肿瘤药(四)[J].中国新药与临床杂志,2003,22(8):507.
[2] Dunlap JC. Molecular base for circadian clock [J].Cell,1999,96(2):271-290.
[3] Granda TG,Liu XH,Smaaland R,et al. Circadian regulation of cell cycle and apoptosis proteins in mouse bone marrow and tumor[J]. FASEB J, 2005,19(2):304-306.
[4] Granda TG, Lévi F. Tumor based rhythms of anticancer efficacy in experimenral models [J].Chronobiol int,2002 ,19(1) :21-41.
[5] Lévi F. Circadian chronotherapy for human cancers [J]. Lancet Oncol,2001,2(5) :307-315.
[6] Lu JW, Zhou ZF, Yin BJ,et al. Chronomodulated chemotherapy of oxaliplatin, 5-fluorouracil and folinic acid for advanced gastric cancer[J]. Zhonghua Zhong Liu Za Zhi,2005,27(11):695-697.
[7] Garufi C, Vanni B, Aschelter AM, et al.Randomised phaseⅡstudy of standard versus chronomodulated CPT-11 plus chronomodulated 5-fluorouracil and folinic acid in advanced colorectal cancer patients [J]. Eur J Cancer,2006,42(5):608-616.
[8] Granda TG,D'Attino RM, Filipski E ,et al . Circadian optimization of irinotecan and oxaliplatin efficacy in mice with Glasgow osteosarcoma [J] .Br J Cancer ,2002 ,86(6) :999-1005.
[9] Giaccheti S, Zidani R, Goldwasser F, et al. Chronomodulated CPT-11.A Polit Study[J]. Proc Am Soc Clin Oncol, 1999, 18(abstra 996):259a.
[10] Saltz LB, Cox JV, Blanke C, et al. Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer. Irinotecan Study Group[J].N Engl J Med, 2000, 343(3):905-914.
[11] Ohtsu A, Boku N, Yoshioka T, et al. A Phase Ⅱ study of irinotecan in combination with 120-h infusion of 5-fluorouracil in patients with metastatic colorectal carcinoma: Japan clinical oncology group study( JCOG9703) [J]. Jpn J Clin Oncol, 2003, 33 (1) : 28-32. abstr 4003.
[12] Yilmaz U, Oztop I, Alacacioglu A, et al. Irinotecan combined with infusional 5-fluorouracil and high dose leucovorin (FOLFIR2I) for the treatment of advanced gastric carcinoma as the first line chemotherapy[J]. J Clin Oncol, 2005, 23:348s.

