增强CT结合磁共振扩散加权成像在胸腺瘤诊断中的应用价值*
张砚满,张思琦,张青
(南通大学附属医院 1.医学影像科,2.病理科,江苏 南通 226001)
胸腺瘤是成人前纵隔较为常见的肿瘤,占所有胸腺上皮肿瘤的80%左右,通常生长缓慢,早期无明显症状,但随着病情进展,可出现胸痛、气促、咳嗽、声音嘶哑、乏力等症状,少数患者可能出现恶液质和发热等非特异性表现[1-2]。我国胸腺上皮肿瘤发病率略高于欧美国家[3]。2021年世界卫生组织将胸腺瘤分为A型、AB型、B1型、B2型、B3型、胸腺癌[4]。依据临床预后情况通常将A、AB、B1型纳入低危胸腺瘤,B2、B3型纳入高危胸腺瘤[5]。手术切除是低危胸腺瘤的主要治疗方式,而高危胸腺瘤及胸腺癌则需要额外辅助放化疗等以降低复发风险[6-7]。术前安全、准确地诊断胸腺瘤病情,可指导临床制订个体化精准治疗方案,对改善患者预后具有重要意义。
增强计算机断层成像(computerized tomography,CT)具有高空间及时间分辨率,成像方便迅速,美国国立综合癌症网络推荐增强CT作为胸腺瘤的首选检查方法[8]。磁共振成像(magnetic resonance imaging, MRI)的软组织分辨率、空间分辨率高,磁共振扩散加权成像(MRI-diffusion weighted imaging,MRI-DWI)可全方位反映肿瘤血流动力学过程及新生血管生物学特性,可增加检测肿瘤风险等级的准确性,目前已被用于胸腺瘤的评估[9]。目前已有增强CT、MRI诊断胸腺瘤的报道,但既往报道多集中于CT、MRI影像学特征[10-11],缺乏大量客观定量特征指标的报道,也鲜有客观定量指标对胸腺瘤危险性诊断效果的有关报道。鉴于此,本研究着重分析增强CT、MRI-DWI定量值在胸腺瘤诊断中的应用价值,以期为临床准确地评估胸腺瘤病情提供参考。
1 资料与方法
1.1 一般资料
回顾性分析2017年1月—2022年12月在南通大学附属医院经病理诊断确诊的胸腺瘤及胸腺癌患者204例。其中,低危胸腺瘤组患者98例,高危胸腺瘤组患者62例,胸腺癌组患者44例。纳入标准:①经病理确诊,且可查阅到完整的病理资料;②术前接受增强CT及MRI-DWI检查;③术前未接受任何形式治疗;④年龄> 18岁;⑤临床资料完整。排除标准:①伴其他部位肿瘤、有传染性疾病、过敏体质;②重要脏器功能障碍;③伴检查禁忌证;④存在医患沟通障碍;⑤有吸毒史、药物滥用史、胸腔手术史;⑥哺乳或妊娠者;⑦图像存在运动及金属等伪影;⑧伴其他胸腺疾病和肺部疾病;⑨接受放射、化学治疗者。本研究经医院医学伦理委员会审核批准,患者及其家属均签署知情同意书。3组性别构成、年龄、体质量指数、高血压占比、糖尿病占比、高脂血症占比比较,差异均无统计学意义(P>0.05),见表1。
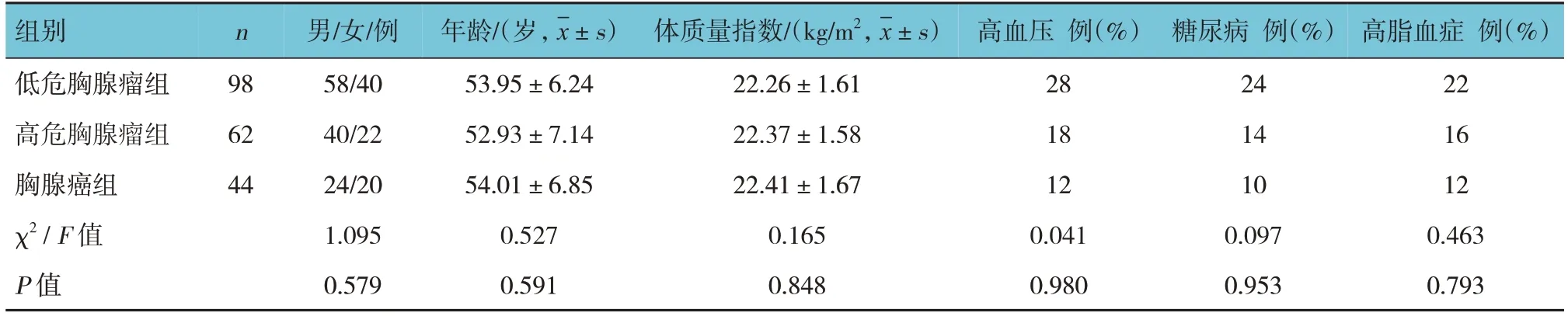
表1 3组患者一般资料比较
1.2 方法
1.2.1 增强CT检查 采用西门子双源炫速128排CT(德国西门子公司)扫描,行常规平扫和双期增强扫描,扫描范围自肺尖至肺底,参数设置:管电压120~140 kV,管电流600 mA,准直器宽度0.625 mm,层厚0.625 mm,重建层间隔0.625 mm。高压注射器在肘前静脉以3 mL/s速度注入对比剂碘佛醇(规格:350 mgI/mL),剂量1 mL/kg,注射后30 s及65 s进行动、静脉期扫描。增强动脉期、静脉期病灶最大层面薄层图像上沿病灶轮廓勾画感兴趣区,使用图像处理软件处理。由两位从业十年以上的主治医师盲法分析患者增强CT影像学资料,意见不一致时经讨论达成统一,从定性和定量两方面进行诊断分析,包括:形状(规则形/不规则形)、位置(中央/右侧/左侧)、边界(清楚/不清楚)、钙化、坏死、强化方式(均匀强化/不均匀强化)、脂肪浸润、淋巴结肿大、肿瘤大小、最大增强CT值(将横轴位图像病灶面积最大处作为感兴趣区,连续3个层面平均值为最终值,选取强化程度最大的一期测量值为最大增强CT值)、增强前后CT最大差值(CT增强值-平扫值,连续3个层面差值的平均值)。
1.2.2 MRI-DWI检查 患者取仰卧位,采用超导核磁共振扫描仪(德国Siemens公司MAGNETOM Vida 3.0型)及18通道相控阵柔软线圈扫描。脉冲序列,横轴位SE T1WI:重复时间(repeat time, RT)10 ms,回波时间(echo time, ET)2 ms;TSE T2WI:RT 1 600 ms,ET 75 ms;T2WI脂肪抑制序列:RT 2 000 ms,ET 76 ms,层厚4 mm,层间距1 mm,激励3次,视野为350 mm×350 mm,矩阵256×512。冠状位T2WI脂肪抑制序列:RT 915 ms,ET 80 ms,层厚5 mm,层间距1 mm,激励3次。所有患者MRI检查图像均传送至工作站,由两位从业八年以上的放射科医师独立盲法阅片、分析。在病变区域勾画感兴趣区,在病灶直径最大层面上相应的表观扩散系数(apparent diffusion coefficient, ADC)图上勾画,感兴趣区尽量选取相同位置,避开坏死区、囊变区与伪影区。包括:形态(规则形/不规则形)、位置(中央/右侧/左侧)、边界(清楚/不清楚)、信号(均匀/不均匀)、强化方式(均匀强化/不均匀强化)、强化程度(轻中度强化/明显强化)、脂肪浸润、淋巴结肿大、肿瘤大小、b =800 s/mm2时ADC值。
1.3 统计学方法
数据分析采用SPSS 18.0统计软件。计量资料以均数±标准差(±s)表示,比较做t检验或方差分析;计数资料以构成比或率(%)表示,比较做χ2检验;绘制受试者工作特征(receiver operator characteristic,ROC)曲线。P<0.05为差异有统计学意义。
2 结果
2.1 3组患者增强CT情况
低危胸腺瘤组、高危胸腺瘤组、胸腺癌组的形状构成、位置构成、钙化占比、坏死占比、强化方式构成、脂肪浸润占比、淋巴结肿大占比、肿瘤大小比较,差异均无统计学意义(P> 0.05)。低危胸腺瘤组、高危胸腺瘤组、胸腺癌组的边界构成、最大增强CT值、增强前后CT最大差值比较,差异均有统计学意义(P<0.05)。胸腺癌组边界不清楚构成比高于低危胸腺瘤组、高危胸腺瘤组(P<0.05),高危胸腺瘤组边界不清楚构成比高于低危胸腺瘤组(P<0.05);胸腺癌组最大增强CT值、增强前后CT最大差值均低于低危胸腺瘤组、高危胸腺瘤组(P<0.05),高危胸腺瘤组最大增强CT值、增强前后CT最大差值低于低危胸腺瘤组(P<0.05)。见表2。

表2 3组患者增强CT影像特征的比较
2.2 3组患者MRI-DWI检查情况
低危胸腺瘤组、高危胸腺瘤组、胸腺癌组的形状构成、位置构成、信号构成、强化方式构成、脂肪浸润占比、淋巴结肿大占比、肿瘤大小比较,差异均无统计学意义(P>0.05)。低危胸腺瘤组、高危胸腺瘤组、胸腺癌组的边界构成、ADC值比较,差异均有统计学意义(P<0.05);胸腺癌组边界不清楚构成比高于低危胸腺瘤组、高危胸腺瘤组(P<0.05),高危胸腺瘤组边界不清楚构成比高于低危胸腺瘤组(P<0.05);胸腺癌组ADC值低于低危胸腺瘤组、高危胸腺瘤组(P<0.05),高危胸腺瘤组ADC值低于低危胸腺瘤组(P<0.05)。见表3。
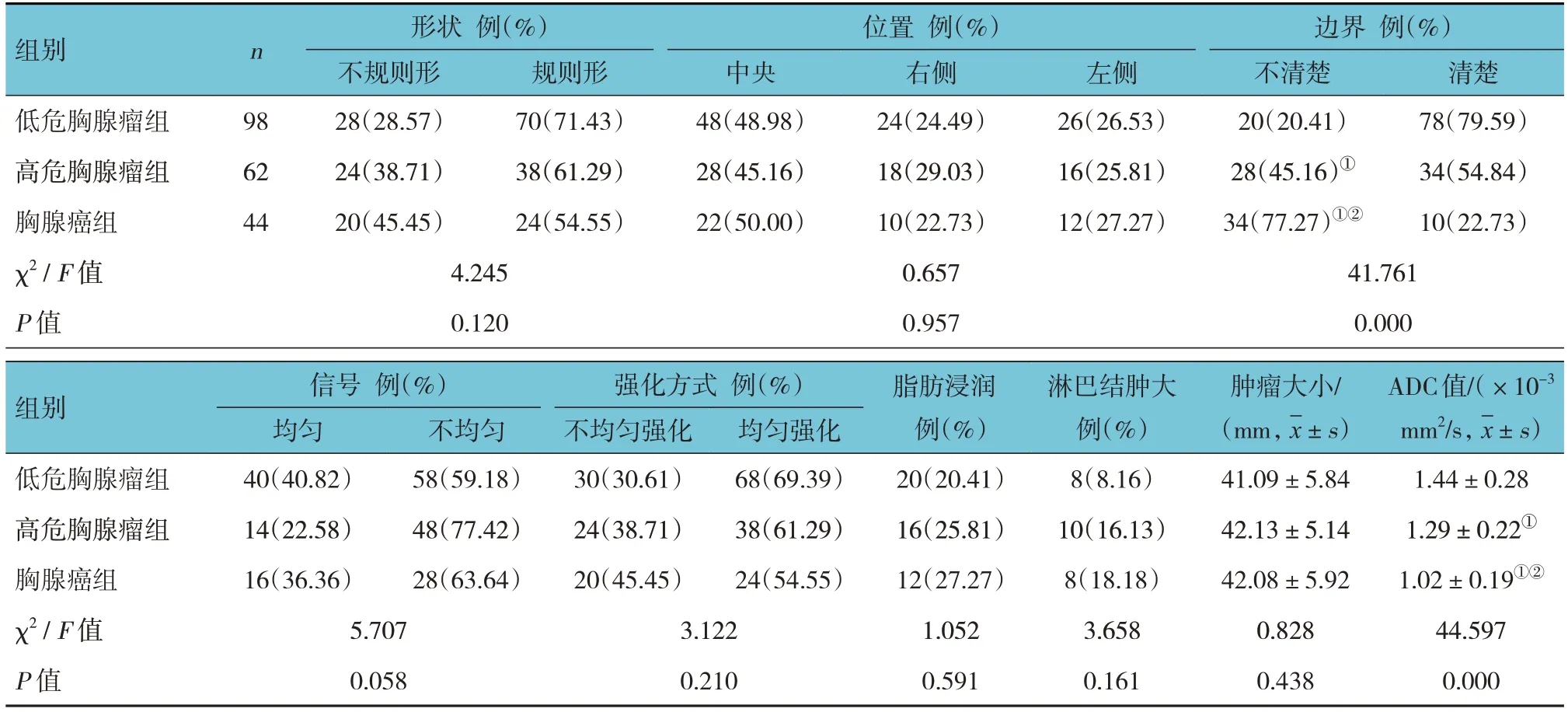
表3 3组患者MRI-DWI检查情况的比较
2.3 增强CT联合MRI-DWI诊断胸腺癌的价值
在胸腺瘤及胸腺癌患者中,ROC曲线分析结果显示,最大增强CT值、增强前后CT最大差值、ADC值及三者联合诊断胸腺癌的敏感性分别为68.19%(95% CI:0.451,0.853)、72.73%(95% CI:0.496,0.884)、77.27%(95% CI:0.542,0.913)、81.82%(95% CI:0.590,0.940),特异性分别为71.25%(95% CI:0.599,0.806)、77.50%(95% CI:0.665,0.858)、76.25%(95% CI:0.652,0.848)、92.50%(95% CI:0.838,0.969),曲线下面积分别为0.711(95% CI:0.604,0.817)、0.702(95% CI:0.594,0.810)、0.703(95% CI:0.586,0.821)、0.892(95% CI:0.824,0.960)。见表4和图1。

图1 增强CT联合MRI-DWI诊断胸腺癌的ROC曲线
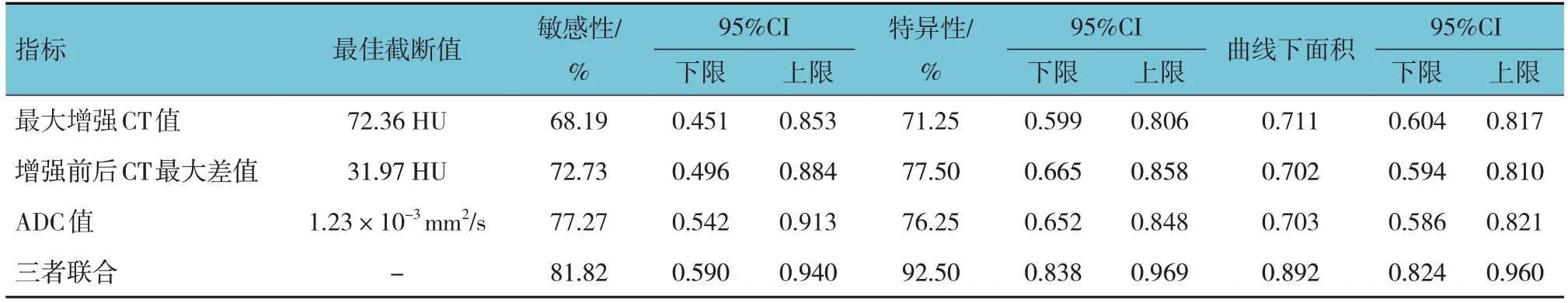
表4 增强CT联合MRI-DWI诊断胸腺癌的价值分析
2.4 增强CT联合MRI-DWI诊断高危胸腺瘤的价值
在胸腺瘤患者中,ROC曲线分析结果显示,最大增强CT值、增强前后CT最大差值、ADC值及三者联合诊断高危胸腺瘤的敏感性分别为67.74%(95% CI:0.485,0.827)、70.97%(95% CI:0.518,0.851)、74.19%(95% CI:0.551,0.875)、83.87%(95% CI:0.655,0.939),特异性分别为79.59%(95% CI:0.652,0.893)、73.47%(95% CI:0.587,0.846)、71.43%(95% CI:0.565,0.830)、85.71%(95% CI:0.721,0.936),曲线下面积分别为0.709(95% CI:0.603,0.816)、0.701(95% CI:0.588,0.814)、0.722(95% CI:0.608,0.836)、0.900(95% CI:0.835,0.965)。见图2和表5。
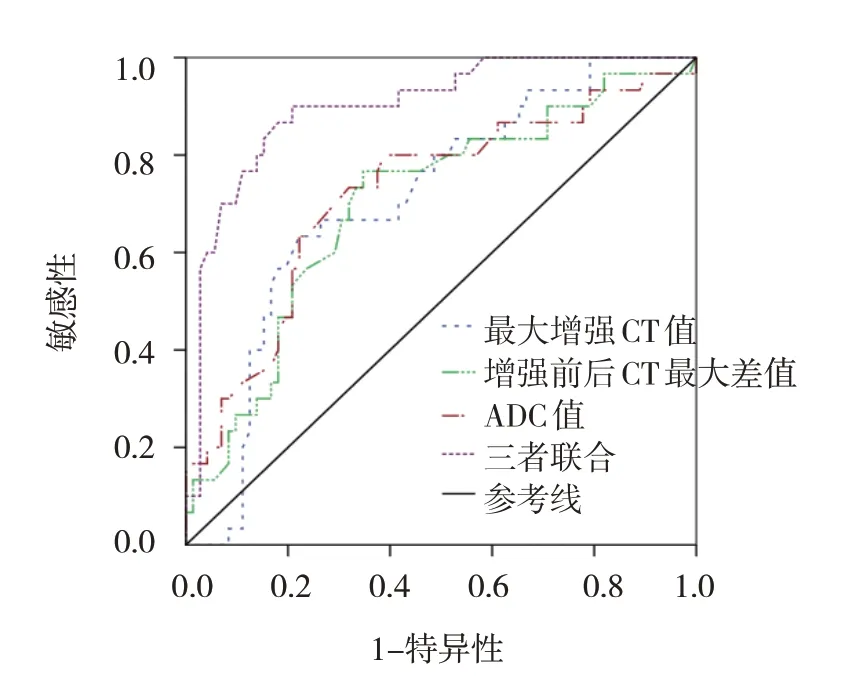
图2 增强CT联合MRI-DWI诊断高危胸腺瘤的ROC曲线

表5 增强CT联合MRI-DWI诊断高危胸腺瘤的价值分析
3 讨论
胸腺瘤占所有成人肿瘤的1%~5%,通常发生在中年或老年人群中,男女发病率无明显差异[12]。目前尚不清楚胸腺瘤的具体病因,但部分研究表明其与某些基因的变异、自身免疫反应等因素有关[13]。胸腺瘤的诊断通常需要通过临床表现、影像学检查、组织学和免疫组化检查等多种方法进行综合评估,治疗前多根据影像学检查来评估病情严重程度。增强CT是胸腺瘤治疗前的首选检查手段,其能够精准显示出胸腺肿瘤大小、位置、形态、密度、强化程度及与周围结构的关系。目前已有学者根据增强CT影像学特征评估胸腺瘤危险度的报道[14],但CT、MRI影像学特征评估胸腺瘤患者病情均需要后期复杂繁琐地分析处理,且缺乏特异性。近年来,MRI技术已在胸腺瘤诊断中广泛应用,相比其他影像学检查,其软组织分辨率更高,可以更加详细地观察胸腺瘤组织内部结构和血流情况[15]。本研究显示低危胸腺瘤、高危胸腺瘤、胸腺癌患者在增强CT、MRI-DWI影像学征象方面,边界不清是其主要表现特征,由于不同胸腺瘤病情患者增强CT、MRI-DWI特异性征象较为缺乏,因此探索出增强CT、MRI-DWI定量指标辅助诊断胸腺瘤病情具有重要意义。
本研究显示,胸腺癌组的最大增强CT值、增强前后CT最大差值、ADC值均低于胸腺瘤组,高危胸腺瘤组的最大增强CT值、增强前后CT最大差值、ADC值均低于低危胸腺瘤组,这与既往学者关于不同胸腺瘤危险度的CT强化程度研究结果一致[16-17],提示胸腺瘤患者最大增强CT值、增强前后CT最大差值、ADC值与其病情关系密切,随着病情严重程度增加,其值呈下降趋势。CT值是临床工作中较为容易得到的定量参数,有执行速度快、可用性广、客观等特点,增强后CT值、平扫和增强后CT值之间的差值是量化病变强化程度的常用的定量指标,能够反映病变区域血供情况。章婷婷等[18]研究显示,最大增强CT值、增强前后CT最大差值是胸腺瘤危险度的独立预测因子。金晶等[19]采用单因素方差分析研究发现,低危胸腺瘤患者的CT强化幅度比高危胸腺瘤患者、胸腺癌患者高,强化趋势与本研究结果基本一致。随着肿瘤进展,血管内皮完整性损伤及血管生长更明显,CT增强程度能够反映血供、血管内皮完整性,故胸腺瘤患者的CT增强程度能反映其病情进展。本研究结果显示,低危胸腺瘤患者CT强化程度高于高危胸腺瘤患者,这与上述理论不一致,笔者认为与以下原因有关:A型胸腺瘤细胞多表呈现梭形或纺锤形,AB型胸腺瘤一般由梭形上皮细胞及淋巴细胞混合组成,A型、AB型的梭形细胞多排列为血管外皮瘤样或微囊样,这是低危胸腺瘤组的最大增强值、增强前后最大差值高于高危胸腺瘤组的重要原因之一[20]。
DWI是MRI功能成像技术之一,MRI-DWI是目前唯一能够呈现细胞膜完整性信息、活体组织中水分子扩散运动的无创性影像学检查技术,可以明显反映出不同介质中水分子运动差异,可通过定量分析ADC值评估活体组织中水分子微观运动情况。胸腺癌等恶性肿瘤细胞生长、繁殖活跃,侵袭性强,肿瘤细胞生长增殖速度较快致使恶性肿瘤细胞呈现高密度,肿瘤细胞内部水分子运动受限,扩散作用不明显,使DWI采集信号强度改变,与胸腺瘤病变相比ADC值明显降低。张正平等[21]研究指出,ADC值在低危胸腺瘤、高危胸腺瘤、胸腺癌组间呈现明显下降趋势,胸腺癌患者扩散明显受限,ADC值较小。THUY等[22]研究指出,在低危胸腺瘤、高危胸腺瘤、胸腺癌患者中,低危胸腺瘤组ADC值最高,胸腺癌患者ADC值最低。ROC曲线分析结果显示,最大增强CT值、增强前后CT最大差值、ADC值三者联合诊断胸腺癌、高危胸腺瘤的敏感性、特异性、曲线下面积均最高,说明最大增强CT值、增强前后CT最大差值联合ADC值诊断高危胸腺瘤及胸腺癌效能良好,具有一定临床价值。
综上所述,最大增强CT值、增强前后CT最大差值联合ADC值辅助诊断高危胸腺瘤及胸腺癌效能良好。本研究仍存在不足之处,选择样本量有限,且为单中心回顾性研究,后期仍需增加样本量进行多中心研究来深入分析增强CT、MRI-DWI定量指标在胸腺瘤诊断中的应用价值,也会将新的MRI技术对胸腺瘤定性及分级作为研究重点。

