基于RANKL/RANK/OPG信号轴探讨骨痹通消颗粒对激素性股骨头坏死模型小鼠的治疗作用*
方祥,周正新,朱磊,芮仞,许茂玉,朱彩玉
(1.安徽中医药大学研究生院,安徽 合肥 230038;2.安徽中医药大学第一附属医院 骨科,安徽 合肥 230038)
股骨头坏死是一种早期发病隐匿的临床疑难疾病,临床分为创伤性与非创伤性两类。非创伤性的股骨头坏死往往是由于长期或者过量服用糖皮质激素,使股骨头血供受损,部分骨细胞或骨髓造血细胞和脂肪细胞死亡,股骨头出现缺血、坏死甚至塌陷,继而发展为髋关节功能障碍,这种又称为激素性股骨头缺血坏死(steroid-induced osteonecrosis of the femoral head, SONFH)[1]。该病发病率逐年上升,严重影响患者的活动能力和生活质量[2-3]。目前临床早期治疗一般服用降脂、抗凝与双磷酸盐等药物或者选择物理治疗方法,病情进展至晚期时只能进行人工髋关节置换手术[4],而指南药物治疗和手术治疗均可能存在诱发并发症、术后血栓、感染和二次手术等潜在的风险,同时给患者带来严重的经济负担,且这些治疗只能缓解患者的疼痛,不能减缓软骨退化和促进软骨修复。考虑到这一点,许多患者希望通过减缓软骨退化和软骨修复从根本上治疗SONFH。因此,从中医药中寻找有效防治方法成为重要的研究方向。
研究表明,糖皮质激素可直接与具有维持正常骨组织代谢及骨重塑作用的破骨细胞结合,破骨细胞在组织的存活时间延长、活性增加,导致股骨头中出现骨代谢紊乱现象,重塑失衡,从而引起骨量减少及骨稳态破坏,随着时间累积,这种破坏是不可逆的,最终结果是股骨头塌陷[5-6]。缺血、坏死、塌陷是SONFH的不同病理阶段,缺血是可逆的,而后两者均不可逆。SONFH的发病机制尚未完全明确,目前主要认同的有脂质代谢紊乱学说、血管内凝血学说、骨质疏松学说、细胞自噬学说等[7]。有文献报道,磷脂酰肌醇特异性磷脂酶Cγ2(phospholipase Cγ 2, PLCγ2)是机体或血管发生缺血缺氧的重要指标[8],骨保护素(Osteoprotegerin, OPG)、核因子-κB受体活化因子(receptor activator of nuclear factor-κB,RANK)和核因子-κB受体活化因子配体(receptor activator of nuclear factor kappa B ligand, RANKL)在骨的生长发育和重塑过程中发挥重要的调节作用[9]。骨碱性磷酸酶(bone alkaline phosphatase, BALP)、Ⅰ型前胶原氨基端延长肽(propeptide of typeⅠprocollagen, PINP)、组织蛋白酶K(Cathepsin K,CTSK)、抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase, TRAP)均与破骨细胞有关,是提高成骨细胞功能的关键基因[10],这表明SONFH的发生机制可能与骨代谢异常有关。
基于课题组前期研究,中医复方骨痹通消颗粒应用于SONFH患者的早中期已取得了好的疗效,骨痹通消方在增加血流灌注,抗血小板凝集等改善微循环方面的功效显著,其整体调节机体的内环境,可有效地缓解患者的术后疼痛,减少并发症的发生[11-12]。课题组还通过体内动物实验发现骨痹通消方在减少骨细胞凋亡,以及改善SONFH家兔模型的股骨组织形态学与空骨陷窝率方面效果明显[13],但该方在激素性股骨头坏死的骨代谢作用方面缺乏相关报道。因此,课题组从RANKL/RANK/OPG信号轴出发,同时设置目前临床公认对SONFH治疗具有显著疗效的通络生骨胶囊为对照组[14-15],进一步探讨骨痹通消颗粒治疗早期激素性股骨头坏死模型小鼠的骨代谢作用机制,为更好地运用中药治疗SONFH提供理论基础和治疗靶点。
1 材料与方法
1.1 实验动物
选择体重为20~23 g、7周龄的SPF级C57小鼠90只,购于安徽医科大学实验动物中心。实验动物生产许可证号:SCXK(皖)2017-001。实验动物使用许可证号:SYXK(皖)2017-005。实验通过安徽中医药大学第一附属医院实验动物中心伦理审批(动物伦理批号:AHUCM-mice-2020020)。
1.2 药物
骨痹通消颗粒组方:川芎10 g、丹参15 g、赤芍12 g、当归10 g、淫羊藿10 g、补骨脂15 g、何首乌15 g、肉桂6 g、土鳖虫10 g、川断10 g、甘草6 g(四川新绿色药业科技发展股份有限公司),中药购自安徽中医药大学第一附属医院中药房,通络生骨胶囊(批号:Z20040001,规格:0.5 g/粒,浙江弘盛药业有限公司)。
1.3 主要试剂与仪器
醋酸泼尼松龙注射液(H33020824,浙江仙琚制药股份有限公司),脂多糖(Lipopolysaccharide, LPS)(L263,合肥德尔谱生物科技有限公司),PBS[C10010500BT,赛默飞世尔(苏州)仪器有限公司],BALP(JYM0601Mo)、PINP(JYM0798Mo)(北京荣志海达生物科技有限公司),Goat anti-Mouse IgG(H+L)(ZB-2301))和Goat anti-Rabbit IgG(H+L)(ZB-2301)(北京中杉金桥生物技术有限公司),EZ-10 Total RNA Mini-Preps Kit(B618583)(上海生工生物工程技术服务有限公司),real-time PCR仪(IQ5)[孚约生物科技(上海)有限公司]。
1.4 方法
1.4.1 模型复制 选择90只SPF级C57小鼠适应性喂养7 d,按照随机数字表法将其中78只小鼠用于模型复制,腹腔注射LPS(10 μg/kg),间隔24 h后重复相同剂量,同时左侧臀肌注射醋酸泼尼松龙注射液(100 mg/kg),连续3 d[16]。另外12只设为空白对照组(NC组),同时间段注射等剂量的生理盐水。24 d后,随机抽取10只小鼠行核磁共振检测,根据影像学表现,判断SONFH小鼠模型复制是否成功[17-18]。
1.4.2 干预方法 再将模型复制成功的60只小鼠(死亡18只)分为模型(MC)组、骨痹通消颗粒(GBTX)组及通络生骨胶囊(PC)组,每组20只。参照《药理实验方法学》中小鼠与人剂量折算方法及预实验结果提示,GBTX组与PC组按剂量分别为3.0 g/(kg·d)、2.40 g/(kg·d)的骨痹通消颗粒与通络生骨胶囊相应药物进行灌胃。NC组与MC组分别灌胃等剂量生理盐水。于第12个周末予以剂量为30 mg/kg 的3%戊巴比妥钠麻醉后取材。
1.4.3 小鼠一般情况 观察各组小鼠的饮食、精神面貌、皮毛光泽顺滑度及行动能力等表现。
1.4.4 骨性标志物 采用酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测小鼠血清的BALP及PINP含量,室温血液自然凝固10~20 min,离心20 min(转速:2 000~3 000 r/min)。收集上清液,保存。按试剂盒说明书测定波长450 nm处光密度(optical density,OD)值。
1.4.5 Western blotting检测RANKL/RANK/OPG信号轴相关指标的蛋白表达 每组取骨组织100 mg,加入RIPA细胞裂解液1 mL,离心后提取蛋白;将蛋白煮变性后保存备用。经过灌胶、加样电泳、转膜(RANK转膜50 min;RANKL转膜50 min;OPG转膜50 min;PLCγ2转膜50 min;CTSK转膜50 min;TRAP转膜50 min),转膜结束后用5%脱脂奶粉室温封闭2 h;参考一抗的说明书稀释至合适的比例,4 ℃缓慢摇动孵育过夜;洗3次,参考二抗的说明书用PBST稀释至适当浓度(1∶10 000)室温孵育2 h;最后用试剂盒通过化学发光、显影、定影的步骤检测蛋白的表达。
1.4.6 实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction,qRT-PCR)检测RANKL/RANK/OPG信号轴相关指标的基因表达 液氮速冻骨组织100 mg将其研磨成粉末并加入1 mL的TRIzol溶液,匀浆后提取RNA,并测量其浓度和纯度;每组取质量为1 μg RNA逆转录成cDNA。反应体系:TB Green Premix Ex TaqⅡ 10 μL,正、反向引物(10 μmol/L)各0.8 μL,cDNA 2.0 μL,H2O 6.4 μL。反应条件:95 ℃预变性60 s;95 ℃变性,20 s,60 ℃退火60 s,共40个循环,以β-actin为内参,计算目的基因相对表达量(2-ΔΔCt)。引物序列见表1。

表1 qRT-PCR引物序列
1.5 统计学方法
数据分析采用SPSS 23.0统计软件。计量资料以均数±标准差(±s)表示,多组比较用方差分析,两两比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 SONFH小鼠模型复制结果
根据影像学结果,动物模型复制后,随机选取10只小鼠进行影像学核磁共振检查,核磁共振结果显示,横断面均显示小鼠左侧髋部高信号。见图1。

图1 核磁共振结果
2.2 各组小鼠一般状态
第12周灌胃结束后观察MC组小鼠发现:小鼠活动度减少,有8只小鼠出现跛行状态,精神倦怠,毛色暗淡偏黄无光泽、形体偏瘦;治疗组较MC组小鼠活动量增加,跛行情况好转,精神一般,毛色转亮。
2.3 各组小鼠BALP、PINP水平比较
ELISA结果显示,各组小鼠BALP、PINP水平经方差分析,差异均有统计学意义(P<0.05)。与NC组比较,MC组BALP、PINP水平均降低(P<0.05);与MC组比较,GBTX组、PC组BALP、PINP水平均升高(P<0.05);与GBTX组比较,PC组BALP、PINP水平差异无统计学意义(P>0.05)。见表2。
表2 各组小鼠BALP、PINP水平比较 (pg/mL,±s)
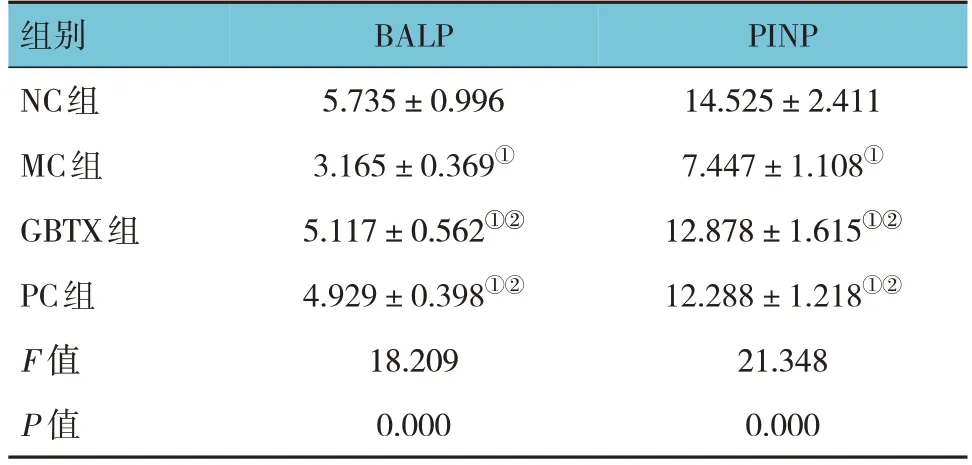
表2 各组小鼠BALP、PINP水平比较 (pg/mL,±s)
注:①与NC组比较,P<0.05;②与MC组比较,P<0.05。
组别NC组MC组GBTX组PC组F 值P 值PINP 14.525±2.411 7.447±1.108①12.878±1.615①②12.288±1.218①②21.348 0.000 BALP 5.735±0.996 3.165±0.369①5.117±0.562①②4.929±0.398①②18.209 0.000
2.4 各组小鼠RANKL/RANK/OPG信号轴相关指标的蛋白和基因相对表达量的比较
Western blotting和qRT-PCR检测结果显示,与NC组比较,MC组OPG蛋白和基因相对表达量均下降(P<0.05),RANK、RANKL、PLCγ2、CTSK、TRAP蛋白和基因相对表达量均升高(P<0.05);与MC组比较,GBTX组和PC组中OPG蛋白和基因相对表达量均升高(P<0.05),RANK、RANKL、PLCγ2、CTSK、TRAP蛋白和基因相对表达量均下降(P<0.05);与GBTX组比较,PC组OPG、RANK、RANKL、CTSK、TRAP蛋白和基因相对表达量,以及PLCγ2蛋白相对表达量差异均无统计学意义(P>0.05),而PC组PLCγ2基因相对表达量较GBTX组下降(P<0.05)。见表3、4和图2。
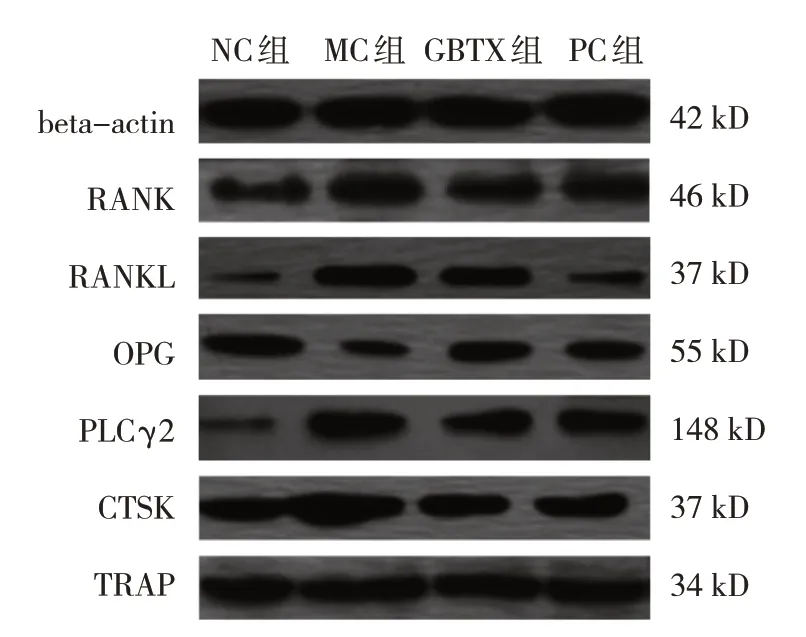
图2 各组小鼠RANK、RANKL、OPG、PLCγ2、CTSK、TRAP蛋白电泳图
表3 各组小鼠RANK、RANKL、OPG、PLCγ2、CTSK、TRAP蛋白相对表达量比较 (±s)
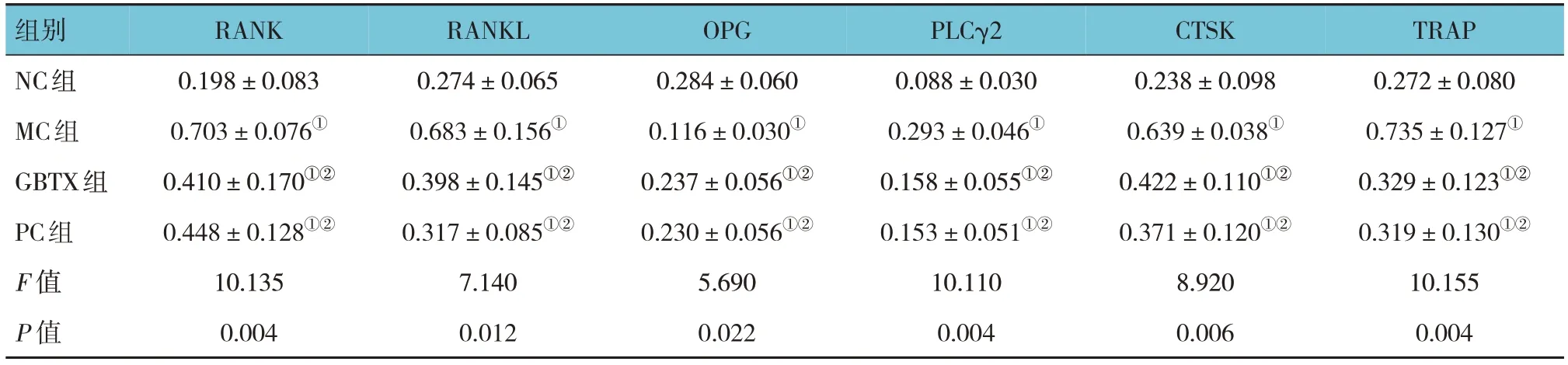
表3 各组小鼠RANK、RANKL、OPG、PLCγ2、CTSK、TRAP蛋白相对表达量比较 (±s)
注:①与NC组比较,P<0.05;②与MC组比较,P<0.05。
组别NC组MC组GBTX组PC组F 值P 值TRAP 0.272±0.080 0.735±0.127①0.329±0.123①②0.319±0.130①②10.155 0.004 RANK 0.198±0.083 0.703±0.076①0.410±0.170①②0.448±0.128①②10.135 0.004 RANKL 0.274±0.065 0.683±0.156①0.398±0.145①②0.317±0.085①②7.140 0.012 OPG 0.284±0.060 0.116±0.030①0.237±0.056①②0.230±0.056①②5.690 0.022 PLCγ2 0.088±0.030 0.293±0.046①0.158±0.055①②0.153±0.051①②10.110 0.004 CTSK 0.238±0.098 0.639±0.038①0.422±0.110①②0.371±0.120①②8.920 0.006
表4 各组小鼠RANK、RANKL、OPG、PLCγ2、CTSK、TRAP基因相对表达量比较 (±s)
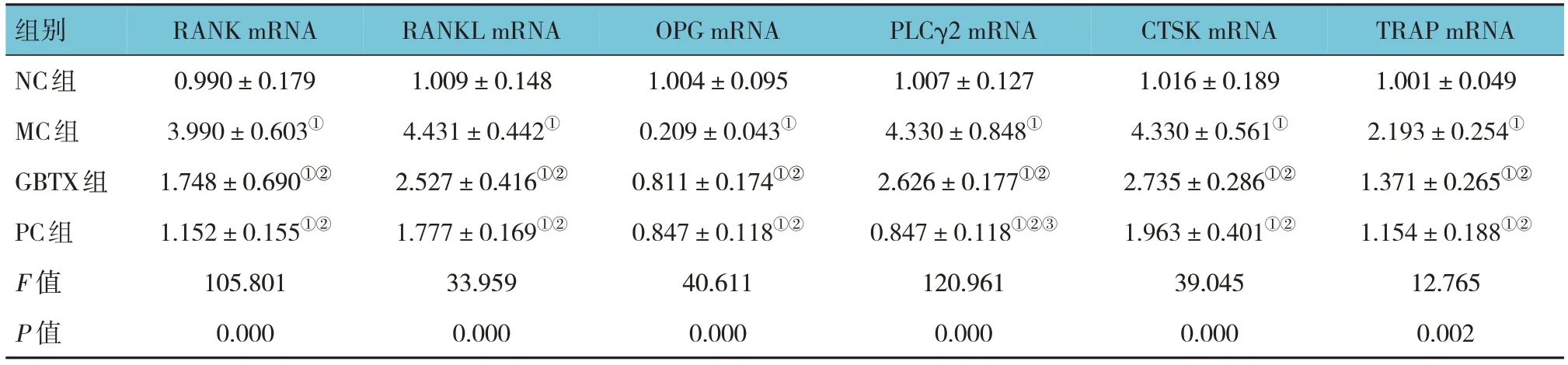
表4 各组小鼠RANK、RANKL、OPG、PLCγ2、CTSK、TRAP基因相对表达量比较 (±s)
注:①与NC组比较,P<0.05;②与MC组比较,P<0.05;③与GBTX组比较,P<0.05。
组别NC组MC组GBTX组PC组F 值P 值TRAP mRNA 1.001±0.049 2.193±0.254①1.371±0.265①②1.154±0.188①②12.765 0.002 RANK mRNA 0.990±0.179 3.990±0.603①1.748±0.690①②1.152±0.155①②105.801 0.000 RANKL mRNA 1.009±0.148 4.431±0.442①2.527±0.416①②1.777±0.169①②33.959 0.000 OPG mRNA 1.004±0.095 0.209±0.043①0.811±0.174①②0.847±0.118①②40.611 0.000 PLCγ2 mRNA 1.007±0.127 4.330±0.848①2.626±0.177①②0.847±0.118①②③120.961 0.000 CTSK mRNA 1.016±0.189 4.330±0.561①2.735±0.286①②1.963±0.401①②39.045 0.000
3 讨论
根据激素性股骨头缺血坏死的临床症状,可将其归为中医学“骨痹”“骨蚀”“骨痿”等范畴。《素问·长刺节论篇》中有关于最早“骨痹”的记载“骨重不可举,骨髓酸痛,寒气至,名骨痹……”。《灵枢·刺节真邪》篇中记载“虚邪之入于身也深,寒与热相搏,久则内著,寒胜其热,则骨痛而肉枯,热胜其寒,则烂肉腐肌为脓,内伤骨为骨蚀……”。中医认为骨痹的病机主要为血瘀与肾虚,早中期主要以“血瘀”为主,当治以活血化瘀止痛之法,晚期主要以“肝肾亏虚”为主,治当以补肝肾,强筋骨之法[19]。骨痹通消颗粒是在本院骨科专家丁锷教授结合多年临床实践经验总结出来的治疗股骨头坏死的经验方“骨蚀宁(Ⅰ、Ⅱ号)方”的基础上化裁而来[20-21]。课题组根据“损其有余,补其不足”和“活血、祛瘀、生新”等理论,提出“补肾活血通络”之法以达“标本兼顾,多靶点作用”之效。该方较骨蚀宁方去全蝎、水蛭、蜈蚣、地龙虫类药物引起毒副反应,增加具有活血化瘀,行气止痛的丹参、川芎、当归、赤芍和补肝肾、强筋骨作用的川断、何首乌,加以温肾助阳的淫羊藿、补骨脂,引火归元的肉桂。诸药合用,共奏补肾活血通络之功。
以往有文献报道,过量或长期地使用糖皮质激素可以延长破骨细胞的存活时间,发生早期的骨丢失[22]。而BALP通过骨转化速率和骨吸收状况反映成骨细胞的物理活性,PINP反应骨形成过程促进新骨生成,是受损骨组织或者关节修复好坏的重要指标,在小鼠骨组织损伤修复期,二者含量升高,则表示成骨细胞的分泌活跃,破骨细胞的分泌受到抑制,骨愈合好[23-24]。付大鹏等[25]的研究证明,RANKL/RANK/OPG信号轴在激素性股骨头坏死的分子机制中也发挥着中心作用。作为肿瘤坏死因子(tumor necrosis factor, TNF)配体家族成员之一的RANK及其配体RANKL是调节破骨细胞的存活和分化的关键因子,通过信号级联反应激活破骨细胞的成熟与分化以促进骨吸收,使得成骨细胞与破骨细胞之间的平衡被破坏,加速细胞的凋亡,导致机体骨代谢紊乱[26]。OPG是一种抑制骨吸收的TNF配体,具有负性调节作用,通过与RANK竞争结合RANKL,发挥着阻断破骨细胞的激活、分化与成熟,从而防止骨吸收过度,维持骨稳态的功能[27]。而在骨吸收过程中,CTSK与TRAP是骨破坏的经典标志物。CTSK将有机成分从骨基质中分离和降解,是破骨细胞中表达水平最高,溶骨活性最强的一种半胱氨酸蛋白酶,TRAP是破骨细胞特异性高表达的糖基化的含金属蛋白酶,在酸性条件下CTSK可以催化TRAP磷酸酯键的水解,直接参与破骨细胞的骨吸收过程[28-29]。PLCγ2是磷脂酶Cγ家族的亚基,对于血管内皮细胞增殖、分化有重要的调控作用,当机体处于缺氧、缺血状态时,PLCγ2过度表达,诱导细胞凋亡[30]。
本研究发现,骨痹通消颗粒能改善模型复制成功的SONFH小鼠的一般表现,通过同时上调BALP、PINP和OPG的蛋白与基因表达,下调RANKL、RANK、PLCγ2、CTSK和TRAP蛋白和基因表达,充分调节成骨细胞活动,起到相应的调节作用,继而抑制骨吸收,促进骨的合成修复,这表明骨痹通消颗粒可能是通过调节RANK/RANKL/OPG信号轴来从而改善股骨头缺血性坏死情况。

