猪流行性腹泻病毒荧光免疫层析检测试纸条的研制和应用
陈芷珊,陈滢锴,陈中婷,蒙淑玲,江明生,陈海兰,3,4*
(1. 广西大学动物科学技术学院,广西 南宁 530004;2. 广西壮族自治区兽用生物制品工程研究中心,广西 南宁 530004;3. 广西畜禽繁育与疾病防控重点实验室,广西 南宁 530004;4. 广西高校动物疫病预防与控制重点实验室,广西 南宁 530004)
猪流行性腹泻病毒(PEDV)属于冠状病毒科冠状病毒属的单股正链RNA病毒,可感染各日龄各品系的猪,引发猪流行性腹泻(PED)。PED是一种以腹泻、呕吐、脱水为主要特征的高度接触性肠道传染病,对哺乳仔猪危害最大,死亡率可高达100%[1]。猪流行性腹泻在1971年首次发现于英国,随后在欧洲和亚洲的部分国家相继流行,各地的哺乳仔猪大量被感染并发生死亡[2]。2007年在泰国暴发PED,给当地的养猪业造成了巨大损失[3]。2004年杜坚等[4]首次用血清学方法证实了广西猪场存在PEDV感染,但未出现大规模疫情暴发。2010年,中国首先于南方地区出现PED暴发,随后遍及全国各地,给中国的养猪企业造成了重大经济损失和影响[5]。近几年的调查结果表明,PEDV在广西的平均检出率最高为58.26%,表明PED在广西生猪养殖场中的危害不容忽视[6]。对PEDV感染的早期筛查是控制该病毒传播和PED疫情蔓延的关键,因此,建立一种PEDV现场快速检测方法对PED的防制有着重要意义。
常用的PEDV检测方法主要包括病原学检测方法和血清学检测方法,其中病原学检测方法包括常规反转录PCR(RT-PCR)、荧光定量PCR和环介导等温扩增技术(RT-LAMP),而血清学检测方法主要有间接免疫荧光(IFA)、病毒中和检测(VN)、酶联免疫吸附试验(ELISA)和免疫层析技术等[7]。RT-PCR和荧光定量PCR检测方法有较好的特异性和灵敏度,但是需要较高水平的专业能力和昂贵的设备支持,不适用于养殖场的现场快速检测。RT-LAMP具有引物特异性强,反应条件简单和时间短等优点,但由于反应需要多条引物,且相关试剂价格较高,限制了该方法在基层检测的普及[8]。VN检测试剂盒操作简便且无需专门设备,但检测结果的判断具有主观性,并且检测的重复性易受影响[9]。ELISA可用于大规模临床检测,但仍需要严格的操作技术和昂贵的仪器,不适用于PEDV急性感染的一线临床检测[10-11]。免疫层析技术具有检测快速、价格低廉、操作简单、携带方便、安全无污染等特点,适用于临床快速检测,但传统胶体金免疫层析技术的准确性和灵敏度有待提高[12]。荧光免疫层析技术 (LFIA) 是以荧光物质为信号源,建立在层析膜上的基于抗原抗体特异性免疫反应的新型膜检测技术。该检测技术将免疫荧光和免疫层析技术相结合,克服了传统胶体金免疫层系技术灵敏度较低的不足,且保留了快捷简便、价格低廉、不依赖仪器设备和专业技术人员等优点,被广泛运用于疾病检测、食品安全监测、环境监测等方面[13-16]。
本研究以羧基化量子点微球为标记材料,建立了一种用于PEDV现场快速检测的荧光免疫层析检测技术,可由养殖人员在现场直接完成PEDV感染的快速筛查,对及时制定正确有效的疫病防控措施具有重要意义。
1 材料与方法
1.1 主要试验材料
鼠抗PEDV单克隆抗体(货号:JN1401,批号:M20201109)购于北京金诺百泰生物技术有限公司;羊抗鼠IgG多克隆抗体(货号:D111024,批号:H318AA0001)购于生工生物工程(上海)股份有限公司;硝酸纤维素膜(NC膜,货号:500774047,批号:S019110264)由德国Sartorius公司提供;羧基化量子点微球购于北京纳晶生物科技有限公司;2-(N-吗啉代)乙磺酸(MES),碳二亚胺(EDC),N-羟基琥珀酰亚胺(NHS),牛血清白蛋白(BSA),硼酸钠和硼酸由美国Sigma公司生产;样品垫、结合垫、吸水纸和聚氯乙烯(PVC)底板等购于上海金标生物科技有限公司。
PEDV、猪圆环病毒2型(PCV2)和伪狂犬病毒(PRV),由广西大学动物科学技术预防兽医实验室分离保存;肠炎沙门菌(ATCC 14028)购于北京保藏生物科技有限公司;大肠杆菌(CMCC(B)44102)和金黄色葡萄球菌(CMCC(B)26003),由中国微生物菌种保藏中心提供;副溶血弧菌由广西大学水产病害实验室分离保存;猪轮状病毒(PoRV)和猪丁型冠状病毒(PDCoV)强阳性粪便样品,由广西兽医研究所收集和提供。
1.2 主要仪器和设备
ZQ2002微电脑自动斩切机、CTS300XYZ数控裁条机和HM3035三维化膜喷金仪由上海金标生物科技有限公司生产;荧光试纸条读值仪由北京纳诺金生物科技有限公司研制。
1.3 荧光免疫层析试纸条的制备和优化
1.3.1 量子点微球标记抗体的制备
取25 μL浓度为1 μmol/L的羧基化量子点微球,加入25 μL 20 mmol/L MES(pH=6.0),混匀后分别加入现配的0.5 μL 20 mg/mL EDC和0.5 μL 20 mg/mL NHS,混匀后超声5 min,再于37 ℃活化15 min。然后于8 000g离心20 min,弃去上清液。用25 μL 10 mmol/L MES(pH=6.0)重悬沉淀,加入10 μg PEDV抗体,混匀后置于37 ℃避光反应1 h,反应后用0.1 mol/L甘氨酸封闭30 min。5 510g离心15 min,弃去上清液后,用50 μL硼酸盐缓冲液(BB)重悬沉淀,再次离心弃去上清液。用复溶液(浓度为10 mmol/L的Tris缓冲液,pH=8.5,添加有10%蔗糖、10%海藻糖、0.5% BSA和0.2%吐温20)重悬沉淀,涂于结合垫上,37 ℃真空烘干3 h。
1.3.2 荧光免疫层析试纸条的组装与样品检测
利用接触式自动划膜仪将鼠抗PEDV单克隆抗体和羊抗鼠IgG多克隆抗体分别包被在NC膜上作为检测线及质控线,37 ℃烘干3 h。然后将固定有T线和C线抗体的NC膜、喷涂有量子点微球标记抗体的结合垫、样品垫和吸水纸依次粘贴到PVC底板上,并采用数控裁条机裁成3.0 mm宽的试纸条。
将60 μL样品滴加到样品垫上,室温放置10 min后,用波长为365 nm的紫外手电筒观察结果。若T线、C线均有条带出现,判定为阳性;若T线没有条带,C线有条带,则判定为阴性;若C线没有条带,则判定试纸条无效,需重新检测。
1.3.3 量子点微球标记抗体最佳复溶液体积的确定
将采用25 μL量子点微球体系标记好的抗体离心后,分别用150、300、600和900 μL复溶液重悬后,制备荧光试纸条,并用于样品的检测,根据试纸条显色程度确定最佳复溶液体积。
1.3.4 检测线和质控线抗体包被浓度的确定
分别采用0.3、0.5和1.0 mg/mL的鼠抗PEDV单克隆抗体和羊抗鼠IgG多克隆抗体包被T线和C线,并以PBST和稀释后的病毒液上样,测试试纸条T线、C线的显色程度。用不同浓度的抗体划膜,以相同样品上样测试,以试纸条显色程度确定T线、C线的划膜抗体浓度。
1.4 荧光免疫层析试纸条的性能考察
1.4.1 敏感性考察

1.4.2 特异性考察
利用荧光试纸条分别检测PoRV(强阳性猪粪便样品),PDCoV(强阳性猪粪便样品),PCV2病毒液(1.0×106TCID50/mL),PRV病毒液(1.0×106TCID50/mL),沙门菌(1.0×107CFU/mL),大肠杆菌(1.0×107CFU/mL),金黄色葡萄球菌(1.0×107CFU/mL)及副溶血球菌(1.0×107CFU/mL),并设置PEDV阳性对照和阴性对照,根据T线荧光信号判断试纸条的特异性。
1.4.3 临床样品检测
分别采用荧光试纸条和RT-PCR对50份样品(肠道组织或肛门拭子,由生猪养殖公司和第三方检测公司提供)中的PEDV进行检测,计算阳性符合率、阴性符合率和总符合率。使用试纸条进行检测时,取临床样品1 g,加入1 mL的样品稀释液,震荡混匀后离心,取60 μL上清液滴于样品垫位置,待10 min时观察C、T线显色结果及测定荧光值。对于RT-PCR,取临床样品1 g,加入3 mL PBS,反复冻融3后,提取核酸,反转录后分别以5′-AAGGCTCCATCATCTTTACG-3′和5′-ACTCCGATACGAG-TCTAGCG-3′为上下游引物,对PEDV的N基因进行PCR扩增。PCR反应程序为:94 ℃预变性2 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸90 s,30个循环;72 ℃延伸10 min。
2 结果
2.1 量子点标记最佳复溶液体积的确定
将25 μL羧基化量子点体系标记的抗体分别用150、300、600和900 μL复溶液重悬后涂布于结合垫上制备试纸条,检测PEDV阴性和阳性样品后根据试纸条显色程度确定最适复溶液体积。图1显示,各试纸条的C线的荧光显色均清晰,均无假阳性出现,膜面干净。但从阳性样品检测结果发现,用600 μL和900 μL体积的复溶液会导致T线不显色。用150 μL和300 μL复溶液重悬标记抗体制备的试纸条T线清楚,但用300 μL体积复溶液的试纸条结合垫比用150 μL体积复溶液的释放更全,可得出最佳复溶液体积为300 μL。

1~4. 复溶液体积分别为150、300、600和900 μL。
2.2 检测线和质控线抗体包被浓度的确定
采用不同浓度的鼠抗PEDV单克隆抗体和羊抗鼠IgG多克隆抗体分别包被T线和C线,并对阴性样品和阳性样品进行检测。由图2和图3可见,当试纸条T线包被浓度为0.5 mg/mL,C线包被浓度为0.3 mg/mL时,试纸条的显色清晰,且所耗抗体量少。因此,后续研究采用的T线包被浓度均为0.5 mg/mL,C线包被浓度均为0.3 mg/mL。

1. T线包被浓度0.3 mg/mL,C线包被浓度0.3 mg/mL;2. T线包被浓度0.5 mg/mL,C线包被浓度0.3 mg/mL;3. T线包被浓度1.0 mg/mL,C线包被浓度0.3 mg/mL。

1. T线包被浓度0.5 mg/mL,C线包被浓度0.3 mg/mL;2. T线包被浓度0.5 mg/mL,C线包被浓度0.5 mg/mL;3. T线包被浓度0.5 mg/mL,C线包被浓度1.0 mg/mL。
2.3 敏感性考察
将载毒量为1.0×104TCID50/mL的PEDV病毒液以1∶10、1∶20、1∶30、1∶35、1∶40和1∶50的比例进行稀释后,采用制备好的PEDV荧光试纸条对PEDV稀释液进行检测,平行重复5次,考察试纸条的灵敏度。根据图4试纸条显色程度,可知当病毒以1∶10、1∶20、1∶30和1∶35稀释时,T线均显色清晰;当病毒以1∶40和1∶50稀释时,T线显色不清晰,与阴性对照相似。采用荧光试纸条读值仪测定T线荧光值,结果如表1所示。对阴性样品重复检测的结果为294,故检测阈值确定为336。由表1可见,当病毒以1∶50稀释时,T线荧光值为369,大于阈值。因此,所制备的荧光试纸条基于肉眼观察和荧光试纸条读值仪的检测限分别确定为2.9×102TCID50/mL和2.0×102TCID50/mL。
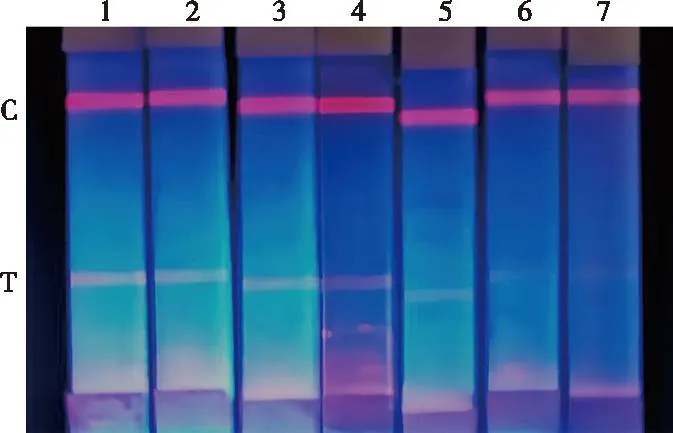
1~6. 病毒液稀释倍数为10、20、30、35、40、50;7. 阴性对照。

表1 试纸条灵敏度试验荧光值
2.4 特异性测定
使用所制备的荧光免疫层析试纸条对PoRV、PDCoV、PCV2、PRV、沙门菌、大肠杆菌、金黄色葡萄球菌及副溶血球菌进行检测,结果如图5所示。可见,只有检测PEDV阳性样品时,试纸条T线清晰可见;而检测其他病原时,结果如检测阴性样品一致,均无T线显示,说明试纸条特异性较好。

1~10. 分别为阴性样品、PEDV、PoRV、PDCoV、PCV2、PRV、沙门菌、大肠杆菌、金黄色葡萄球菌、副溶血球菌。
2.5 临床样品检测
分别采用荧光试纸条和RT-PCR对50份临床样品进行检测,结果如表2所示。根据表2结果,计算得到的PEDV荧光免疫层析试纸条与RT-PCR的阳性符合率为76.2%,阴性符合率为89.7%,总符合率为90.0%,说明所制备的PEDV荧光试纸条具有较高的准确性。

表2 试纸条和RT-PCR临床样品检测
3 讨论
PED主要经粪-口传播,随粪便排出的病毒可形成气溶胶颗粒随空气进行远距离传播感染其他仔猪,最远传播距离可达10英里[17-18]。PEDV感染后,猪可出现腹泻、呕吐、厌食、脱水和体重减轻等临床症状,哺乳仔猪大量死亡,给养猪业造成了巨大的经济损失[19-20]。研究发现,PEDV感染早期的治愈率远高于后期,所以PEDV感染的早期诊断对PED的防控尤其重要[21]。
量子点又称半导体纳米晶体,是一种稳定的纳米晶粒,具有发光率高、寿命长、光稳定性好等优势[22]。近年来,量子点制备和表面修饰技术得到了快速发展,量子点作为荧光探针在生物医学、食品安全等领域中应用越来越广泛[22-23]。PEDV荧光免疫层析将免疫荧光和免疫层析技术相结合,在保留胶体金免疫层析技术操作简单、不依赖专业实验室和设备、快速方便的优势的前提下,通过包含有大量量子点粒子的羧基化量子点微球作为标记材料,可有效提高试纸条的灵敏度和稳定性,实现生猪养殖场PEDV的现场快速准确检测。
量子点标记抗体时,使用不同体积的复溶液会导致单位体积内的量子点量标记抗体量的变化,进而使每根试纸条上所包含的量子点微球标记抗体的含量不同。量子点和标记抗体量较少时,会影响T、C线的显色程度,易产生假阴性;量子点和标记抗体量较多时,会影响量子点的扩散,导致较多的量子点留在结合垫或使膜面不清晰,造成量子点和抗体的浪费,甚至出现假阳性。因此,对复溶液的用量进行优化能使试纸条检测在耗费最少的情况下获得最优结果。本研究发现,在25 μL量子点微球标记体系下,600 μL以上的复溶液会导致T线不显色,而150 μL以下的复溶液会造成释放不充分,300 μL复溶液重悬标记抗体制备的试纸条T线清楚,释放完全,膜面干净。
本研究制备的PEDV量子点荧光免疫层析试纸条,基于肉眼观察和荧光试纸条读值仪的检测限分别为2.9×102TCID50/mL和2.0×102TCID50/mL。边红芬等[24]基于细胞表面荧光免疫吸附法制备单克隆抗体,研制出一种用于PEDV现场检测的新型免疫层析方法,最低检测限为7.8×103TCID50/mL。王华俊等[25]建立了一种快速、定量检测PEDV的时间分辨荧光免疫层析检测方法,对PEDV的最低检测限为3 896 997 TCID50/mL。Lyoo等[26]开发了一种用于PEDV检测的胶体金免疫层析试纸条,检测限为1.0×104TCID50/mL。因此,本研究制备的免疫层析试纸条具有更高的灵敏度,有望用于PEDV的现场快速检测。

