基于P32蛋白的山羊痘病毒抗体荧光微球检测方法的建立
孟卫芹,王金良*,吴信明,唐娜,李通,石竞楠,董帅,沈志强
(1. 山东省滨州畜牧兽医研究院,山东 滨州 256600;2. 青岛农业大学动物医学院,山东 青岛 266109;3. 内蒙古民族大学生命科学与食品学院,内蒙古 通辽 028000;4. 河北工程大学生命科学与食品工程学院,河北 邯郸 056000)
山羊痘是由山羊痘病毒(goatpox virus,GTPV)感染引起的发病急、热性、高度接触性传染病,造成被感染山羊的皮肤、消化道黏膜和呼吸道出现痘疹等症状,是具有严重威胁的一种动物痘病[1]。山羊痘被世界动物卫生组织(WOAH)列为必须通报的动物疫病[2-6],我国农业农村部将其列为二类传染病。该病广泛分布于世界各地,如非洲、中东、北欧各国等[7],近几年来,在我国多个地区也有相关报道[8-9]。该病的发病率和死亡率均较高,尤其羔羊感染后的死亡率最高可达100%[10],给部分地区养羊业带来严重的经济损失。
GTPV基因组为线性双股、两端共价闭合的DNA,长度约为150 kb,编码约150个蛋白[11]。P32蛋白是位于羊痘病毒膜表面的一种结构蛋白,包含1个重要抗原决定簇,能诱导产生良好的中和抗体[12],可以用于建立血清学诊断技术。目前常用的血清学检测方法有病毒中和试验(VNT)、酶联免疫吸附试验(ELISA)、琼脂扩散试验(AGID)和间接免疫荧光(IFA)等[13-14],这些方法存在费时费力、试验步骤繁琐、特异性和敏感性不高等缺点;PCR技术也可用于检测山羊痘[15],但需要昂贵的仪器设备和专业人员,不利于在基层推广。荧光微球免疫学检测技术(FMIA)是一种超敏免疫分析方法[16],具有低背景、强特异性、高灵敏度等优点,已被广泛应用于病毒、细菌、药物、激素等的快速检测分析[17]。
本研究将实验室前期成功构建的pET28a-P32重组质粒转化至大肠杆菌BL21(DE3)中,经诱导表达及纯化后得到重组P32蛋白,以镧系元素铕(Eu)及其螯合物作为标记物对重组蛋白进行偶联标记,成功建立了一种快速检测GTPV抗体的荧光微球免疫层析方法,为山羊痘病毒抗体的现场快速检测提供了技术支持。
1 材料与方法
1.1 血清
GTPV阳性血清购自中国兽医药品监察所;GTPV阴性血清,山羊副流感病毒3型(CPIV3),小反刍兽疫病毒(PPRV),羊口疮病毒(ORFV)阳性血清和兔抗山羊IgG多抗均由本实验室保存;120份临床血清样品为内蒙古、山东等地羊场送检保存。
1.2 主要试剂和耗材
原核表达重组质粒pET28a-P32由山东省滨州预防兽医学与动物生物技术重点实验室保存,截取了P32蛋白抗原表位集中的N端2 ~ 141 aa区域进行表达;大肠杆菌BL21(DE3)、DNA Marker、低分子量蛋白Marker、DAB底物显色液等购自宝生物(大连)工程有限公司;山羊痘病毒抗体ELISA检测试剂盒购自山东绿都生物科技有限公司;Eu-荧光微球(粒径为210 nm)购自南京微测生物科技有限公司;EDC[1-(3-二甲氨基丙基)-3乙基碳二亚胺盐酸盐]购自Sigma公司;硝酸纤维素膜(NC膜)购自上海杰一生物有限公司;样品垫、结合垫、吸水纸、PVC板购自上海金标生物科技有限公司;其他试剂为国药分析纯。
1.3 主要仪器
超声波细胞粉碎机购自宁波新芝生物科技股份有限公司;试纸条喷点平台购自美国BioDot公司;HGS201切条机购自杭州峰航科技有限公司;ZWYR-2102C恒温摇床购自上海智城分析仪器制造有限公司;MD-100干式荧光分析仪购自上海飞测生物科技有限公司。
1.4 P32重组蛋白的表达、纯化与鉴定
将pET28a-P32重组质粒转化至大肠杆菌BL21(DE3)感受态细胞,加入终浓度为1 mmol/L的IPTG诱导6 h,收集菌体并超声,离心取沉淀溶于8 mol/L尿素溶液中,复性后用镍离子亲和层析法纯化目的蛋白。SDS-PAGE分析纯化蛋白,通过半干转印法将目的蛋白转移到聚偏二氟乙烯(PVDF)膜上,5%脱脂奶37 ℃封闭2 h,含0.5%吐温-20的Tris-HCl缓冲液(TBST)洗涤,加入1∶100稀释的GTPV抗体阳性兔血清4 ℃过夜,TBST洗涤后加入显色液,室温避光显色30 min观察鉴定结果。
1.5 试纸条的制备
1.5.1 微球标记
取固体含量为1%的Eu-荧光微球分散液100 μL,加入400 μL pH=8.0的硼酸缓冲溶液(BBS),再加入20 μL 10 mg/mL的EDC溶液,室温活化30 min;12 000 r/min、4 ℃离心15 min,将沉淀洗涤1次,用500 μL BBS重悬;超声分散后,加入0.1 mg P32蛋白,室温孵育2 h,用终浓度1%的BSA在4 ℃过夜封闭;以12 000 r/min、4 ℃离心15 min,等体积复溶液(0.1%的BSA,BBS缓冲液)复溶,超声分散后置于2 ~ 8 ℃保存备用。
1.5.2 NC膜划线
以0.05 mol/L硼酸缓冲液为包被液,用点膜仪以50 mm/s的速度、5 μL/cm的剂量将稀释后的兔抗山羊IgG多抗、P32蛋白分别喷在NC膜的质控线(C线)、检测线(T线)位置,37 ℃烘箱中烘干2~3 h后密封备用。
1.5.3 结合垫的制备
将荧光微球标记的P32蛋白稀释成系列浓度,均匀的喷在结合垫上,37 ℃烘箱中烘干2~3 h后密封备用。
1.5.4 试纸条的组装
将NC膜、吸水纸、结合垫、样品垫依次贴于PVC底板上,用切条机切成4 mm宽的试纸条,装入卡壳,置于含干燥剂的铝箔袋内密封备用。
1.5.5 结果判定
将待检血清用pH=8.0的Tris-HCl溶液稀释100倍,吸取80 μL样品滴加到试纸条样品孔中,反应结束后在荧光分析仪上读取信噪比值(T/C)。参照标准[18],当T/C<0.1时,判定为阴性;当T/C≥0.1时,判定为阳性。
1.6 试纸条反应条件的优化
1.6.1 划线浓度的优化
C线浓度设定为0.5 mg/mL,将T线划线浓度稀释为0.1、0.2、0.3、0.4、0.5 mg/mL。检测GTPV阴性、阳性血清样本,通过荧光分析仪读取T/C,根据阳性血清(P)和阴性血清(N)比值,即P/N值筛选最佳划线浓度。
1.6.2 荧光微球复溶稀释倍数的优化
荧光微球按照50、100、200、400倍复溶,分别检测阴性、阳性血清样本,读取T/C值,根据P/N值确定合适的复溶稀释倍数。
1.6.3 反应时间的优化
加样后分别在5、10、15、20、25 min时读取数据,以T/C值稳定、P/N值最大且时间最短为最佳反应时间。
1.7 性能评价
1.7.1 特异性
用制备的荧光微球试纸条检测GTPV、CPIV3、PPRV、ORFV阳性血清及GTPV阴性血清,每份血清样本做3个重复,读取T/C值,以评价试纸条的特异性。
1.7.2 敏感性
将GTPV阳性血清参照品按2倍倍比稀释(1∶50~1∶1 600),各取80 μL滴加于试纸条样品孔中,读取T/C值,以评价该试纸条的敏感性。
1.7.3 重复性
取同一批次和不同批次制备的荧光微球试纸条,分别对6份临床血清样品进行检测,每份血清做3个重复,读取T/C值,计算批内与批间变异系数(CV)。
1.7.4 稳定性
将同批次制备的试纸条干燥密封后置于37 ℃条件下进行加速老化试验,每天随机取出1组检测阴性、阳性血清,每组3个平行,读取T/C值。
1.8 临床样本的检测
采用优化后的试纸条对120份临床山羊血清进行检测,将检测结果与山东绿都ELISA试剂盒检测方法作对比,计算2种检测方法的符合率。
2 结果
2.1 P32蛋白的表达、纯化与鉴定
经SDS-PAGE显示在大约16 kDa处可见目的条带(图1A),使用镍离子亲和层析法纯化得到P32蛋白,质量浓度为1.1 mg/mL;Western blot结果显示,重组蛋白可以与GTPV阳性血清发生特异性反应(图1B),表明具有良好的反应原性。

M1. 蛋白Marker;1. 诱导后上清液;2. 诱导后沉淀;3. 纯化蛋白;M2. 预染蛋白Marker;4. 纯化蛋白与阳性血清反应。
2.2 试纸条反应条件的优化
2.2.1 划线浓度的优化
由图2中可知,当T线划线浓度为0.2 mg/mL时,P/N值最大,因此选择C线0.5 mg/mL、T线0.2 mg/mL为最佳划线浓度。

图2 T线最佳划线浓度确定
2.2.2 荧光微球复溶稀释倍数的优化
从图3中可知,当荧光微球按照200倍稀释复溶时,阳性血清T/C值较高,P/N值最大,因此选择200倍为最佳复溶稀释倍数。

图3 荧光微球最佳复溶稀释倍数确定
2.2.3 反应时间的优化
从图4可以看出,15 min后T/C值较稳定,P/N值最大,因此选择在反应时间为15 min时读取结果。

图4 最佳反应时间确定
2.3 性能评价
2.3.1 特异性
用制备的试纸条对CPIV3、PPRV、ORFV、GTPV阳性血清及GTPV阴性血清进行检测。结果显示,只有GTPV阳性血清检测结果T/C值大于0.1,其余均为阴性(表1),表明该试纸条特异性良好。

表1 特异性试验结果
2.3.2 敏感性
将GTPV阳性血清按2倍倍比稀释(1∶50~1∶1 600),稀释800倍时,T/C值仍大于0.1,为阳性,说明该试纸条的敏感性较高。
2.3.3 重复性
用同一批次与不同批次的试纸条对6份临床山羊血清检测,表2结果显示,批内变异系数小于10%,批间变异系数小于15%,说明该试纸条重复性较好。

表2 重复性试验结果(n=6)
2.3.4 稳定性
在37 ℃条件下进行加速老化试验,测得试纸条T/C值变化相对稳定(图5),在7 d时仍可准确读出阴性、阳性血清。表明在37 ℃条件下至少可保存7 d,该试纸条稳定性较好。
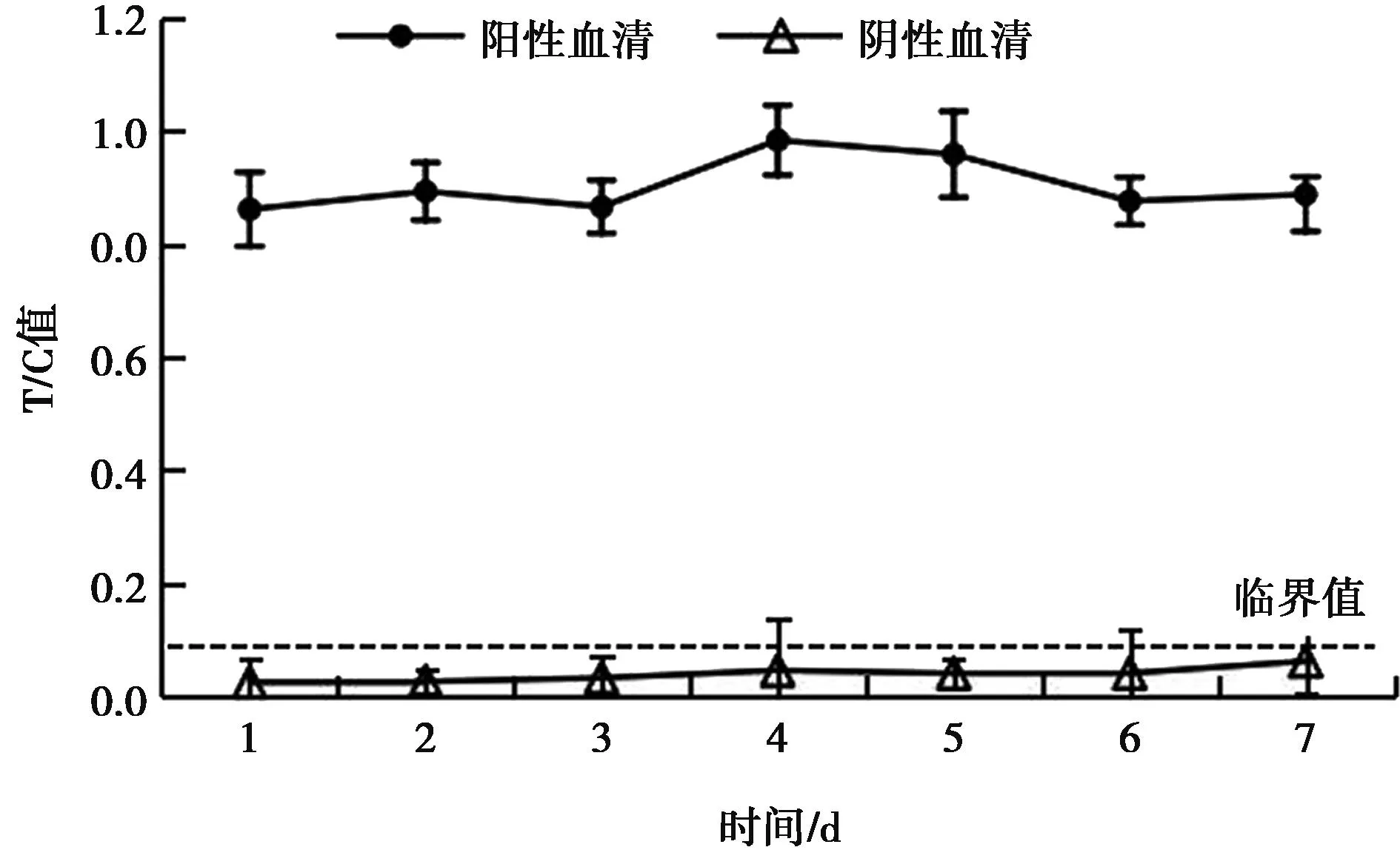
图5 37 ℃条件加速老化试验
2.4 临床样品的检测
试纸条与ELISA试剂盒检测对比结果见表3,经ELISA方法检测的70份阳性血清中检出5份阴性,阳性符合率为92.86%;50份阴性血清中检测出4份阳性,阴性符合率为92%;总体符合率为92.5%,说明试纸条准确性较高。

表3 试纸条与ELISA检测结果
3 讨论
我国对山羊痘的控制主要通过接种疫苗来完成,羊痘弱毒疫苗在羊痘防控过程中发挥了巨大作用。由于该疫苗有效接种途径为尾部皮内注射,具有一定的接种难度,因操作失误等原因可导致疫苗免疫失败,使羊具有感染羊痘病毒的风险。国内外已建立了多种GTPV检测方法,常规的病毒中和试验应用表达荧光蛋白的重组羊痘病毒,使检测时间大大缩短[15];有学者针对GTPV建立了快速、灵敏的PCR诊断技术,并已经研究出可同时识别山羊痘病毒和羊口疮病毒的PCR检测方法[19];程汝佳等[20]选取ORF068基因保守区域设计引物,建立了GTPV环介导等温快速检测方法,与实时荧光PCR方法符合率达100%。赵宏吉等[21]以G9蛋白作为包被抗原建立的GTPV间接ELISA方法,证实与P32蛋白作为包被抗原建立的 ELISA方法的检测效果相似。
疫苗免疫抗体水平的现场快速监测对于成功预防羊痘具有重要意义,目前已有商品化的羊痘病毒ELISA抗体检测试剂盒,但因其对检测平台具有一定的要求,不适用于现场的快速检测。1983年,Soini等[22]首次提出将稀土离子为标记物引入到免疫分析领域,为FMIA检测方法的开创奠定了基础。该技术利用镧系元素Eu微球共价偶联标记抗原或抗体,比物理偶联更加牢固[23]。微球包裹及葡聚糖修饰技术确保了荧光离子不泄露、不受外界干扰,光稳定性好,而且Eu离子Stoke位移大,具有时间分辨功能,可有效地排除非特异荧光的干扰,极大地提高了分析灵敏度[24]。若能同时结合便携式荧光分析仪,操作简便,适于在基层推广应用。
GTPV抗体检测的靶蛋白中,P32蛋白是目前世界各国分离鉴定的毒株所共有的、特异性很强的结构蛋白[25]。其中,2~141 aa区域是P32蛋白的优势抗原区,本试验前期将该区域在大肠杆菌中进行截短表达、纯化获得重组P32蛋白,为荧光微球快速检测方法的建立提供了抗原基础。以荧光微球为标记材料对P32蛋白进行标记,以纯化的多抗IgG和P32蛋白分别包被试纸条的C线与T线,通过优化反应条件建立了GTPV抗体荧光微球免疫层析试纸条,丰富了GTPV快速检测方法。经评价,该试纸条只与GTPV阳性血清反应,与CPIV3、PPRV、ORFV的阳性血清均无交叉反应,特异性较强;阳性血清稀释至800倍仍能检出阳性,敏感性较高;随着时间的延长,信号强度会有所减弱,但T/C值相对稳定,批内变异系数小于10%,批间变异系数小于15%;与ELISA检测方法对比的总符合率为92.5%。
综上所述,本研究建立的基于P32蛋白的GTPV抗体荧光微球快速检测方法具有特异性强、敏感性高、重复性和稳定性好、无需大型昂贵的仪器、操作简便等优势,可广泛应用于羊场中GTPV抗体的监测和流行病学调查。

