玉米花序发育基因AFP1 的定位及功能研究
薛 明 汪晨晨 姜露光 刘 浩 张路遥 陈赛华,*
1 江苏省作物基因组学和分子育种重点实验室 / 植物功能基因组学教育部重点实验室 / 江苏省作物遗传生理重点实验室, 扬州大学农学院, 江苏扬州 225009; 2 作物杂种优势与利用教育部重点实验室 / 国家玉米改良中心 / 中国农业大学农学院与生物技术学院,北京 100193
玉米(ZeamaysL.)是重要的粮食、饲料、工业和能源原料, 在保障粮食安全、经济发展及缓解能源危机等方面起重要作用。玉米也是典型的雌雄同株异花植物, 其花序包括雌穗和雄穗, 它们是玉米产量的载体。花序的正常发育对稳定玉米产量具有根本性的意义。
玉米雌穗和雄穗早期的发育是相似的。由营养生长向生殖生长转换时, 花序由叶腋处的腋生分生组织(axillary meristem, AM)按固有模式分化和发育形成[1]。首先叶腋处的AM 启动, 逐渐膨大伸长形成花序分生组织(inflorescence meristem, IM)。在性别分化期间, 雌穗小花中的雄蕊败育, 雄穗小花中的雌蕊败育, 最终分别形成成熟的雌雄花序[2]。雌花序分生组织 IM 产生数目不等的成对小穗分生组织(spikelet-paired meristem, SPM)。而雄穗发育过程中花序分生组织IM 分化形成雄穗侧枝分支分生组织(branch meristems, BM), 之后BM 分化形成SPM。花序分化形成的SPM 继续分化产生2 个小穗分生组织(spikelet meristem, SM)[3], 进而分化形成小花分生组织(floral meristem, FM)。最后, 小花分生组织形成花器官[4]。
玉米花序发育是一个复杂的过程, 由许多基因共同调控[3,5-6]。目前被报道参与SM 分化的基因主要有:BD1[7]、IFA1(INDETERMINATEFLORAL APEX1)[8]、IDS1(INDETERMINATESPIKELET1)[9]和RGO1(REVERSEDGERMORIENTATION1)[10]等。BD1突变后, 改变雌穗小穗分生组织的命运, 产生许多分枝结构而无法形成小穗和花丝, 而雄穗侧生小穗数量明显增多[7];IDS1、IFA1和RGO1在调控SM 命运决定功能上存在一定的冗余[11]。SM 分化异常最终将会影响FM 的发育。目前已经被清楚解析影响 FM 分化的基因较少[12], 主要包括:BDE(BEARDEDEAR)与ZAG1(ZEAAGAMOUS1)互作调控小花分生组织的产生和花器官分生组织起始与活性的维持[13];Zmm16(Zeamaysmads16)影响雄花浆片和雄蕊转变、以及雌花中雄蕊的退化[14];SI1(Silky1)突变后导致雄蕊转换为心皮、浆片转换为类似于内外稃的结构[15]。
BD1 蛋白由315 个氨基酸组成, 含有1 个保守的ERF/AP2 结构域[7], 该结构域是ERF 的DNA 结合域和行使转录调控的关键[16]。ERF/AP2 家族蛋白被证明在植物生长发育、生物与非生物胁迫以及生物合成方面均有重要作用[17]。BD1 蛋白功能丧失后,影响玉米雌雄穗的发育, 但对其上下游基因调控的分子机制还需要进一步挖掘。
玉米花序发育过程涉及选择性细胞死亡、信号转导等多种遗传调控机制。近年来许多研究结果证明赤霉素(GA)[18]、细胞分裂素(CK)[19]、油菜素内酯(BR)[20]、生长素(IAA)[21]和茉莉酸(JA)[22-23]等多种植物激素参与玉米花序发育过程。而 BD1是否通过调控激素信号转导途径影响雌雄穗的发育尚不清楚。
本研究利用EMS 诱变的突变体库材料, 筛选获得玉米花序发育模式改变的突变体afp1。结合表型和基因型分析, 对afp1进行精细定位。进一步利用转录组测序和qRT-PCR 对afp1调控的代谢途径和关键基因的表达量进行了分析和鉴定。本研究为后续afp1基因的定位以及功能研究奠定了基础。
1 材料与方法
1.1 试验材料
afp1为花序发育模式改变材料(Mo17 背景下的EMS 突变体材料, 中国农业大学贺岩教授馈赠)。利用afp1作为父本与B73 杂交后自交, 构建F2群体,用于基因定位。
1.2 田间试验
试验材料于海南乐东和江苏扬州沙头试验基地种植, 种植株距为25 cm, 行距60 cm, 每行10株。水肥管理按照玉米常规栽培条件实施。
1.3 基因定位
根据 F2群体花序发育的表型, 随机选取群体中花序正常发育的F2单株40 个, 平均分成2 份组成2 个混池样本WM1 和WM2; 选取群体中花序发育异常的F2单株40 个, 平均分成2 份组成2 个混池样本MM1 和MM2; 同步选取Mo17、afp1和B73材料各5 株分别组成混池, 利用Maize 6H-60K 芯片(辽宁东亚种业有限公司)对7 个混池材料的基因型进行鉴定。
芯片数据质控原则: (1) 保留Call Rates 大于等于80%的基因型位点; (2) 删除没有明确物理位置信息的基因型位点。亲本afp1和B73 之间多态性SNP 筛选标准: (1) 删除双亲中没有多态性的SNP; (2) 删除亲本中未检测到的基因型位点和杂合的基因型位点。
基于连锁不平衡的原理, 首先寻找与表型连锁的位点。随后根据目标区段内自交系B73 和Mo17基因组差异设计分子标记, 利用后代群体中明确表型的交换单株, 对目标基因进行精细定位, 引物序列见表1。

表1 试验中使用的引物序列Table 1 Primers used in this study
1.4 总RNA 提取及测序
转录组测序材料为海南乐东基地种植F4分离群体, 待植株生长至抽雄期, 根据雄穗小花发育是否异常判定突变体表型材料和野生型表型材料, 同时利用分子标记M1722 和M1725 对基因型进行鉴定,选取候选区间纯合的突变体材料和野生型材料发育早期的雌穗各3 株, 用液氮冷冻备用。
委托北京诺禾致源科技股份有限公司完成RNA提取、文库构建和转录组测序。选取突变体和对照材料的幼小雌穗组织, 利用TRIzol (诺唯赞, 南京)提取雌穗的总RNA。RNA 质量和纯度分光光度计在波长为260 nm 和280 nm 条件下检测。检测合格样品利用Oligo(dT)富集mRNA, 并通过Fragmentation Buffer 使其短片段化, 以短片段mRNA 合成双链cDNA, 纯化后进行末端修复、加碱基A、加测序接头处理; 最后进行PCR 扩增完成测序文库制备。采用Illumina NextSeq 550AR 平台进行双末端测序。
1.5 RNA-seq 数据分析
RNA-seq 数据过滤步骤如下: (1) 去除接头;(2) 去除低质量的Reads (包括去除N 的比例大于10%和质量值Q≤10 的碱基数占整条Read 的50%以上的Reads)。经过上述一系列的质量控制之后得到的高质量的Clean Data。使用Hisat2 将质控后的clear reads比对到玉米参考基因组ZeamaysB73 Ref Gen_v4 ftp://ftp.ensemblgenomes.org/pub/release-32/plants/fas ta/zea_mays/dna 上。通过FPKM (Fragments Per Kilobase of exon model per Million mapped fragments)对基因表达量进行标准化, 以FPKM>1 为表达标准,随后根据突变体与野生型材料基因表达量的比较,以| log2(Fold Change) |≥1 和P-value/FDR<0.05)为标准确定差异表达基因(DEGs)。通过GO 富集分析DEGs 显著富集的功能分类, 用KEGG (Kyoto encyclopedia of genes and genomes, KEGG)分析DEGs 主要参与的代谢途径和信号通路。
1.6 实时荧光定量PCR (qRT-PCR)分析
取500 ng 总RNA 利用反转录试剂盒(TaKaRa,日本)合成cDNA。使用SYBR Green RT-PCR 试剂盒(诺唯赞, 南京)进行定量qRT-PCR 检测, 根据基因CDS 序列设计特异引物检测基因的表达情况。利用2-ΔΔCT法计算基因的相对表达量,ZmGAPDH(Zm00001d049641)基因表达量作为对照。挑选的基因及使用的引物序列见表1, 每个基因的表达量统计均为3 次生物学重复和3 次技术重复。
2 结果与分析
2.1 表型鉴定
与野生型材料相比(图1-A~E),afp1材料雌穗产生一系列侧生分枝且无花丝形成(图1-F~G); 雄穗侧生小穗数量显著增多(图1-I)。经过多年多点鉴定该表型能够稳定遗传。对B73×afp1构建的F1群体植株的花序发育观察发现, F1植株均正常发育; 进一步将构建的F1群体自交获得F2分离群体, 通过统计突变表型植株和正常表型植株的数量后进行卡方测验, 发现突变体表型和野生型表型的植株数量分离比符合1 ∶3 ( 表2), 说明afp1表型由1 对隐性核基因控制。

图1 Mo17 和afp1 花序表型Fig. 1 Ear and tassel of Mo17 and afp1

表2 afp1 突变位点的遗传分析Table 2 Genetic analysis of the afp1 locus
2.2 基因定位及候选基因预测
对F2代分离群体构建的混池样本以及亲本的基因型数据分析显示: 4 个混池样本的基因型缺失率从4.44%到5.01%变化, 杂合率均约43%左右; 亲本B73 和afp1基因型缺失率分别为0.40%和1.83%, 杂合率分别为0.38%和8.78% (表3)。去除亲本B73 和afp1的杂合基因型、缺失基因型以及两者间无差异的基因型数据后共筛选到26,826 个高质量的SNP,且均匀分布在10 条染色体上, 说明芯片数据可靠。

表3 SNP 芯片检测数据分析Table 3 Data analysis identified by SNP array
利用质控后获得26,826 个高质量的SNP 对混池样本的基因型进行鉴定, 并根据连锁不平衡原理对候选基因进行初定位: 挑选WM1 和WM2 混池中样本基因型为杂合、MM1 和MM2 混池中样本基因型为纯合的区段, 最终将候选基因定位在7 号染色体SNP 标记AX-107979066 和AX-107996145 之间, 并进一步通过与表型连锁的分子标记M150 和M176对候选区段进行确认, 两者之间物理距离约为 26 Mb。为了缩小定位区间, 利用后代群体以及新开发的14 对分子标记对候选基因进行精细定位, 将afp1精细定位在分子标记M1722 和M1725 间的300 Kb范围内(图2-A)。

图2 afp1 精细定位及候选基因分析Fig. 2 Fine mapping of afp1 and analysis of candidate gene
分子标记M1722 和M1725 之间包含一个已知的花序发育基因BD1。利用afp1和Mo17 材料对BD1(Zm00001d022488)基因的CDS 和起始密码子(ATG)上游~2 kb 的序列进行测序发现:BD1基因ATG 下游第199 位胞嘧啶C 突变为胸腺嘧啶T, 其余碱基序列均无变化(图2-B)。该突变位点位于BD1 蛋白的AP2/ERF 结构域, 导致BD1 蛋白第67 位的氨基酸由精氨酸R 变为色氨酸W (图2-B)。AP2/ERF 结构域为BD1 蛋白保守功能域(图2-C), 且afp1材料花序的表型与BD1基因突变后植株表型一致[7], 说明afp1花序发育模式的改变可能是BD1 的R67W 造成的。
2.3 afp1 调控通路分析
为了进一步挖掘和探讨afp1调控玉米花序发育的分子机制, 我们对野生型和突变体材料的幼嫩雌穗进行了RNA 测序(RNA-seq), 以分析afp1可能调控的代谢通路。6 个RNA-seq 文库原始数据过滤分析后结果见表4。过滤后Q20 均大于96%, GC 含量约为55%, 单一位置序列比对率均大于82%, 表明测序数据质量良好, 可用于下一步分析。
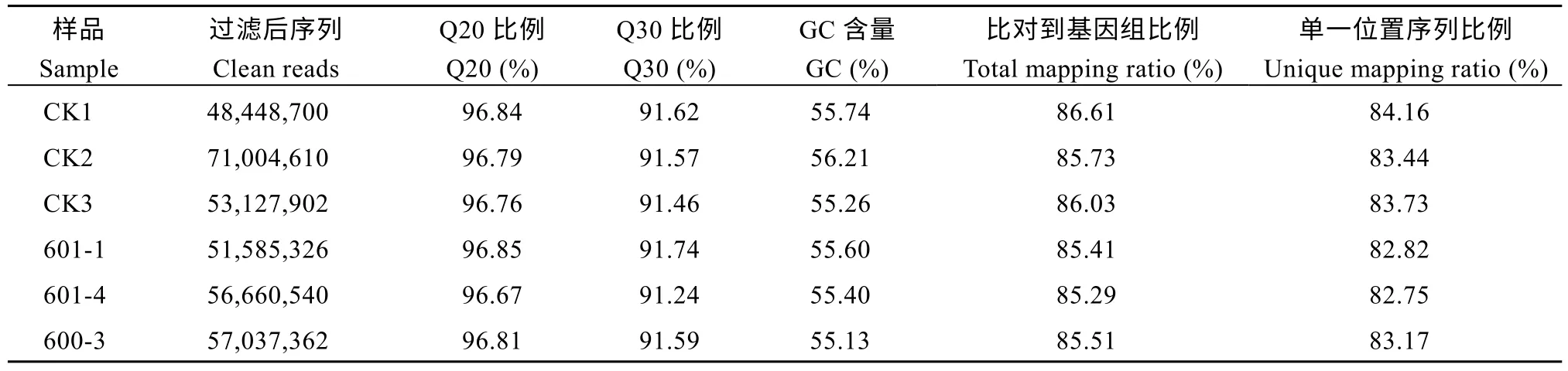
表4 Illumina 测序数据组装概述Table 4 Overview of the sequence assembly after Illumina sequencing
对野生型和突变体材料的基因表达量分析发现,在突变体材料和野生型材料间共有274 个差异表达基因, 其中154 (56.20%)个基因的表达量下调, 120(43.80%)个基因的表达量上调(图3-A)。为了验证RNA-seq 结果的准确性, 随机选取6 个差异表达基因进行了qRT-PCR 分析(挑选基因和对应引物序列见表1)。结果如图3-B 所示, 所挑选基因的表达量在突变体材料和野生型材料间均表现出显著差异,与RNA-seq 数据一致。对qRT-PCR 与RNA-seq 结果进行相关性分析, 发现两者的决定系数R2=0.81,说明RNA-seq 结果可靠。
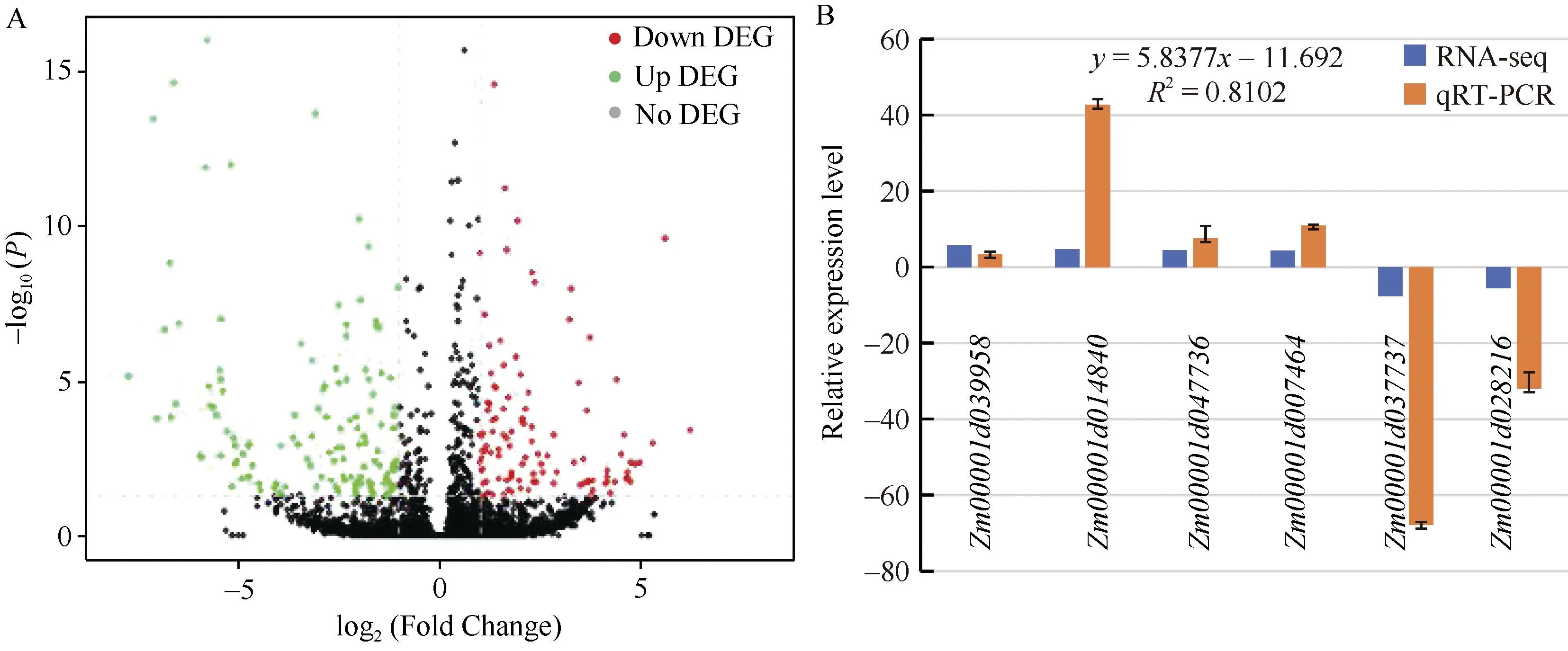
图3 差异表达基因火山图及qRT-PCR 分析Fig. 3 Volcano plot of differentially expressed genes (DEGs) and the relative expression patterns of genes
为了探索差异表达基因的功能, 我们对差异表达基因进行GO 注释分析。差异表达基因被注释到17 个细胞组分、53 个分子功能和143 个生物过程。其中细胞组分分析中差异基因显著富集在细胞核、胞外区域和质膜等组分类别; 分子功能分析中差异基因显著富集在RNA 聚合酶II 调控区DNA 结合、蛋白质二聚化活性和DNA 结合等方面; 生物过程分析中差异基因显著富集在远轴细胞命运决定、RNA代谢或转录调控和茎尖分生组织发育等过程。
进一步对差异表达基因进行pathway 富集分析发现, 差异表达基因被注释到56 条代谢通路中。以矫正的P<0.05 为筛选标准, 未发现明显富集的通路。KEGG 分析结果中最主要的10 条代谢通路为MAPK 信号途径、氰氨酸代谢、二萜生物合成、淀粉和蔗糖代谢、柠檬烯和蒎烯降解、亚麻酸代谢、植物激素信号转导、核糖核酸聚合酶、赖氨酸降解和苯并恶唑嗪酮的生物合成(图4)。其中, 富集基因数量最多的3 个通路为MAPK 信号途径、淀粉和蔗糖代谢以及植物激素信号转导途径。MAPK 信号途径中富集的差异表达基因数目为7 个, 其中2 个基因下调表达, 5 个基因上调表达; 淀粉和蔗糖代谢中富集的差异表达基因数为5 个, 其中1 个基因下调表达, 4 个基因上调表达; 植物激素信号转导途径中富集到6 个差异表达基因, 其中5 个基因下调表达,1 个基因上调表达。植物激素信号转导途径富集83.3%基因的表达量都显著下调, 说明这些激素信号可能在玉米花序发育中发挥重要作用。
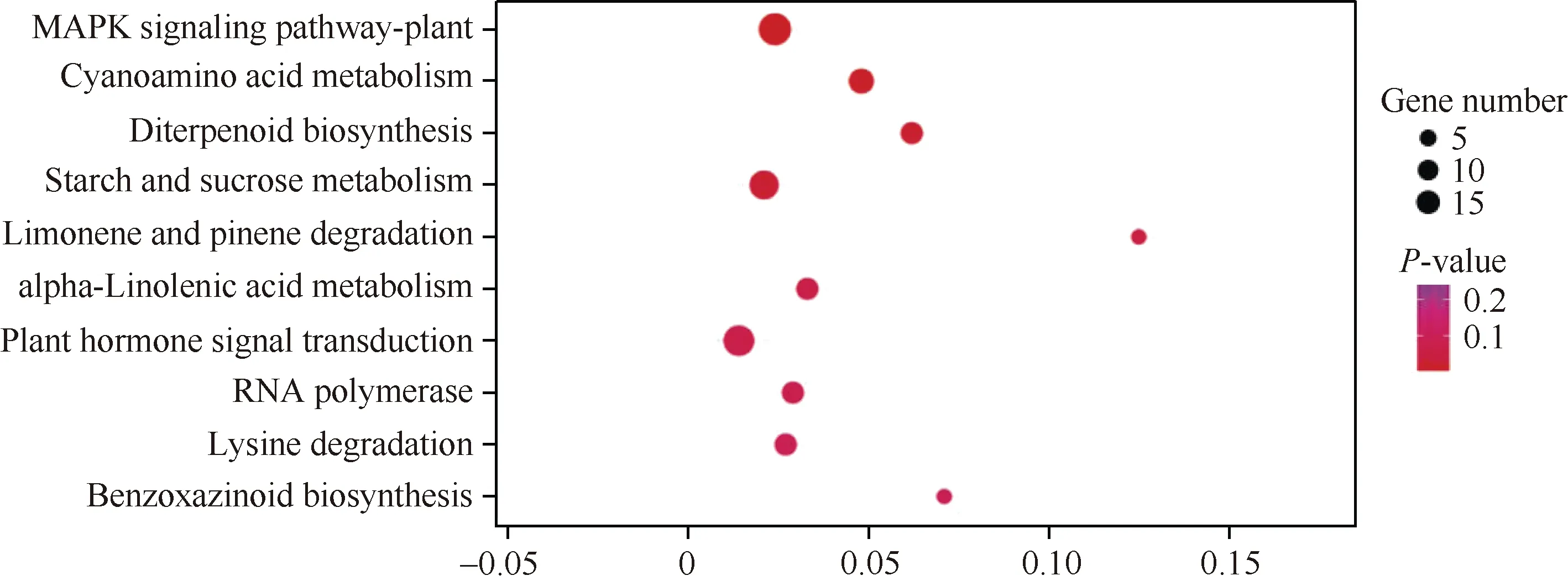
图4 基于差异表达基因的KEGG 分析Fig. 4 KEGG analysis based on the differentially expressed genes (DEGs)
多种植物激素已经被证明参与到玉米花序的发育过程, 对玉米花序的形态建成起到一定的调节作用。afp1突变后生长素、水杨酸和乙烯3 种激素信号途径的基因表达发生显著变化(表5)。其中, 生长素信号转导通路富集到2 个差异表达基因, 表达量均下调; 水杨酸信号响应通路富集到3 个差异表达基因, 2 个基因表达量下调; 乙烯信号响应通路富集到1 个差异表达基因, 表达量下调。
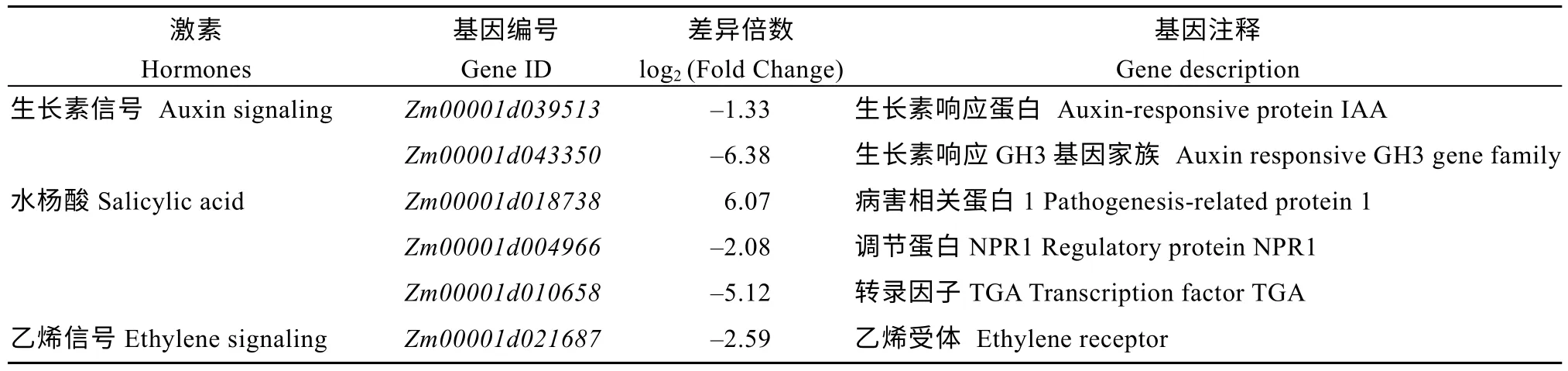
表5 植物激素信号转导路径相关基因Table 5 Genes involved in phytohormone signaling pathway
为了进一步挖掘afp1调控的基因, 我们对差异表达基因进行注释发现, 多个已被解析影响玉米花序发育的基因表达量都显著下调, 包括调控FM 确定的基因Zm00001d017614(BDE)[13]、影响玉米雌雄穗发育和性别决定的基因Zm00001d008882(Zmm2)、Zm00001d037737(ZAG1)[24]和Zm00001d036425(SI1)[15]、调控心皮发育和花对称发育的基因Zm00001d042618(Zmm16)[14]、Zm00001d028216(IFA1)和Zm00001d048083(DroopingLeaf1,DRL2)[25](图5-A), 说明AFP1可能正调控这些基因的表达。
除上述已报道的Zmm2、ZAG1和Zmm16外, 多个MADS-box 基因家族(Zeamaysmads)成员的表达量也显著下调, 包括Zm00001d048082(Zmm8)、Zm00001d051465(ZEAAGAMOUS5,ZAG5) 、Zm00001d031620(Zmm6)、Zm00001d028217(Zmm14)、Zm00001d010232(Zmm29)、Zm00001d023955(Zmm1)、Zm00001d010233(Zmm18)、Zm00001d006094(Zmm27)、Zm00001d021057(Zmm7)、Zm00001d015381(Zmm17)和Zm00001d041781(ZEAAGAMOUS2,ZAG2) (图5-B)。其中Zmm29和Zmm18也已经被报道在玉米花序发育中可能与Zmm16的功能冗余[14]。
本研究还发现6 个主要在雌雄穗中表达的基因在afp1材料中表达量显著降低(图5-C), 而多个在雌穗中不表达或者表达量低的基因在afp1材料中表达量显著增加(图5-D), 例如,Zm00001d014840主要在根和雄穗中表达(https://www.maizegdb.org/), 而在afp1材料其表达量增加最显著(图3-B 和图5-D), 说明这些基因可能参与玉米雌雄穗发育过程。
3 讨论
根据前人报道,BD1参与玉米花序形态建成, 尽管BD1 蛋白在水稻和高粱等物种中只有45%至75%的同源性, 但它们AP2/ERF 结构域的氨基酸完全一致[7], 本研究中对不同作物BD1 蛋白AP2/ERF 结构域的氨基酸序列分析也发现了类似的结果, 说明该结构域的氨基酸序列非常保守。基于 BD1 蛋白AP2/ERF 结构域氨基酸序列的保守性以及afp1表型与bd1表型基本一致, 本研究初步认为BD1第199位碱基由胞嘧啶C 突变为胸腺嘧啶T (BD1 蛋白第67 位氨基酸由R 变为W), 导致其功能缺失。同时也说明该位点可能是BD1 蛋白发挥作用的关键位点。
玉米花序形态建成需要多种激素的参与。玉米AM 的正常启动和身份决定与生长素的调节密切相关[26]:BIF1和BIF4编码的Aux/IAA 蛋白调控BA1的表达, 进而调控AM 的形成[21],BA1突变后, 玉米发育过程中不能启动腋生分生组织, 导致植株只由茎和叶组成[27]; 高浓度CK 可以抑制雌蕊形成[19],促进细胞分裂素合成的基因KN1功能缺失后植株表现为顶端分生组织缩小, 产生稀疏的花序[28]; 内源赤霉素(GAs)在促进玉米雄蕊退化和抑制雌蕊原基败育中也发挥重要作用[29-30]; 油菜素内酯(BR)生物合成途径中的NA1突变后, 玉米植株会出现雄穗结实的现象, 而外源喷施BR 能抑制这种现象的发生[20]; 茉莉酸(JA)及其相关物质在决定玉米雌雄蕊发育中也发挥重要作用,SK-A7110突变后, 雌穗中JA 和JA-Ile 水平显著增加, 导致雌蕊败育[23], 影响玉米雄花花序发育的基因TS1和TS2突变体后, 内源JA 含量显著降低, 而外源喷施JA 能够恢复雄花花序发育[22]。本研究中的差异表达基因富集到3 种激素信号转导途径, 其中生长素信号途径中GH3 家族基因(Zm00001d043350)表达量降低最显著(log2(FC)=-6.38), 其同源基因OS01G0764800被证明在不同水稻品种开花期的表达量呈现显著差异[31]; 此外, 水杨酸和乙烯信号途径中多个基因的表达量也发生了显著变化, 在玉米雌穗发育异常fea5(fasciatedear5)材料也发现了类似的现象[32], 说明水杨酸和乙烯信号转导途径也可能参与SM 和FM 的发育过程, 但还需要更多的试验来验证。
MADS-box 基因家族是植物中最大的家族之一,在花序发育过程中起着重要的作用[33]。本研究发现除3 个已经被解析参与玉米花序发育的MADS-box家族基因表达量显著降低外, 其他多个MADS-box基因家族成员的表达量在afp1材料中的表达量也显著下调, 说明这些基因可能在玉米花序发育中也发挥重要作用。同时, 多个在雌雄穗中特异表达的基因在afp1材料中表达量显著降低、以及多个在雌穗中不表达或者表达量低的基因在afp1材料中表达量显著增加, 说明AFP1可能调控这些基因的表达从而调控玉米FM 的形成。此外, 本试验中还发现afp1材料中Zm00001d037708的表达量显著提高(图6-D), 该基因的同源基因在拟南芥中编码尿苷二磷酸-糖基转移酶(UGTs), UGTs 也被报道参与玉米花丝的形成[34], 因此,Zm00001d037708也可能通过编码UGTs 调控玉米花序形态建成。
4 结论
本研究通过表型分析和连锁分析对影响玉米花序发育的基因afp1进行定位, 并通过进一步精细定位将候选区间缩小至300 kb 的范围内, 初步确定该候选基因为BD1。BD1 蛋白保守结构域ERF/AP2 的氨基酸R67W 的改变导致玉米花序发育异常, 说明该位点是BD1 蛋白发挥作用的关键。通过对afp1与野生型材料的幼穗组织进行RNA-seq 分析鉴定了274 个差异表达基因。对这些差异表达基因进行GO富集分析发现, 它们富集在17 个细胞组分、53 个分子功能和143 个生物过程。进一步KEGG 分析发现差异表达基因富集到多条代谢通路中。其中, 生长素、水杨酸和乙烯信号转导途径中富集的83.3%基因表达量都显著下调, 说明afp1可能通过影响激素信号途径从而调控玉米花序发育。
——植物学教材质疑(六)

