水稻花粉小肽锌指蛋白基因OsFLZ13 功能研究
张丽洁 周海宇 MUHAMMAD Zeshan MUNSIF Ali Shad 杨明冲李 波 韩世健 张翠翠,3 胡利华,3,* 王令强,*
1 广西大学亚热带农业生物资源保护与利用国家重点实验室, 广西南宁 530004; 2 广西大学农学院, 广西南宁 530004; 3 广西大学生命科学技术学院, 广西南宁 530004
锌指蛋白是一种重要且结构多样、功能广泛的蛋白质, 锌指蛋白中的锌离子由半胱氨酸和组氨酸残基结合[1]。根据含有的半胱氨酸和组氨酸残基的位置和数量, 锌指蛋白可分为C2H2、C2HC、C2HC5、C2C2、CCCH、C3HC4、C4、C4HC3、C6 和C8 等类型[2], 它们与转录调控、DNA修复、细胞增殖和组织发生等生物学过程相关。
FCS序列基序(zf-FCS)是一类高度差异化的C2C2型锌指, 存在于动物、植物、原核生物和病毒中。未知功能581 结构域(DUF581)是zf-FCS型锌指中的一种植物特异性结构域, 对植物的生长发育和应对逆境胁迫起着重要的作用[3]。研究人员在衰老相关的增强子捕获实验中鉴定出第一个含有该结构域的蛋白,将该结构域命名为FCS样锌指(FLZ)或未知功能581结构域(DUF581)[4]。该结构域大约含有70 个氨基酸残基, 由相同的CX2CX17-19FCSX2C基序组成。随后的研究表明, 大多数FLZ家族基因的表达受细胞能级的调节, 含在能量不足下的正向调控基因和在能量充裕下的负向调控基因。SnRK1-FLZ蛋白相互作用与糖和能量信号以及应激反应的生物过程密切相关[5]。在拟南芥(Arabidopsisthaliana)中, DUF581 蛋白与拟南芥的SnRK1α亚基(AKIN10/11)相互作用, 形成不同的同工酶复合物[6]。拟南芥FCS样锌指(FLZ)蛋白家族的2 个成员FLZ6 和FLZ10 蛋白, 是SnRK1 的抑制因子, 调控拟南芥的生长和对脱落酸(ABA)的响应[7]。进一步的研究指出, FLZ6 和FLZ10 蛋白抑制SnRK1信号传导, 从而参与雷帕霉素靶标(TOR)信号传导的激活, 这种调节对植物生长和抵御逆境环境具有广泛的影响[8]。此外, 小麦中FLZ家族基因TaSRHP的异位过表达增强了拟南芥对盐和干旱胁迫的耐受性[9]。敲除拟南芥FLZ家族基因MARD1的突变体, 能够抵抗ABA, 调控种子休眠。与野生型种子相比, 突变体种子在添加外源ABA培养基中的萌发速度更快[10]。最新的研究通过计算机分析, 预测FLZ蛋白具有保守的固有无序区域(IDR), FLZ 结构域对于介导与SnRK1α亚基的相互作用至关重要, 而N末端的IDR促进了与SnRK1 的β和βγ亚基的相互作用[11]。
目前关于FLZ基因家族的研究主要集中在拟南芥上, 在水稻中FLZ家族基因特征特别是功能研究还较少。最近研究表明OsFLZ18与SnRK1A相互作用, 调节水稻耐涝性正调节因子αAmy3的表达[12]。还有研究发现,OsFLZ18调控水稻抽穗开花, 超量表达导致水稻抽穗期延迟, 抑制了植株中Ehd1、Hd3a和RFT1等基因的表达, 在水稻生长发育和逆境应对过程中具有重要的作用[13]。OsZFP6参与水稻干旱和盐胁迫逆境应答的调节, 过表达可显著提高水稻对干旱和盐胁迫的耐受能力[14]。此外, 锌指蛋白OsBBX24正调控水稻响应热胁迫, 提高对热胁迫的耐受性[15]。这些研究表明, 锌指蛋白可用于遗传改良, 调控水稻生长发育, 提高水稻逆境适应能力。在水稻中发现的FLZ基因家族的一些基因主要调控抗逆性(如干旱、盐胁迫、热胁迫等), 但调控雄性发育的研究还鲜见报道。
本研究分析了水稻FLZ锌指蛋白家族的蛋白质理化性质、保守结构域、基因结构、顺式作用元件以及家族成员在各生长发育时期组织的表达模式。对OsFLZ13基因进行了表型分析和功能研究, 发现osflz13突变体花粉育性异常, 结实率显著降低, GUS染色表明OsFLZ13基因在花药发育后期表达, 亚细胞定位结果显示OsFLZ13蛋白在质膜和细胞核表达。研究结果可为锌指蛋白基因家族的功能研究提供参考, 为研究OsFLZ13功能建立基础, 对水稻的杂交育种有重要意义。
1 材料与方法
1.1 水稻FLZ 家族基因成员的鉴定及其蛋白质理化性质分析
利用Rice Genome Annotation Project (RGAP)(http://rice.uga.edu/index.shtml)网站下载水稻的蛋白质文件, 版本为version_7.0。以拟南芥(Arabidopsis thaliana) 18个、大豆(Glycinemax) 37个、短柄草(Brachypodiumdistachyon) 26个、玉米(Zeamays)29个、大麦(Hordeumvulgare) 16个FLZ蛋白为参考序列[16], 使用TBtools[17]的Blast功能对下载的水稻蛋白质文件进行检索, 鉴定获得水稻FLZ家族基因成员。再通过NCBI-CDD (http://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)、PFAM (http://pfam.xfam.org/)和SMART (http://smart.embl.de/)这3个在线工具进行结构域分析, 筛选出包含FLZ结构域的基因作为水稻FLZ基因家族成员。使用RGAP查找水稻FLZ家族基因所在的染色体、核酸长度、蛋白质长度、蛋白质分子量, 使用Expasy (https://www.expasy.org/)分析蛋白质一级结构的不稳定系数、脂肪族指数、平均疏水性。水稻FLZ基因家族成员命名参考The Rice Annotation Project (RAP-DB) (https://rapdb.dna.affrc.go.jp/)中的命名标准。
1.2 水稻FLZ 蛋白保守基序、保守结构域和基因结构分析
通过在线网站MEME[18](http://meme-suite.org/)分析水稻FLZ 蛋白的保守基序, 设置查找20 个宽度为6~50 个氨基酸的基序, 最大E-value 为10。通过NCBI-CDD (http://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)下载水稻FLZ 结构域分析结果。根据 RGAP 下载的水稻基因组注释文件, 版本为version_7.0, 分析水稻 FLZ 家族基因结构。使用TBtools 中的Gene Structure View (Advanced)工具对保守基序、保守结构域和基因结构可视化。
1.3 水稻FLZ 家族基因启动子的顺式作用元件预测
根据RGAP 下载的水稻基因组注释文件, 版本为version_7.0, 提取29 个水稻FLZ 家族基因起始密码子(ATG)上游2000 bp 的启动子序列, 提交至Plant CARE[19]网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/), 预测顺式作用元件及其潜在的功能, 并通过TBtools 可视化。
1.4 水稻FLZ 家族基因的表达分析
利用水稻数据库Collection of Rice Expression Profiles (CREP) (http://crep.ncpgr.cn/crep-cgi/home.pl),分析了水稻FLZ在明恢63不同组织、不同生长时期和圆锥花序发育不同阶段的表达水平, 同时分析了OsFLZ13在明恢63 (Minghui 63, MH63)、珍汕97(Zhenshan 97, ZS97) 2个品种中不同组织中的表达。通过Origin聚类分析生成基因表达热图。
1.5 亚细胞定位实验
使用Wolf PSORT[20]和CELLO[21]在线网站对OsFLZ13 蛋白的亚细胞定位进行预测。从水稻中花11 扩增OsFLZ13基因编码序列(CDS) (不含终止密码子), 并在CaMV35S 启动子的控制下与含有增强型绿色荧光蛋白(eGFP)的pD1301S 载体融合, 构建35S::OsFLZ13::eGFP 重组表达载体。将重组表达载体导入根癌农杆菌(EHA105), 根据Kokkirala 等[22]的方法转入4~6 周的烟草叶片表皮细胞中。注射36~48 h 后, 用FluoViewFV3000 共聚焦显微镜(Olympus,日本)观察亚细胞定位结果。
1.6 组织定位重组载体pCAMBIA1381Z-OsFLZ13和基因编辑载体PHK1-Cas-U3-OsFLZ13 的构建
通过RGAP 下载OsFLZ13基因ATG 前2000 bp,用表1 中的引物OsFLZ13-GUS 从中花11 的DNA扩增启动子序列, 选择BamH І 和EcoR І 两个酶切位点, 与含有GUS 的载体pCAMBIA1381Z 融合, 构建pCAMBIA1381Z-OsFLZ13重组表达载体。转化DH5α 感受态细胞, 平板培养, 单菌落测序后采用农杆菌介导法转化中花11 愈伤, 经培养获得转基因株系。利用表1 中的潮霉素基因检测引物Hyg PCR 扩增, 筛选阳性转基因株系。进一步通过Primer 5.0 设计分别位于载体和启动子上的2 条引物OsFLZ13-GUS-Identify (表1)进行PCR 鉴定阳性植株。依据OsFLZ13(LOC_Os04g49650) 基因序列, 利用CRISPR-P2.0 (http://cbi.hzau.edu.cn/CRISPR2/)在线软件在基因反义链的上游和下游位置各设计 1 个20 bp 的编辑靶点[23]。使用引物OsFLZ13-CRISPR(表1)进行PCR 扩增, 获得含靶点序列的线性DNA片段, 用武汉伯远生物科技有限公司单子叶基因编辑载体试剂盒, 构建双靶点CRISPR-Cas9 载体, 并转化DH5α 感受态细胞, 平板培养, 单菌落测序后采用农杆菌介导法转化中花11 愈伤, 经培养获得转基因株系。利用表1 中的潮霉素基因检测引物Hyg,PCR 扩增筛选出阳性转基因株系。分别使用引物OsFLZ13-Target1,OsFLZ13-Target2 (表1) PCR 扩增包含靶点1 和靶点2 的序列, 由北京擎科生物科技股份有限公司测序, 获得基因编辑类型。引物由北京擎科生物科技股份有限公司合成。
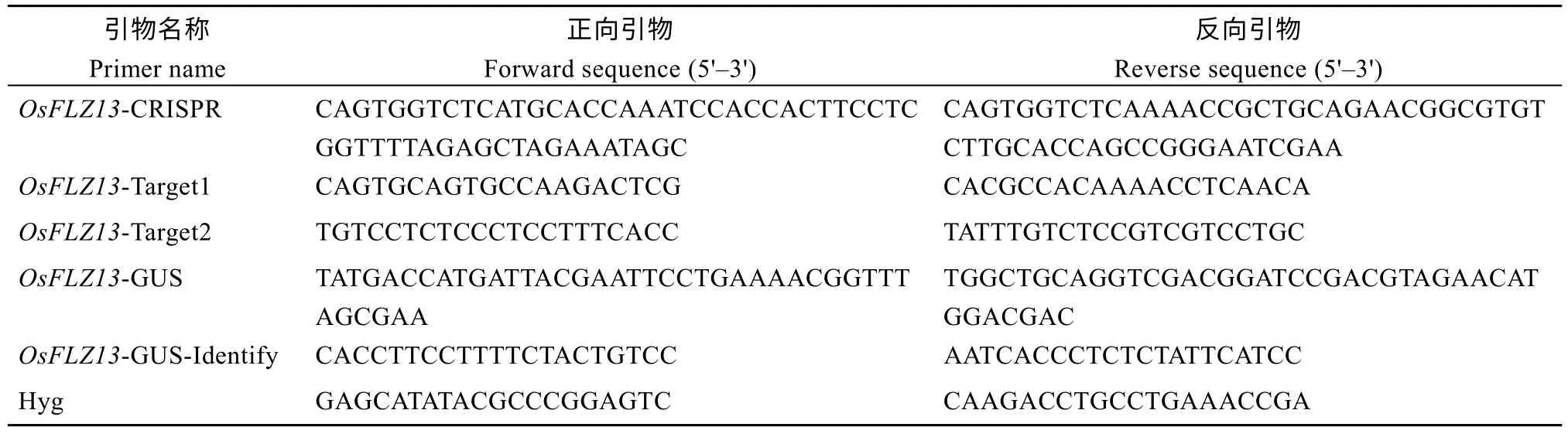
表1 引物及序列表Table 1 Primers and sequences in this study
1.7 GUS 染色和花粉染色观察
OsFLZ13GUS 报告基因的定性检测根据Lee 和Schöffl 的方法[24]。OsFLZ13的CRISPR-Cas9 材料的花粉经碘-碘化钾染色后, 使用体式显微镜(leica S8AP0, Weztlar, 德国)观察花粉活力。
2 结果与分析
2.1 水稻FLZ 家族基因成员的鉴定与蛋白质理化性质
以拟南芥(Arabidopsisthaliana) 16 个、大豆(Glycinemax) 37 个、二穗短柄草(Brachypodium distachyon) 26 个、玉米(Zeamays) 29 个、大麦(Hordeumvulgare) 16 个FLZ 蛋白为参考序列, 通过TBtools 的Blast 功能对水稻的蛋白质文件进行检索,共获得31 个水稻基因。其中, 29 条序列具有FLZ 结构域, 其余2 个基因没有检索到FLZ 结构域。参考RAP (https://rapdb.dna.affrc.go.jp/)数据库的命名信息, 将其基因命名为OsFLZ1~OsFLZ29。蛋白质一级结构理化性质分析见表2。OsFLZ基因核酸长度在309 (OsFLZ21)~1167 (OsFLZ1)个碱基之间, 平均核苷酸数量为555.3。编码的蛋白质序列长度介于103(OsFLZ21)~389 (OsFLZ1)个氨基酸, 平均氨基酸数量为185.1。OsFLZ 等电点(Isoelectric point)最小值是4.33 (OsFLZ2), 最大值是11.05 (OsFLZ25)。其中17个等电点小于7, 为酸性蛋白, 12 个等电点大于7, 为碱性蛋白, 平均值为7.19。分子量在10.75 (OsFLZ21)~39.42 (OsFLZ1) kD 之间。蛋白质不稳定系数在50.35(OsFLZ9)~94.87 (OsFLZ16)之间, 平均亲疏水性在-1.02 (OsFLZ14)~0.05 (OsFLZ15)之间, 脂肪族指数在40.07 (OsFLZ20)~82.36 (OsFLZ15)之间。根据不稳定系数小于40 为稳定蛋白的原则, 推测水稻FLZ 家族均为不稳定蛋白。其中OsFLZ13 只含有120 个氨基酸, 属于小分子肽, 等电点为9.50, 不稳定系数为56.63, 脂肪族指数为51.76, 平均疏水性为-0.93。

表2 水稻FLZ 家族基因编码蛋白的理化性质Table 2 Physicochemical properties of proteins encoded by OsFLZ family genes
2.2 水稻FLZ 蛋白保守基序、结构域与基因结构
CDD 搜索发现, 水稻FLZ 均含有FLZ 结构域,OsFLZ19 (LOC_Os06g05970)还含有一个未知功能620 结构域(DUF620) (图1-B)。OsFLZ17、OsFLZ19、OsFLZ23 含有zf-FLZ superfamily, 其他的OsFLZ蛋白含有zf-FLZ 结构域。通过MEME 在线工具分析OsFLZ 蛋白序列, 共获得14 个保守基序(motif),根据 E 值依次命名为 motif1 至 motif14。除了OsFLZ17 只含有motif1, 所有的OsFLZ 蛋白都含有motif1 和motif2 (图1-A)。这表明motif1 和motif2是 OsFLZ 蛋白的重要组成部分, 其中 motif1(CX2CX3LX4DX3YX5FCSX2CR)是FLZ 蛋白的标志序列, OsFLZ19 由motif10、motif2 组成DUF620。此外, OsFLZ15、OsFLZ8 不仅含有motif1 和motif2,还含有 motif13。从基因结构看,OsFLZ1和OsFLZ3、OsFLZ11、OsFLZ13、OsFLZ17、OsFLZ19、OsFLZ28含有2 个内含子,OsFLZ2含有3 个内含子(图1-C)。
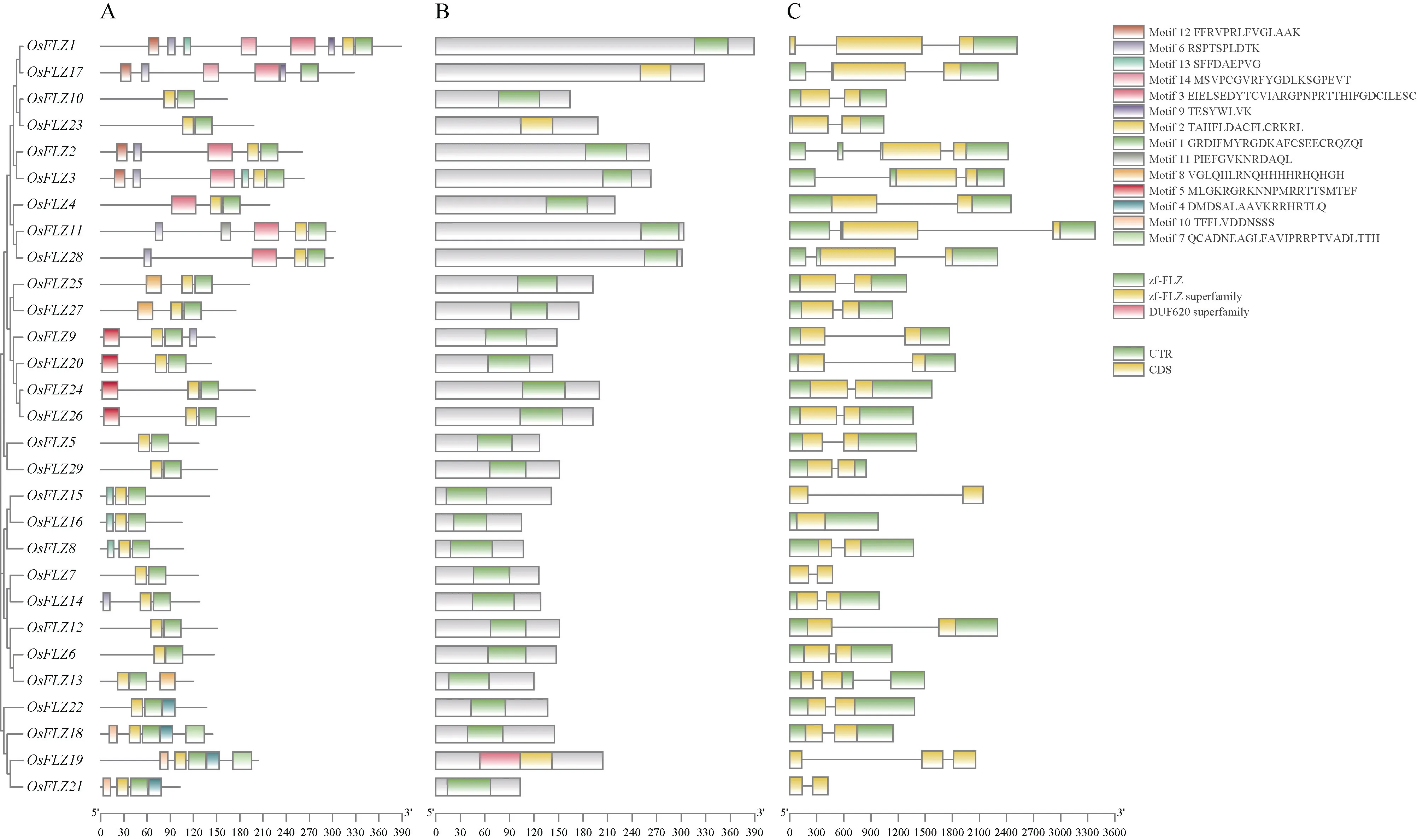
图1 OsFLZ 家族基因蛋白保守基序、结构域和基因结构分析Fig. 1 Analysis of conserved motifs, domains, and gene structure of OsFLZ family genes
2.3 水稻FLZ 家族基因启动子区的顺式作用元件
为进一步研究OsFLZ基因的转录调控机制, 对基因ATG 上游2000 bp 启动子序列进行分析表明,OsFLZ 家族基因启动子区至少包含58 种顺式元件(图2)。这些元件主要分为光信号响应元件、激素和胁迫响应元件和生长代谢元件3 个大类。其中, 光响应元件和植物激素响应元件占比较高, 大部分水稻FLZ 家族基因都包含光响应元件, 在基因的上游序列中普遍存在G-box。激素和胁迫响应元件也广泛存在于水稻FLZ 家族基因中, 包括对生长素、赤霉素、脱落酸和低温胁迫响应相关的元件。激素响应元件中参与脱落酸反应、茉莉酸甲酯反应的元件占比较高。其中24 个基因的启动子中含有参与茉莉酸甲酯反应的CGTCA-motif 和TGACG-motif, 27 个基因含有与脱落酸响应相关的调控元件ABRE, 表明水稻FLZ 家族基因可能参与调控脱落酸和茉莉酸甲酯反应。胁迫响应元件中, 含有较多的厌氧诱导的响应元件(ARE), 还有部分低温胁迫(LTR)和干旱诱导(MBS)响应元件, 表明水稻FLZ 家族基因可能参与抵抗严寒和干旱。FLZ 家族基因的第3 大类顺式作用元件是参与生长代谢的元件, 调控细胞周期调节、昼夜节律控制、胚乳表达、栅栏叶肉细胞分化、玉米醇溶蛋白代谢、根特异性调节和分生组织表达等生命过程。OsFLZ13基因的启动子区包括参与光反应、脱落酸反应、茉莉酸甲酯反应、赤霉素反应、厌氧和缺氧诱导的顺式作用元件, 还含有干旱诱导的MYB 结合位点、低温胁迫响应元件。其中光反应、脱落酸反应响应元件占比较多。

图2 水稻FLZ 家族基因顺式作用元件分析Fig. 2 Cis-regulatory elements analysis of OsFLZ family genes in rice
2.4 水稻FLZ 家族基因的表达模式分析
构建了29 个OsFLZ 家族基因在24 个不同组织中的表达热图(图3-A)。大部分OsFLZ 家族基因在各组织中均有表达, 在不同组织中的表达量差异较大。部分OsFLZ 家族基因表达表现为组织特异性,如OsFLZ15、OsFLZ18和OsFLZ22在吸胀的种子高度表达,OsFLZ24和OsFLZ26在幼苗的根和叶中表达较高,OsFLZ5、OsFLZ7、OsFLZ8和OsFLZ27在抽穗期前的茎中特异表达,OsFLZ2在抽穗期的茎中表达量较高,OsFLZ10在圆锥花序发育第3 阶段的叶中表达量较高,OsFLZ20在开花前的颖壳中表达量较高。OsFLZ6和OsFLZ13在开花前的雄蕊中特异性表达, FPKM值分别为20,477.6和37,139.7。OsFLZ3、OsFLZ9和OsFLZ23在授粉后的胚乳中表达较高。OsFLZ4在抽穗期前的茎和开花前的雄蕊中表达较高,OsFLZ28在抽穗期前后的茎中有一定表达。
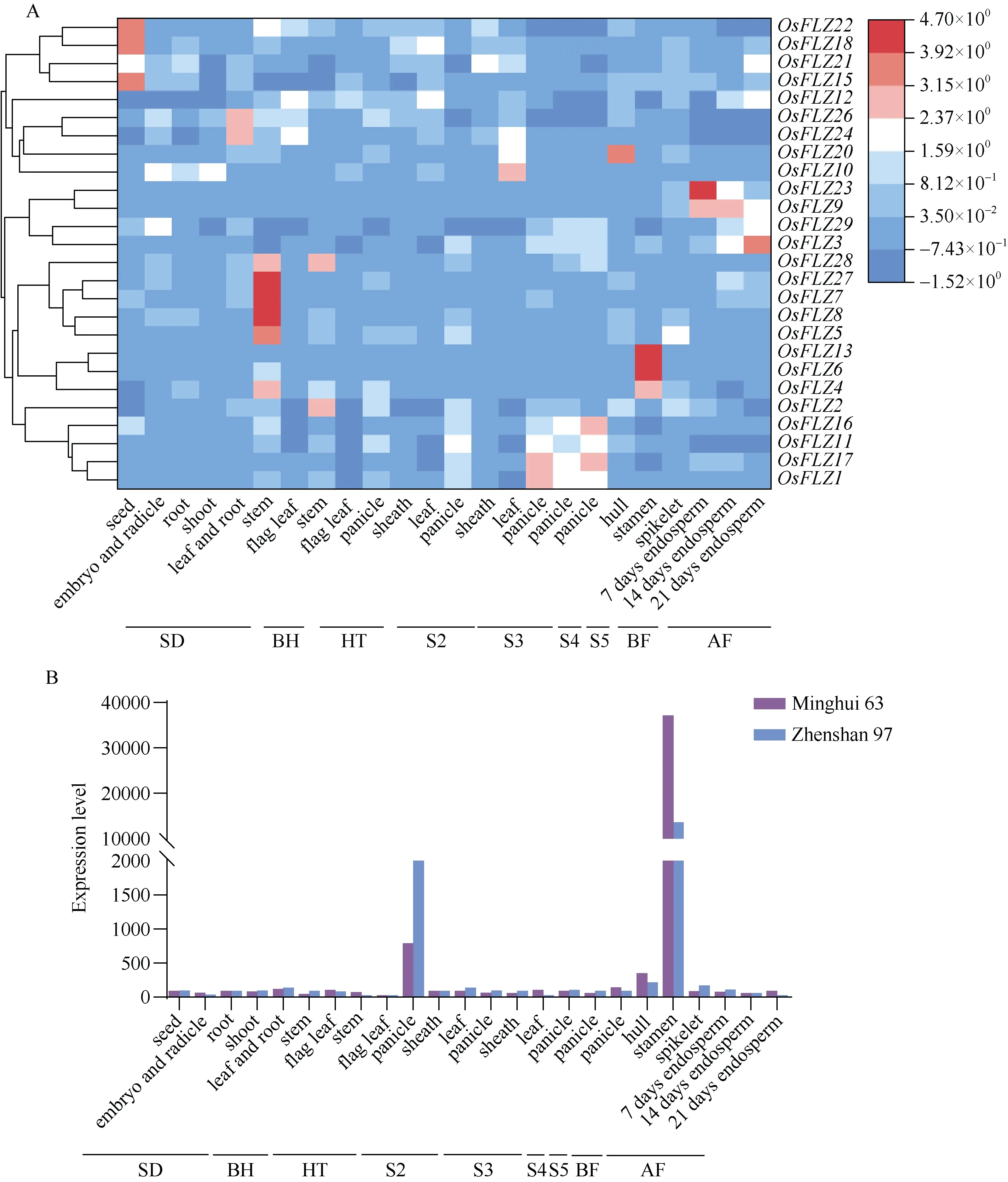
(图3)
通过比较表达数据聚类与进化树发现, 表达模式相近的OsFLZ 家族基因序列相似, 倾向于聚在一类。例如,OsFLZ6和OsFLZ13在进化上聚为一类,而且均在开花前的雄蕊中特异性表达。基因的启动子顺式元件组成也比较接近(图 2),OsFLZ6和OsFLZ13启动子序列中含有17 种相同元件, 这也可以解释这2 个基因相似的表达模式。有意思的是,OsFLZ13表现更为特异, 在水稻的2 个品种珍汕97(Zhenshan 97, ZS97)和明恢63 (Minghui 63, MH63)中均在开花前雄蕊中高度特异表达(图3-B)。在小穗中有一定的表达, 可能是其中含有雄蕊的缘故。因此, 推测该基因和水稻花药发育有关。
OsFLZ 家族基因表达的组织特异性还与更细化的组织发育时期有关。研究发现, 在胚乳发育的不同时期, OsFLZ 家族基因成员的表达模式也有细微差异(图3-A)。例如OsFLZ23在授粉后7 d 的胚乳中表达量高达38,950.7, 而在授粉后14 d 的胚乳中表达量为18,789.4, 授粉21 d 后表达量仅为4244.2, 逐渐下降。与之相反的是OsFLZ3在授粉后的第7 天、第14 天、第21 天, 表达量逐渐升高。因此, 水稻FLZ 家族基因的表达不仅具有组织特异性, 而且具有发育时期特异性。
OsFLZ 家族基因的幼苗在赤霉素(GA3)、激动素(KT)和萘乙酸(NAA)处理后, 大部分基因表达水平改变(图3-C)。处理后,OsFLZ18 在幼苗中表达量大幅度降低。OsFLZ24表达量显著升高, 尤其是在激动素处理后。48 h 黑暗或者光照处理同样改变了 OsFLZ 家族基因在胚芽和幼根中的表达水平(图3-C)。首先是胚芽中表达水平的改变, 无论是光照还是黑暗处理,OsFLZ8、OsFLZ9、OsFLZ21、OsFLZ23、OsFLZ26、OsFLZ27、OsFLZ28和OsFLZ29表达水平下调,OsFLZ1、OsFLZ15、OsFLZ17的表达水平上调; 然后是在幼根中表达水平的改变, 光照或黑暗处理后,OsFLZ9、OsFLZ21、OsFLZ23、OsFLZ26、OsFLZ27、OsFLZ28和OsFLZ29的表达水平下调, 而OsFLZ4、OsFLZ7、OsFLZ11、OsFLZ12、OsFLZ20则表达水平上调。
激动素处理后,OsFLZ13在幼苗中的表达水平上调。无论是在胚芽还是幼根, 48 h 的光照或黑暗处理,都使OsFLZ13的表达水平上调(图3-C)。说明OsFLZ13可能与水稻幼苗抵御不良环境胁迫相关功能有关。
2.5 OsFLZ13 组织器官表达的GUS 染色和亚细胞定位
克隆了OsFLZ13基因启动子序列并连接到载体pCAMBIA1381Z, 遗传转化获得阳性转基因植株。取转基因植株的萌发种子、根、叶、茎节和茎节间,以及花期的小穗和花药进行了GUS 染色(图4)。在营养生长期, 除在萌发种子的胚芽鞘以及茎秆的幼嫩部位有少量染色外, 其余组织无染色, 说明OsFLZ13在营养生长期表达量低(图4-A, B)。在生殖生长期的花药不同发育阶段, 主要在花药发育的后期着色(st11~st14), 说明OsFLZ13可能影响花药后期的发育(图4-C)。此外, 在雌蕊未见着色, 说明OsFLZ13在雌蕊不表达(图4-D)。进一步观察发现,在花药发育st8b 时期, 绒毡层已有轻微染色, 但花粉没有染色, 花药发育st13 和st14 时期, 花粉粒染色较深, 说明OsFLZ13可能先影响了绒毡层后再影响花粉的发育(图4-E, F)。

图4 pCAMBIA1381Z-OsFLZ13 转基因水稻营养和生殖组织器官的β-D-葡萄糖苷酸酶(GUS)染色Fig. 4 β-glucuronidase (GUS) staining of the tissues and organs across vegetative and reproductive stages from the pCAMBIA1381Z-OsFLZ13 transgenic rice plants
克隆中花11 的OsFLZ13基因CDS 序列(不含终止密码子), 并构建表达载体 35S::OsFLZ13::eGFP,在烟草叶片表皮细胞中瞬时表达, 观察蛋白的亚细胞定位。根据荧光出现的位置判断, OsFLZ13 蛋白定位于质膜和细胞核中, 与生物信息学预测结果一致(图5)。
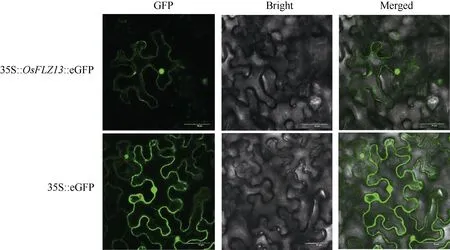
图5 OsFLZ13 蛋白在本氏烟草中的亚细胞定位Fig. 5 Subcellular localization of OsFLZ13 protein in Nicotona benthamiana
2.6 OsFLZ13 的CRISPR/Cas9 材料构建和突变体水稻表型观察
由于OsFLZ13在开花前的花药中特异表达, 推测可能和花粉育性相关, 构建了OsFLZ13的CRISPRCas9 载体遗传转化水稻中花11 (图6-A, B)。经组织培养获得13 株再生植株, 取叶片提取DNA, 利用潮霉素引物进行阳性鉴定, 共获得9 株阳性再生植株。对转基因阳性株系T1代植株基因的2 个靶点区域PCR 扩增和测序, 结果均为双峰, 未获得纯合转基因株系。通过与野生型序列比较分析, 筛选出在2个靶点均产生突变的2 个独立转化株系(Osflz13-1和Osflz13-2) (图6-C)。Osflz13-1在靶点1 插入一个碱基C, 在靶点2 缺失3 个碱基。Osflz13-2在靶点1缺失12 个碱基, 在靶点2 缺失3 个碱基(图6-C)。
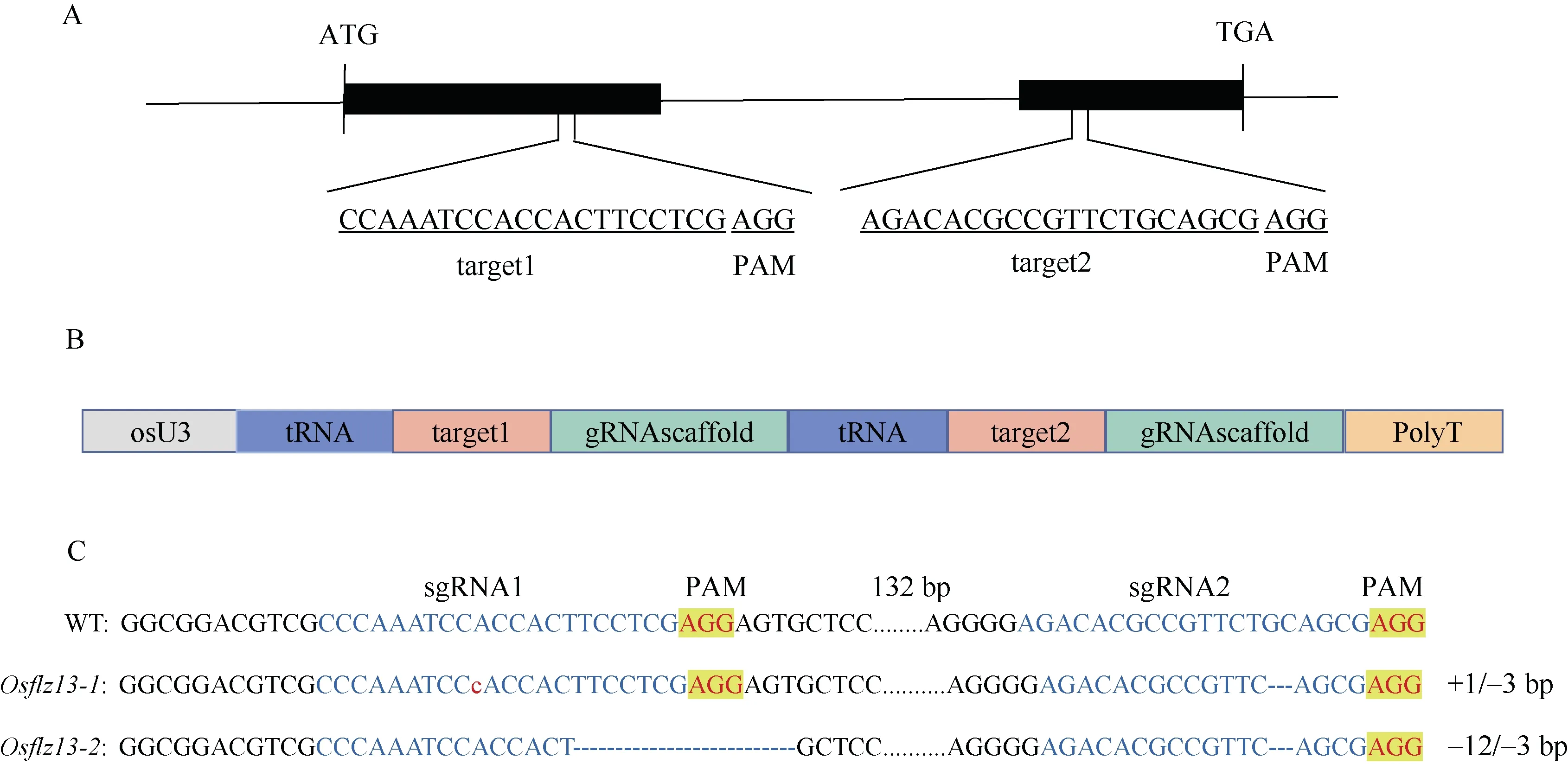
图6 CRISPR/Cas9 编辑材料(Osflz13-1 和Osflz13-2)构建过程及Osflz13 基因序列Fig. 6 Construction of CRISPR/Cas9 editing lines (Osflz13-1 and Osflz13-2) and Osflz13 gene sequences
观察2 个突变株系的T1代植株的小花, 发现和野生型植株在花药发育的st13 有明显差异, 突变体花药变小而雌蕊无明显差异(图7-A, B)。对突变体开花前的花粉碘染, 显示Osflz13-1和Osflz13-2均有50%以上的花粉败育(图7-C)。这与GUS 染色中,OsFLZ13在花药发育的第13 阶段和第14 阶段高度表达的结果一致。野生型的穗粒饱满稻穗弯曲, 突变体植株有大量空瘪种子, 稻穗直立(图7-D)。野生型结实率高达94%, 突变体结实率显著降低(图7-E),突变体Osflz13-1和Osflz13-2的结实率分别只有44%和36% (图7-F)。

图7 Osflz13 突变体植株的雄蕊、雌蕊和花粉育性的观察及其结实率Fig. 7 Stamen, pistil, pollen fertility, and seed-setting rates of Osflz13 mutant plants
3 讨论
FLZ 基因家族对植物的生长发育和逆境胁迫具有重要的作用。一般认为, FLZ 蛋白的主要功能是介导蛋白质之间的相互作用[25]。FLZ 蛋白能够通过与SnRK1α 亚基相互作用, 发挥在糖代谢、发育和应对胁迫方面的调控功能。目前, 在水稻中FLZ 家族基因功能研究较少。有报道表明,OsFLZ2通过与短日照条件下的开花激活基因OsMADS51相互作用延迟开花[26]。最近有研究对水稻OsFLZ 家族做了较系统的分析, 指出OsFLZ18负向调控水稻抽穗期, 并且负向调控水稻抗淹水胁迫[12-13]。但FLZ 家族基因在水稻生长发育中特别是花发育中的作用缺乏研究,绝大部分成员功能尚不明确。
本研究采用同源序列搜索方法在水稻中鉴定了29 个OsFLZ 家族基因, 分析了该家族蛋白的理化性质、基因结构、蛋白保守结构域、顺式作用元件等信息。研究发现, OsFLZ 具有高度保守的FLZ 结构域, 蛋白质长度较小, 在103~389 个氨基酸之间。水稻FLZ 家族和玉米、大豆等植物中鉴定的FLZ 家族基因具有很高的相似性[27-28]。从结构域看, 目前发现的植物FLZ 蛋白均只含有FLZ 单结构域, 且不含有跨膜结构和信号肽序列[25]。OsFLZ 蛋白也基本类似, FLZ 结构域均含有保守motif, 并且呈现α-β-α 的二级拓扑结构特征。基因结构分析也显示OsFLZ 家族基因与其他植物的FLZ 家族基因相似, 大部分只含有单一的内含子(图1-C), 部分成员具有2 个或3个内含子。但研究发现, OsFLZ19 除了含有FLZ 结构域外, 还含有一个DUF620 (图1-B)。值得注意的是, 在生物信息预测中, OsFLZ 蛋白均不含有跨膜结构域和信号肽。但研究表明OsFLZ2、OsFLZ5、OsFLZ6、OsFLZ11、OsFLZ18、OsFLZ20 和OsFLZ27定位于细胞核和细胞质[12]。亚细胞定位中, 本研究OsFLZ13 也定位于细胞核和质膜。可能是因为有些蛋白质的定位不依赖于经典的信号肽路径, 而是通过非典型信号肽或者直接与其他蛋白质相互作用形成复合物等方式定位, 这有待进一步研究。
植物基因的表达模式与功能密切相关。水稻FLZ 家族基因家族成员表达模式多样, 有些成员表现时空和组织特异性, 如OsFLZ5、OsFLZ7、OsFLZ8和OsFLZ27只在抽穗期前的茎中表达(图3-A)。在水稻花序发育不同阶段中, 大多数OsFLZ 家族基因表达较高。OsFLZ1、OsFLZ4、OsFLZ6、OsFLZ13、OsFLZ16和OsFLZ17在生殖器官中高水平表达。在拟南芥中, 有些AtFLZ 家族基因也在生殖阶段的花中具有更高的表达水平[16]。在水稻中,OsFLZ2通过与正向调控水稻抽穗期的转录因子OsMADS51相互作用调控水稻抽穗期, 延迟开花[26]。OsFLZ18负向调控水稻抽穗期, 过量表达OsFLZ18可导致抽穗延迟, 抑制了植株中开花途径相关基因Ehd1、Hd3a和RFT1的表达[13]。过表达OsCTZFP8植株在冷处理下可保持高的花粉活力和结实率[29]。本研究发现, 家族基因成员OsFLZ13在雄蕊中高度特异表达。因此,有必要进一步了解OsFLZ 家族基因在水稻生殖生长中的作用。随后的GUS 染色进一步明确了该基因在发育后期的花药中特异表达, 在雌蕊中无表达。通过CRISPR 基因编辑获得的突变体Osflz13大部分花粉丧失活性, 结实率显著降低。因此, 本研究表明OsFLZ13参与水稻花药发育, 对于产生正常育性的花粉具有重要作用。本研究首次发现了OsFLZ13在花药发育和花粉育性中的作用, 对于花粉育性形成机理研究以及杂种优势的利用具有积极的意义。但OsFLZ13作用的分子机制, 及其是否与花药开裂以及花粉和柱头的识别、花粉管萌发有关有待进一步阐明。
4 结论
本研究共鉴定了FLZ 家族成员29 个, 分布在11 条染色体上, 具有特定的FLZ 结构域。OsFLZ 家族基因表达多样化, 有些成员具有组织特异性。其中OsFLZ13亚细胞定位在质膜和细胞核, 在开花前的花药中特异性表达, 并通过 β-D-葡萄糖苷酸酶(GUS)活性染色证实。通过CRISPR/Cas9 基因编辑技术获得了2 个独立转化株系, 发现突变体植株花粉粒活性丧失, 结实率显著下降。本研究为揭示FLZ 家族基因成员在水稻生长发育中的功能建立了基础。

