GJB6和PRKAA1基因多态性及其与槐山羊产羔数的关联分析
韩浩园,李 涛,李世凯,宋小雨,李 君,哈 斯,赵金艳,魏红芳,权 凯
(1.河南牧业经济学院 动物科技学院,河南 郑州 450046;2.华南农业大学 动物科学学院,广东 广州 510642;3.宁夏大学 农学院,宁夏 银川 750021)
产羔数是山羊生产中重要的经济指标,山羊的产羔数由多个基因共同控制,遗传力低,常规的育种技术难以对其改良。利用标记辅助选择(Marker-assisted selection,MAS)技术对山羊的产羔数量性状进行筛选,已成为当前的研究热点。
间隙连接蛋白(Connexin,Cx)也称为缝隙连接通道,可形成细胞间膜通道,细胞间以此连接通道为直接途径传递代谢物质和信号分子[1]。卵巢、卵泡、卵母细胞以及胚胎发育等生理过程均受间隙连接蛋白调控。研究发现,特异性敲除小鼠颗粒细胞的Cx后,造成卵泡形态异常,卵母细胞的胞质和颗粒细胞空泡化。在卵泡发育的早期阶段,含有Cx组成的连接通道是维持颗粒细胞群扩张所必需的,若缺乏连接通道会对卵母细胞的生长与成熟造成损害[2]。Cx家族成员众多,编码间隙连接蛋白30(Cx30)的GJB6基因属于Cx家族成员,目前,GJB6基因研究主要集中在耳聋以及其他疾病上[3-4]。关于GJB6基因与繁殖性能关系的研究极少,仅在云上黑山羊产羔性能研究中发现,GJB6基因突变位点GJB6g.50694816A>G和GJB6g.50694819G>A的不同基因型与产羔数间相互关联,且差异性显著,可作为云上黑山羊产羔数选择的潜在分子标记[5]。此外,有研究发现,GJB6蛋白在卵丘细胞的细胞质中表达[6]。综上所述,Cx家族GJB6基因在动物繁殖性能方面研究较少,但可能影响山羊的产羔性状。
腺苷活化蛋白激酶α1亚基(Protein kinase,AMP activated α1,PRKAA1)蛋白属于哺乳动物的单磷酸腺苷活化蛋白激酶(AMP-activated protein kinase,AMPK)家族中一员,是在血管细胞和单核/巨噬细胞中发现的主要亚型,在哺乳动物中参与细胞生长、细胞周期调节和能量代谢等多种过程[7-8]。PRKAA1是构成AMPK的催化亚基之一。研究发现,PRKAA1具有维持猪和牛卵母细胞减数分裂的作用[9],其他PRKAA1基因多态性研究多集中于胃癌、慢性乙型肝炎等疾病中[10-11]。有关PRKAA1基因与山羊繁殖性能关系的研究极少,仅Wang等[12]在济宁青山羊群体中检测到PRKKA1基因为潜在的产羔数性状关联的候选基因。然而,山羊PRKAA1基因的遗传多态性及其与产羔数的关系尚未见报道。
槐山羊是国内为数不多的高繁力山羊品种,为了筛选GJB6和PRKAA1基因的单核苷酸多态性(Single nucleotide polymorphism,SNP)突变,并探究GJB6和PRKAA1基因SNP与山羊产羔性状之间的关系,本研究检测了不同产羔数槐山羊群体中GJB6和PRKAA1基因多态位点,对筛选出的SNP与槐山羊的产羔数进行了相关性分析,以期能够找出与槐山羊产羔数相关的潜在分子标记,为GJB6和PRKAA1基因功能的进一步研究奠定基础。
1 材料和方法
1.1 样本采集
利用负压抗凝采血管采集122只母羊颈静脉血液样本,依据沈丘县农牧科技研发中心的繁殖记录表,记录母羊的产羔季节、胎次、产羔数等信息,依据产羔数将群体分为单羔组(54只)、双羔组(59只)和多羔组(9只),血液样本置于干冰暂时保存,带回实验室后置于-80 ℃冰箱中保存备用。
1.2 DNA提取
利用血液基因组柱式小量提取试剂盒(Blood Genomic DNA Mini Kit,北京艾德莱生物科技有限公司)提取122只槐山羊颈静脉血样的全基因组DNA。采用紫外可见分光光度计法对DNA的浓度和质量进行测定。将基因组DNA稀释至15 ng/μL,放置4 ℃进行保存,用于后续试验。
1.3 引物设计
基于NCBI数据库中已经公开的山羊GJB6基因(登录号:XM_018056534.1)和PRKAA1基因(登录号:XM_018065500.1)的参考序列,使用Primer Premier 5.0设计特异性扩增引物(表1)。引物由生工生物工程(上海)股份有限公司合成。

表1 GJB6和PRKAA1基因的引物序列
1.4 PCR扩增
PCR扩增反应体系为25 μL,包括ddH2O 10.5 μL、2×TaqPCR Master Mix(康为世纪)12.5 μL、上下游引物各0.5 μL(10 μmol/L)、DNA模板1 μL(20 ng/μL)。PCR扩增条件:94 ℃预变性3 min;94 ℃变性30 s,退火30 s(退火温度见表1),72 ℃延伸1 min,共34个循环;最后72 ℃延伸5 min,4 ℃保存。PCR产物经1%的琼脂糖凝胶电泳检测后,扩增条带单一且明亮的引物用于后续试验。
1.5 SNP扫描及基因分型
依据产羔数,将122个槐山羊DNA样品混合为9个DNA池,进行PCR及琼脂糖凝胶电泳检测后,经生工生物工程(上海)有限公司测序,使用SeqMan软件对测序峰图进行分析,筛选混合样的突变位点。采用产生突变位点的引物对122只槐山羊样品进行测序及基因分型。
1.6 数据分析
利用Excel软件,对SNP的基因型频率、等位基因频率、基因杂合度(Gene heterozygosity,He)、多态信息含量(Polymorphic information content,PIC)和有效等位基因数(Effective allele numbers,Ne)等进行计算,并进行哈代温伯格平衡(Hardy-Weinberg equilibrium,H-W)检验。利用SHEsis Main数据库(http://analysis.bio-x.cn/)对SNP进行连锁不平衡(Linkage disequilibrium,LD)与单倍型分析。采用SPSS 26.0中的一般线性模型(One-way ANOVA)进行槐山羊GJB6基因和PRKAA1基因SNP与产羔数的关联分析,并进行不同单倍型与产羔数的关联分析。
2 结果与分析
2.1 PCR扩增结果
对GJB6和PRKAA1基因序列进行PCR扩增后,琼脂糖凝胶电泳结果表明,GJB6基因第2,3对引物及PRKAA1基因第4,5,6,7对引物扩增产物条带清晰、单一、整齐,没有残留,目的条带与预期扩增片段大小一致,可用于后续研究。部分扩增结果如图1所示。
M.Marker;1—3.混合样1,2,3。
2.2 槐山羊GJB6和PRKAA1基因SNP扫描结果
测序发现,GJB6和PRKAA1基因共存在5个SNP,其中,以已知山羊的GJB6基因(XM_018056534.1)序列为参照,槐山羊的GJB6基因存在2个SNP位点,分别位于第837 bp(C/T)和840 bp(T/C)处(图2),均为同义突变,C837T突变前后均编码丝氨酸,T840C突变前后均编码缬氨酸。与参考序列NC_030819.1比对后,将GJB6基因的C837T突变命名为g.50694819 C>T,将T840C突变命名为g.50694816 T>C。
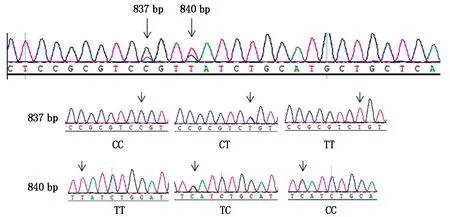
图2 GJB6基因2个SNP位点测序峰图
以已知山羊的PRKAA1基因(XM_018065500.1)序列为参照,槐山羊PRKAA1基因存在3个SNP位点,分别位于第2 287 bp(T/C)、第3 898 bp(T/C)和第4 193 bp(A/T)处(图3),3个突变均位于基因的非编码区,不编码氨基酸。与参考序列NC_030827.1比对后,分别将PRKAA1基因T2287C突变、T3898C突变和A4193T突变命名为g.33691489 T>C、g.33693100 T>C和g.33693395 A>T。

图3 PRKAA1基因3个SNP位点测序峰图
2.3 槐山羊GJB6和PRKAA1基因分型
利用DNAstar软件以及Excel软件将分型结果进行整理,结果显示,GJB6和PRKAA1基因的5个SNP均存在3种基因型,各基因型的个体数分布见表2。分别对5个SNP进行基因型频率和等位基因频率分析(表3)。GJB6基因g.50694819 C>T位点的等位基因频率存在明显的差异,C为优势等位基因,等位基因频率为0.909 8;g.50694816 T>C位点TT为优势基因型,T为优势等位基因,等位基因频率为0.762 3;PRKAA1基因的g.33691489 T>C位点TC为优势基因型,C为优势等位基因,等位基因频率为0.557 4;g.33693100 T>C位点TT为优势基因型,T为优势等位基因,等位基因频率为0.909 8;g.33693395 A>T位点AT为优势基因型,A为优势等位基因,等位基因频率为0.536 9。

表2 GJB6和PRKAA1基因SNP分型结果
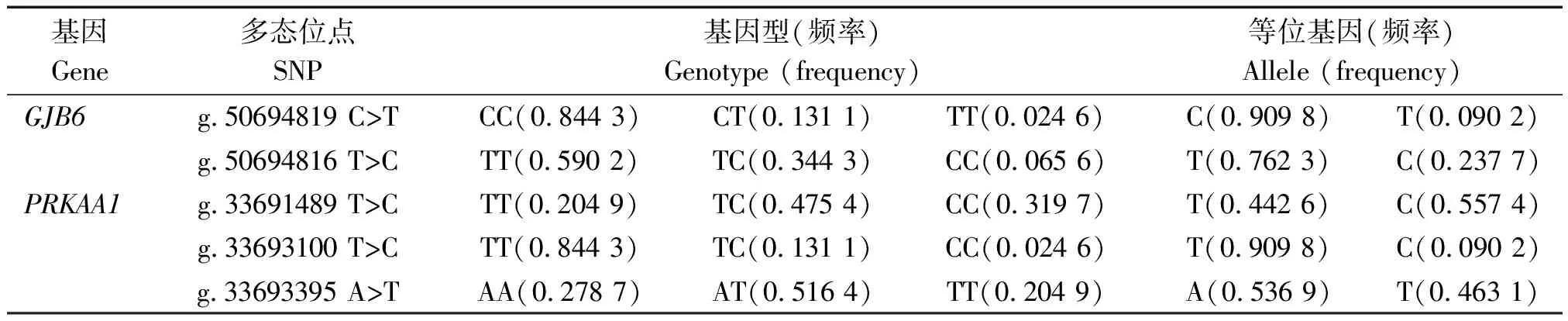
表3 槐山羊5个SNP位点基因型频率与等位基因频率
2.4 槐山羊GJB6和PRKAA1基因SNP遗传多样性分析
对GJB6和PRKAA1基因的SNP位点进行了卡方检验(χ2)及多态信息含量、杂合度、有效等位基因数等遗传参数分析(表4),结果表明,GJB6基因g.50694819 C>T位点和PRKAA1基因g.33693100 T>C位点多态信息含量低于0.25,属于低度多态,与杂合度结果相符;GJB6基因g.50694816 T>C位点、PRKAA1基因g.33691489 T>C和g.33693395 A>T位点属于中度多态位点。Hardy-Weinberg平衡分析显示,5个SNP位点χ2检验结果均小于5.99,处于Hardy-Weinberg平衡。

表4 槐山羊GJB6和PRKAA1基因SNP位点的遗传多样性
2.5 槐山羊GJB6和PRKAA1基因SNP的连锁不平衡分析
槐山羊群体GJB6和PRKAA1基因5个SNP的连锁不平衡分析结果显示,GJB6基因g.50694819 C>T和g.50694816 T>C位点间D′=0.862、r2=0.236(D′>0.8,r2<0.33),为弱连锁平衡状态;PRKAA1基因的g.33691489 T>C和g.33693395 A>T位点间D′=1.000、r2=0.685(D′>0.8,r2>0.33),属于强连锁平衡状态,而g.33693100 T>C和g.33691489 T>C以及g.33693100 T>C和g.33693395 A>T之间D′>0.8,r2<0.33,为弱连锁平衡状态。
2.6 槐山羊GJB6和PRKAA1基因型与产羔数的关联分析
应用SPSS 26.0软件的一般线性模型对GJB6和PRKAA1基因中存在的SNP位点进行基因型与产羔数的关联性分析,结果见表5。GJB6基因SNP不同基因型间的产羔数差异不显著。而PRKAA1基因g.33691489 T>C位点的TC基因型个体产羔数与CC基因型个体产羔数差异显著,TC基因型产羔数比CC基因型多0.603只;g.33693395 A>T位点AT基因型个体产羔数与TT、AA基因型个体产羔数差异显著,AT基因型产羔数比TT基因型多0.459只。结果表明,g.33691489 T>C位点TC基因型和g.33693395 A>T位点AT基因型的产羔数较高。

表5 GJB6和PRKAA1基因突变位点的多态性与槐山羊产羔数的关联分析
2.7 GJB6和PRKAA1基因SNP单倍型与产羔数的关联分析
单倍型分析发现,GJB6基因的2个SNP将群体分为4种单倍型:CC、CT、TC和TT。利用SPSS 26.0软件分析单倍型与产羔数的相关性,结果表明,GJB6基因不同单倍型与产羔数不显著(表6)。

表6 GJB6和PRKAA1基因单倍型对槐山羊产羔数的影响
PRKAA1基因的3个SNP将群体分为5种单倍型:CCT、CTA、CTT、TTA和TCA。单羔和双羔群体中存在4种单倍型,分别为CCT、CTA、CTT和TTA;多羔群体中存在4种单倍型,分别为CTA、CTT、TTA和TCA。单倍型与产羔数之间的关联分析表明,TCA单倍型个体产羔数显著高于CTT、CTA和TTA单倍型个体(表6)。
3 结论与讨论
3.1 GJB6基因多态性与山羊产羔数的关系
目前,GJB6基因的遗传突变研究主要集中在耳聋等疾病方面[13-14],对于繁殖性状的研究极少。本研究根据沈丘县农牧科技研发中心的繁殖记录,共采集54只产单羔母羊、59只产双羔母羊以及9只产3羔以上的母羊,进行了GJB6基因的SNP及其与产羔数的相关性分析。在槐山羊GJB6基因中发现2个SNP,分别为g.50694819 C>T和g.50694816 T>C,均与陶林等[5]在GJB6基因中发现的突变位点一致。有研究表明,GJB6基因在哺乳动物中相当保守,平均同义替换率远远高于非同义替换率[14],与本研究结果相符。
PIC指标用于衡量基因的变异程度,当PIC水平高,等位基因数量多,杂合度高时,说明该群体的多态位点具有较高的遗传变异,具有很好的选择性。本研究PIC测定结果表明,槐山羊中GJB6基因g.50694816 T>C位点为中度多态(0.25
本研究进行了GJB6基因SNP位点与产羔数的关联性分析,结果表明,g.50694819 C>T位点和g.50694816 T>C位点的不同基因型、单倍型与槐山羊的产羔表型数据均无显著相关性(P>0.05),说明上述位点均不是影响槐山羊产羔数的关键位点。而在云上黑山羊的研究中发现,GJB6基因g.50694816 A>G AA型的产羔数显著高于GG型,g.50694819 G>A GG型的产羔数显著高于AG型。GJB6基因的组合基因型分析发现,AAGG型的产羔数显著高于AGGG型,说明GJB6的2个位点可作为云上黑山羊产羔数选择的潜在分子标记[5]。以上结果表明,GJB6g.50694819 G>A和g.50694816 A>G位点可作为云上黑山羊产羔数的分子标记,却与槐山羊的产羔数无关,说明山羊品种间影响产羔数的基因可能不同。
3.2 PRKAA1基因多态性与山羊产羔数的关系
本研究进行了槐山羊PRKAA1基因的SNP分析,发现3个SNP位点g.33691489 T>C、g.33693100 T>C和g.33693395 A>T,3个SNP位点均位于非编码区,有研究表明,编码区域的突变往往影响个体的正常生长和发育,因此,在非编码区域中检测到的SNP多于编码区域[15-17]。PIC测定结果表明,PRKAA1基因g.33691489 T>C和g.33693395 A>T位点在槐山羊群体中处于中度多态。PIC数值大小可以反映出种群中个体的均一性,数值越大,遗传变异越大,反之,则群体变异越小[18-19]。本研究结果表明,槐山羊g.33691489 T>C和g.33693395 A>T位点杂合度较高,说明这2个位点具有较高的遗传变异,有很好的选择性,且处于强连锁平衡状态,可以通过这些位点进行标记来辅助育种。
目前,尚无对山羊PRKAA1基因SNP与产羔数相关性的研究,本研究中槐山羊PRKAA1基因型与产羔表型的关联分析结果显示,g.33691489 T>C位点的TC基因型产羔数极显著高于CC基因型;g.33693395 A>T位点AT基因型的产羔数显著高于AA、TT基因型。且单倍型分析结果说明,TCA单倍型个体产羔数显著高于CTA、CTT、TTA单倍型,说明PRKAA1基因单倍型TCA槐山羊产羔数更多。在对济宁青山羊产羔数性状的关联分析中,通过对不同产羔数分组的选择消除分析,鉴定出PRKAA1基因是与山羊产羔数相关的潜在候选基因[12]。此外,有研究发现,PRKAA1具有维持猪和牛卵母细胞减数分裂的作用[20-21],vaspin通过调控PRKAA1促进卵母细胞成熟,调控类固醇生成和抑制卵泡细胞凋亡[22-23],本研究结果支持了以上研究结论。且本研究首次发现,g.33691489 T>C和g.33693395 A>T位点与山羊产羔数相关,可作为多羔性状选育的潜在分子标记。但本研究的样本数量有限,且突变位点仅限于非编码区,还需扩大样本数量进一步研究。
综上,在槐山羊GJB6基因中发现2个SNP,分别为g.50694819 C>T和g.50694816 T>C,为同义突变,与槐山羊产羔数之间无显著相关性。在槐山羊PRKAA1基因上共发现了3个SNP,分别为g.33691489 T>C、g.33693100 T>C和g.33693395 A>T,位于非编码区。g.33691489 T>C位点的TC基因型产羔数显著高于CC基因型,g.33693395 A>T位点AT基因型产羔数显著高于AA和TT基因型(P<0.05),可作为槐山羊多羔性状选育的潜在分子标记。

