玉米bZIP转录因子ZmbZIP26的分子特征、亚细胞定位及响应非生物胁迫的表达分析
曹丽茹,马晨晨,庞芸芸,叶飞宇,王振华,鲁晓民
(1.河南省农业科学院 粮食作物研究所,河南 郑州 450002;2.神农种业实验室,河南 郑州 450002)
随着全球气候变暖,加剧了极端干旱天气发生的程度和频率,导致植物在生长过程中受到干旱的影响愈加严重,使粮食生产受到严重威胁。玉米(ZeamaysL.)是世界上主要的粮食作物之一,在全球的种植范围较为广泛,其产量在粮食作物中居于首位[1]。我国是农业大国,玉米不仅是我国重要的粮食作物和饲料作物,工业生产中也是必不可少的原料[2]。随着我国人口数量的增加以及对能源的需求逐渐增长,在有限的耕地面积下,保证玉米的高产、稳产是保障粮食安全的重要途径[3]。玉米在生长过程中需水量大,对水分胁迫十分敏感,干旱会导致玉米产量降低,甚至严重时导致玉米绝收[4],应对干旱胁迫最有效的途径是培育抗旱玉米新品种,而利用分子育种技术改良创制抗旱新种质是最有效的途径之一,因此,对玉米抗旱基因的挖掘和遗传解析是当前重中之重的工作。
植物体内都存在着自我调节机制和自我恢复能力,当环境发生改变时,作物会出现恢复原生长的趋势。干旱胁迫条件下,作物为适应环境会减慢生长,在干旱后复水又会加快生长,在一定程度上弥补干旱胁迫造成的损失,产生了补偿效应或者超补偿效应[5]。补偿效应在自然界普遍存在,是植物应对逆境胁迫的自我调节机制[6]。Wang等[7]研究发现,籼稻幼苗在干旱胁迫程度未超过其耐受阈值时,对其补水后可以产生补偿或超补偿效应,表现出其恢复力和适应性。刘婷婷等[8]通过对高粱幼苗干旱复水处理,发现干旱时,高粱的相对含水量、叶绿素含量等生理指标均有所下降,复水后各项生理指标恢复正常,高粱干旱适应能力与复水后的恢复性呈正相关。饲料大麦的株高、穗长、单株产量等指标随着干旱胁迫时间的增加显著下降,在复水后这些指标都得到了不同程度的恢复,且恢复程度随着复水量的增加而增加[9]。
植物面临干旱胁迫时体内除了生理生化发生变化,在分子水平和蛋白质水平也会发生一系列的变化,分子水平上的改变起着决定性作用[10]。响应干旱胁迫的基因按照其作用的方式可以分为2种,即功能基因和调控基因,其中调控基因包括蛋白激酶和转录因子[11]。转录因子(Transcription factors,TF) 是一种能和基因启动子区中的顺式作用元件特异性结合的蛋白质分子,调控植物的生长发育过程,并在抵御逆境胁迫过程中发挥着重要作用[12]。bZIP转录因子在转录因子中家族成员最多,且广泛存在于植物中,在调节植物响应非生物胁迫的生理过程中起着十分重要的作用[13]。拟南芥中存在多个与抗逆性相关的AtbZIP基因。干旱胁迫下,AtbZIP62基因被强烈诱导,该基因过表达后拟南芥的抗旱能力明显增强[14];AtbZIP1过表达使拟南芥的抗盐、抗旱能力都提高[15];在拟南芥中过表达玉米ZmbZIP72基因,发现其激活了Rd29B、Rab18、His1-3等脱落酸(ABA)诱导基因的高表达,增强了转基因植株的抗旱性[16]。沉默OsbZIP71基因后,发现水稻转基因植株对盐和干旱胁迫十分敏感[17]。SlbZIP1基因通过调节ABA的合成从而影响番茄对盐和旱胁迫的抗性[18]。
目前,有关bZIP转录因子与植物生长发育关系的研究较多,其在植物抗逆中的作用研究也逐渐增多,但关于其响应玉米干旱-复水处理的研究较少。本研究利用高通量测序技术对玉米正常、干旱和恢复浇水条件下的叶片和根系进行转录组测序,筛选到一个bZIP转录因子,暂时命名为ZmbZIP26。对ZmbZIP26进行生物信息学分析,同时运用qRT-PCR技术分析其在玉米不同组织器官中的表达情况,以及在干旱、高温、高盐、氮胁迫处理下的表达特性,为深入研究玉米ZmbZIP26基因的生物学功能奠定基础,也为挖掘抗逆相关分子资源、培育抗逆品种提供依据。
1 材料和方法
1.1 试验材料及处理方法
以玉米优良自交系郑36作为试验材料,当玉米生长到三叶一心时进行干旱胁迫(土壤含水量45%~50%)和复水浇水(土壤含水量大于95%)处理,取胁迫前、干旱胁迫5 d以及复水3 d后的叶片和根系,分别命名为T0dY、T5dY、TR3dY和T0dG、T5dG、TR3dG,5株为一个样品,每个样品3个生物学重复,用于转录组测序和后期差异基因表达量的验证。取在田间正常生长到三叶一心的玉米幼叶、幼茎、幼根,以及抽雄后的成熟叶、成熟茎、成熟根、雄穗、雌穗组织样品进行基因时空表达分析。温室中采用光培养16 h、培养温度为30 ℃,暗培养8 h、培养温度为26 ℃,相对湿度33%~55%。当郑36生长到三叶一心时,取生长一致的玉米苗进行处理,干旱组用20% PEG-6000(Hoagland营养液+20% PEG)处理,盐胁迫组用浓度200 mmol/L的NaCl处理,氮胁迫组将玉米幼苗移至缺乏铵态氮的 Hoagland 营养液中,高温组42 ℃培养,在处理0,4,8,12,24,32,36,48,52,60,72,84 h以及解除胁迫后的12,24 h取玉米根系,3株为一个重复,取3个生物学重复,用于分析基因响应非生物胁迫的表达量变化。取完样品迅速放入液氮中,并存放在-80 ℃的超低温冰箱中。
1.2 转录组测序与差异表达转录因子基因筛选
将样品委托广州基迪奥科技有限公司做高通量测序分析,基因表达量的计算采用FPKM(Fragments per kilobase of exon model per million mapped fragments)算法,根据FPKM值计算基因在处理组和对照组之间的差异倍数,差异表达转录因子基因筛选标准为∣log2(fold change)∣≥1,筛选玉米干旱-复水过程中的差异表达bZIP转录因子,参考Maize GDB(https://www.maizegdb.org/)数据库进行命名。
1.3 ZmbZIP26基因的克隆
对玉米郑36总RNA提取利用RNAprep Pure 多糖多酚植物总 RNA 提取试剂盒(天根生化科技有限公司)的方法,根据反转录试剂盒PrimeScriptTM1st Strand cDNA Synthesis Kit(TaKaRa)提供的反应程序(25 ℃,5 min;55 ℃,15 min;85 ℃,5 min)合成cDNA。
在MaizeGDB网站上搜索ZmbZIP26(Zm00001d034199)基因的序列,设计特异性引物(ZmbZIP26-F:ATGGACTGGGCAGCGGCGT和ZmbZIP26-R:CTACTGCCAAGAGAATGGC),以cDNA为模板对ZmbZIP26基因的开放阅读框(ORF)进行扩增,将扩增产物连接到pMDTM18-T载体(TaKaRa)上,转化大肠杆菌DH5α感受态细胞,挑选出阳性单克隆(至少5个样品)送到华大公司进行测序,测序结果与MaizeGDB数据库进行比对。
1.4 ZmbZIP26基因的生物信息学分析
利用ProtParam对ZmbZIP26基因编码蛋白质的分子质量、疏水性及稳定性等进行预测;采用NetPhoS对蛋白质磷酸化位点进行预测;利用SOPMA对ZmbZIP26蛋白的二级结构进行分析;利用软件MEGA 中的PHYLOGENY构建ZmbZIP26蛋白与不同物种同源蛋白的进化树;利用MEME对蛋白质的保守基序(Motif)进行分析,将基序的最大数值设置为6;利用STRING在线工具预测ZmbZIP26的互作蛋白;从 数 据 库 Ensembl Plants(http://plants.ensembl.org/index.html)获取ZmbZIP26基因上游 2 000 bp序列,用Plantcare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对ZmbZIP26基因启动子区的顺式作用元件进行分析。
1.5 实时荧光定量PCR(qRT-PCR)分析
根据ZmbZIP26基因序列设计特异的荧光定量引物(DL-Zm00001d034199-F:CCTTTTCCCCGATTCTCTACTC和DL-Zm00001d034199-R:ACTACGATCTACGACTCTACGA),以玉米18SrDNA作为内参(引物18S-L:CCTGCGGCTTAATTGACTC和18S-R:GTTAGCAGGCTGAGGTCTGG),以上面不同组织、不同胁迫环境的样品RNA反转录cDNA作为模板,参考SYBR Premix Ex TaqTM试剂盒上的程序,采用两步法(95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,40个循环)进行qRT-PCR,采用2-ΔΔCt法对数据进行分析。
1.6 ZmbZIP26蛋白的亚细胞定位分析
亚细胞定位使用表达载体pMDC83-GFP,结合酶切位点SpeⅠ和AscⅠ设计引物(ZmbZIP26-83-GFP-F:CTAGACTAGTATGGACTGGGCAGCGGCGT和ZmbZIP26-83-GFP-R:TTGGCGCGCCCCTACTGCCAAGAGAATGGC)对ZmbZIP26基因进行扩增,经SpeⅠ和AscⅠ双酶切后,用T4-DNA连接酶连接表达载体并转化。将测序正确的重组质粒转到农杆菌EHA105感受态中,利用注射法将农杆菌菌液浸染七叶期生长强壮的烟草叶片,注射48 h后对浸染的叶片通过共聚焦显微镜观察烟草表皮组织细胞内绿色荧光蛋白的表达情况。
2 结果与分析
2.1 ZmbZIP26基因的筛选
对三叶期玉米幼苗进行干旱和复水处理,取根系和叶片部位进行转录组测序,对基因的FPKM值和功能注释进行分析,发现了27个bZIP转录因子成员响应干旱和复水处理,其中ZmbZIP26基因的表达量在正常、干旱和复水处理下达到差异极显著水平(P<0.01)。使用FPKM值计算27个转录因子之间的相关系数(R>0.5),并将这些基因导入软件Cytoscape来构建基因共表达网络,鉴定处于核心节点的关键基因。通过分析,发现ZmbZIP26基因在共表达网络上与其他基因有较高的关联度(图1),说明ZmbZIP26基因是共表达网络的核心关键基因。对玉米叶片和根系中ZmbZIP26进行qRT-PCR分析,发现在干旱胁迫后,该基因在叶片和根系中相对表达量均显著升高,复水后逐渐恢复正常(图2),且定量结果与转录组分析结果一致,表明ZmbZIP26基因在玉米干旱-复水过程中发挥着重要的作用。

图1 差异表达bZIP转录因子基因的共表达网络

不同小写字母表示差异显著(P<0.05)。图5—6同。
2.2 ZmbZIP26基因的克隆和编码蛋白质性质分析
利用RT-PCR技术对ZmbZIP26基因进行扩增,利用1.2%的琼脂糖凝胶电泳,得到了一条大小约为600 bp的条带(图3),切胶回收后连接克隆载体,筛选出阳性单克隆。测序结果表明,该段序列是一个完整的558 bp的开放阅读框,编码了185个氨基酸,与MaizeGDB数据库中B73的参考序列是一致的。
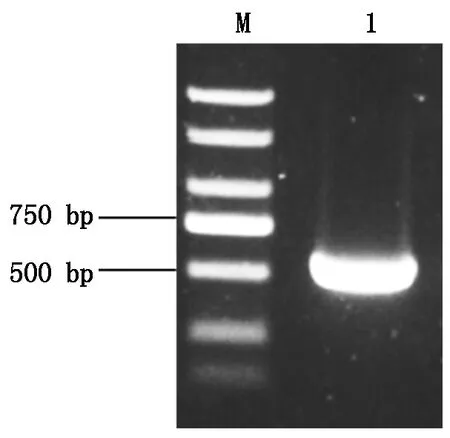
M.2 000 bp DNA Marker;1.ZmbZIP26。
采用ProtParam软件对蛋白质性质进行分析,结果表明,ZmbZIP26的相对分子质量为20.188 07 ku,分子式为C856H1 439N285O263S8,理论等电点为10.50;蛋白质的不稳定系数为71.82,属于不稳定蛋白;ProtScale分析发现,亲水性值(GRAVY值)为-0.443,属于亲水性蛋白;预测PHD跨膜螺旋区显示,该蛋白质无跨膜结构域;利用软件SOPMA进行预测,发现该蛋白质α螺旋占比73.51%,β转角占比0.54%,无规则卷曲占比20.54%,表明该蛋白质以α 螺旋结构为主(表1)。NetPhoS分析显示,该蛋白质含有14个丝氨酸和5个苏氨酸磷酸化位点,表明ZmbZIP26蛋白可能被丝氨酸和苏氨酸激酶激活,调控下游响应基因,从而参与植物的生长发育、信号传导及逆境胁迫过程等。

表1 ZmbZIP26蛋白性质分析
2.3 ZmbZIP26蛋白的系统进化以及保守序列分析
为了揭示ZmbZIP26的进化关系,利用软件MEGA构建了多物种同源蛋白的进化树,发现ZmbZIP26蛋白与高粱(Sorghumbicolor)和芒草(Miscanthuslutarioriparius)同源蛋白的关系比较紧密,且与水稻(Oryzasativa)同源蛋白的进化关系比较远(图4)。为进一步分析ZmbZIP26蛋白与其他物种同源蛋白的保守性,利用软件MEME鉴定6个保守基序,发现玉米不仅与高粱和芒草同源性较高,而且在同一氨基酸位置上的保守基序相同,与水稻的保守基序相差较大(图4),说明了不同物种间的同源性越高,保守基序相似度越高,其亲缘关系也就越近。

图4 ZmbZIP26蛋白与其他物种同源蛋白进化树及保守基序分析
2.4 ZmbZIP26基因启动子顺式作用元件分析
为分析ZmbZIP26基因的潜在功能,利用在线软件Plantcare对ZmbZIP26基因ATG上游2 000 bp的顺式作用元件进行了预测,结果显示,该转录因子基因除了启动子本身含有的最基本元件CAAT-box、TATA-box等,还含有ABRE、MBS、TGACG-motif、CGTCA-motif、TCA-element等多个结合位点(表2)。ABRE参与脱落酸信号传导途径,响应干旱胁迫;MBS是MYB结合位点,参与干旱诱发过程;TGACG-motif、CGTCA-motif参与茉莉酸信号传导途径;TCA-element是水杨酸响应元件,诱导水杨酸途径相关基因的表达。此外,还有大量的响应光刺激的元件Sp1、G-Box、Box 4、I-box等,因此,推测ZmbZIP26基因还可能调控植物开花、参与光合作用等。
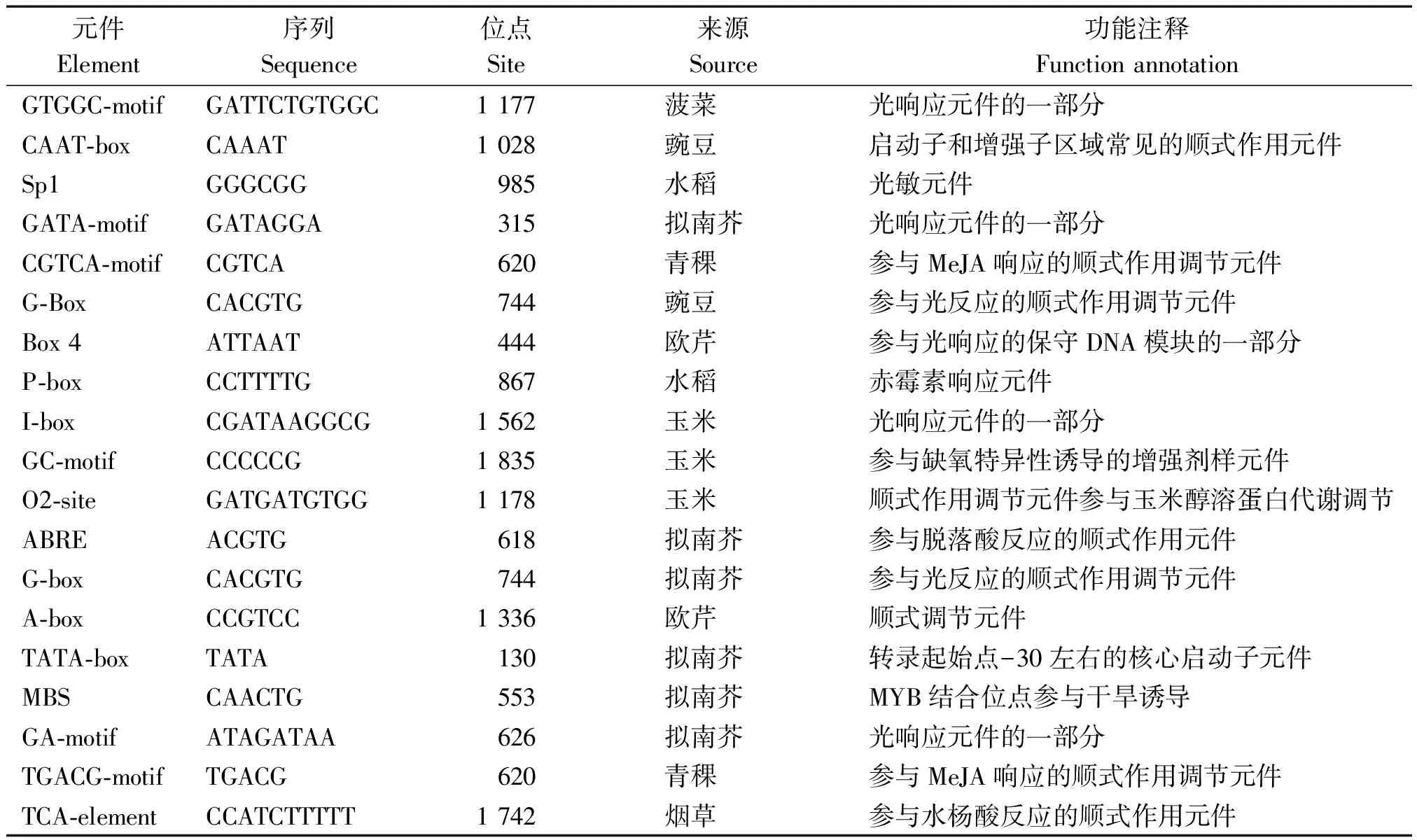
表2 ZmbZIP26基因启动子顺式作用元件分析
2.5 ZmbZIP26基因组织表达模式分析
为了解ZmbZIP26基因的表达模式,采用qRT-PCR技术对该基因在玉米组织中表达情况进行了分析,发现其在幼叶、幼茎、幼根、成熟叶、成熟茎、成熟根、雄穗、雌穗中均有表达,其中在幼茎、雌穗、幼根、成熟根中的表达量较高(图5)。ZmbZIP26是一个组成型表达基因,在不同组织、不同时期的表达水平存在差异,表明ZmbZIP26基因在玉米生长发育的过程中起着重要的作用。
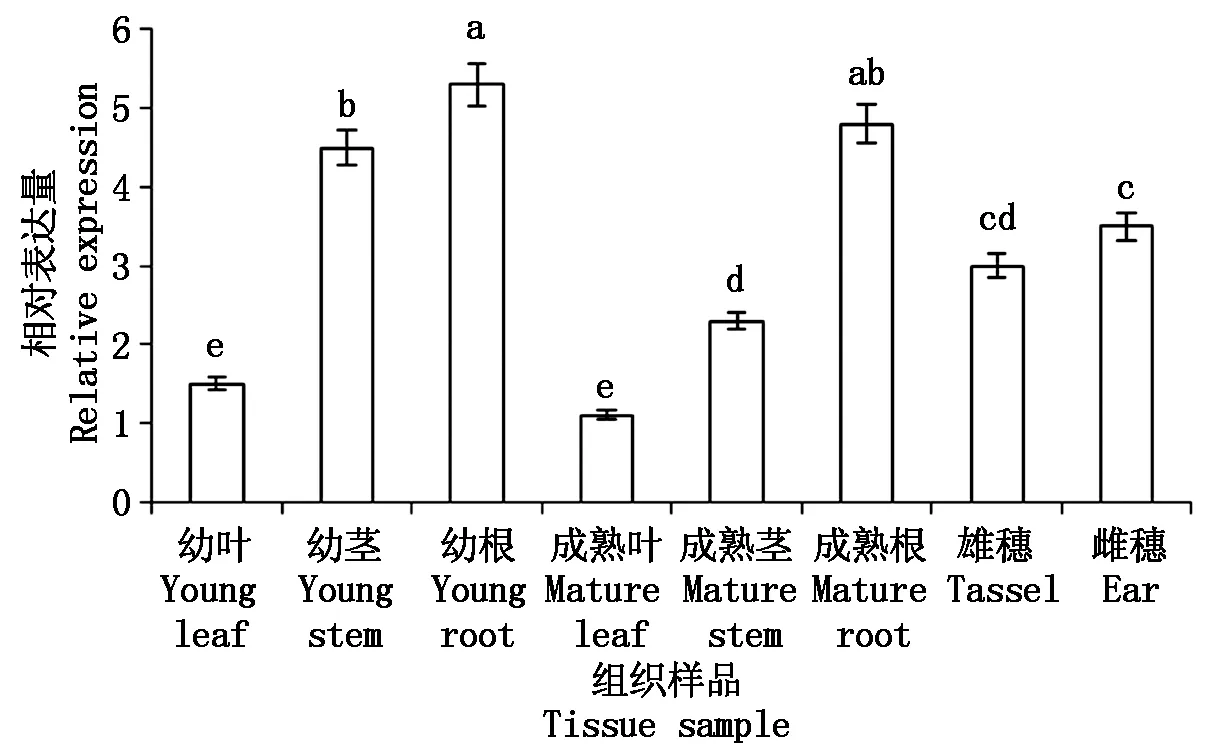
图5 ZmbZIP26基因在不同组织中的相对表达量
2.6 ZmbZIP26基因在干旱、高温、高盐、氮胁迫下的表达模式分析
通过对ZmbZIP26基因启动子顺式调控元件分析,发现其中含有多个胁迫响应元件,因此对干旱、高温、高盐、氮胁迫处理条件下ZmbZIP26基因在根系中的表达量进行分析,结果显示,干旱、高温、高盐、氮胁迫条件下,ZmbZIP26表达量显著上调,其中在高盐、氮胁迫下表达量上调15~20倍,干旱、高温胁迫下表达量上调5~10倍(图6)。在干旱胁迫24 h,表达量达到峰值,复水后表达量逐步下降;高温胁迫84 h,表达量达到峰值,解除胁迫24 h后表达量又显著降低;高盐胁迫48 h,其表达量达到最高,解除胁迫后表达量显著降低,但解除胁迫24 h后,表达量仍高于处理前,推测高盐胁迫严重伤害了玉米生长;氮处理36 h,其表达量达到最高,解除胁迫后表达量显著降低。以上结果表明,ZmbZIP26基因积极响应干旱、高温、高盐、氮胁迫等非生物胁迫,并且在恢复生长过程中也起着重要作用。
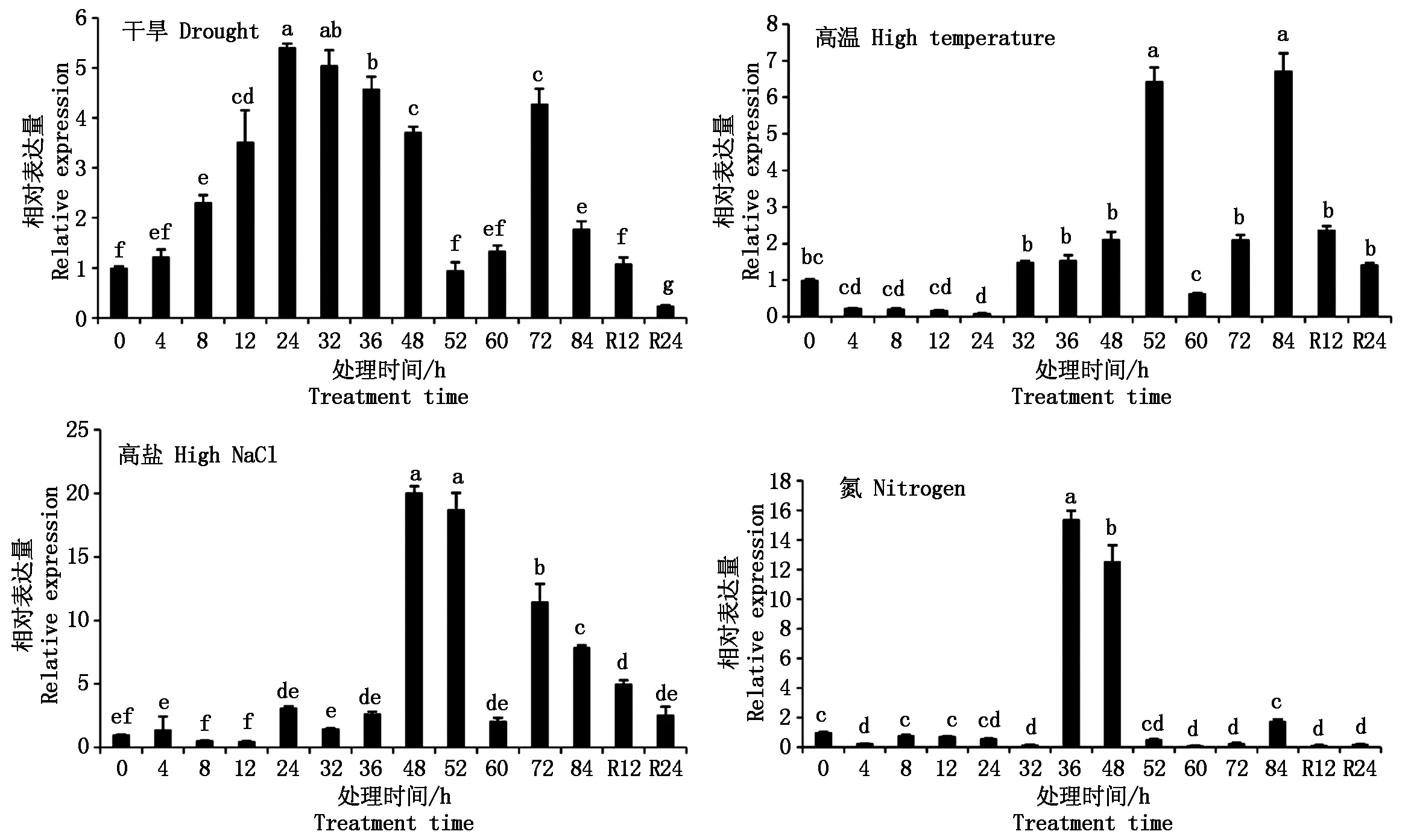
R.解除胁迫。R.Restoring.
2.7 ZmbZIP26蛋白的亚细胞定位分析
构建载体ZmbZIP26-pMDC83-GFP,利用农杆菌法瞬时转化生长较壮的烟草叶片,通过激光共聚焦显微镜观察发现,pMDC83-GFP处理在细胞膜和细胞核中都检测到了绿色荧光信号,但ZmbZIP26-pMDC83-GFP处理中,仅在细胞核中观察到了绿色荧光信号(图7),表明ZmbZIP26定位在细胞核上,属于核蛋白。

图7 ZmbZIP26蛋白的亚细胞定位
2.8 ZmbZIP26的互作蛋白网络预测
为探索ZmbZIP26基因可能的网络作用机制,采用STRING在线预测了ZmbZIP26的互作蛋白,结果显示,与ZmbZIP26互作的蛋白质主要有6个功能结构域(表3)。GRMZM2G159402编码的蛋白质包含锌指蛋白结构,是对基因调控起着十分重要作用的一类转录因子,主要参与细胞分化过程[19];GRMZM2G008109编码的蛋白质包含枯草杆菌蛋白酶sbt3.5结构,是一类丝氨酸蛋白酶,影响细胞壁的形成;GRMZM2G018943编码的蛋白质包含翻译起始因子eIF-2B亚基结构,eIF-2B是与细胞生存紧密相关的真核起始因子,是多亚基复合物,参与调节信号转导途径;GRMZM2G056612编码的蛋白质具有钙依赖性蛋白激酶(Calcium-dependent protein kinase,CDPK)活性,是植物钙信号系统中重要的蛋白激酶;GRMZM2G471517编码的是NPR1(Nonexpressor of pathogenesis-related genes 1)互作子,能激活细胞的免疫反应,保护植物的生长;gst21是谷胱甘肽转移酶,作为谷胱甘肽结合反应的关键酶,催化谷胱甘肽结合反应的起始步骤,在生物体的防御系统中发挥着非常重要的作用。推测ZmbZIP26蛋白与互作蛋白共同构建了一张调控网络,调控着植物的生长发育和逆境胁迫应答过程。

表3 ZmbZIP26的互作蛋白预测
3 结论与讨论
目前,在分析非生物胁迫下植物的代谢通路中,转录组测序技术已经被广泛应用[20],前人对茶树、棉花等植物响应非生物胁迫的调控机制进行了转录组测序分析,从分子层面解析了非生物胁迫下功能基因和调节基因的调控网络[21-22]。转录因子在植物非生物胁迫应答生理过程中起着重要的调节作用,近年来,在不同物种中bZIP基因家族的功能得到了广泛的研究,尤其是在拟南芥和水稻中[23-24],在玉米中也有170多个bZIP蛋白被鉴定[25],但迄今为止,只有少数玉米bZIP基因的功能被报道[26]。本研究通过对玉米幼苗在干旱-复水过程的根系和叶片进行转录组测序,筛选到一个响应干旱和复水处理的bZIP转录因子(ZmbZIP26),基因共表达网络分析发现,ZmbZIP26处于网络调节的核心节点位置。进化树和保守基序分析显示,玉米中该蛋白质与高粱和芒草的同源性较高,且在相同氨基酸位置具有相同的保守基序;对ZmbZIP26基因ATG上游2 000 bp启动子序列进行顺式调控元件分析,结果显示,启动子序列中包含着与植物的生长发育、光反应、逆境胁迫和信号转导等相关的结合位点,且参与玉米脱落酸、茉莉酸、水杨酸等多种激素的信号传导途径。
本研究发现,ZmbZIP26在玉米的多个组织部位均有表达,表明ZmbZIP26是组成型表达基因,该结果与ZmbZIP9、ZmbZIP17、ZmbZIP19等大部分ZmbZIP的研究结果是一致的[27],但ZmbZIP26在幼茎、雌穗和根中表达量较高,与其他ZmbZIP基因的表达模式存在着明显的差异,可见ZmbZIP基因的表达模式存在保守性和多样性。ZmbZIP26基因在干旱、高温、高盐、氮胁迫处理条件下根系中的表达量显著上调5~20倍,这与拟南芥和苹果中的表达趋势是一致的[28],解除胁迫后,ZmbZIP26基因表达量显著下降,说明ZmbZIP26基因有较强的抗逆性和恢复补偿能力。亚细胞定位分析发现,ZmbZIP26定位在细胞核上,这与大多数的ZmbZIP定位结果是一致的。转录因子进入细胞核大多数借助核定位信号,使靶基因表达,杨艳歌[29]证实玉米中ZmbZIP确实发挥着转录因子功能,但也有报道显示ZmbZIP60定位在内质网上[30],拟南芥中AtbZIP60也定位在内质网上,在内质网应激信号转导中发挥作用[31],说明同一家族的转录因子调控作用机制也会存在不同。
为进一步研究ZmbZIP26基因的互作网络机制,本研究对ZmbZIP26的互作蛋白进行预测,发现互作蛋白中包含锌指蛋白结构、枯草杆菌蛋白酶sbt3.5结构、翻译起始因子eIF-2B δ亚基、钙依赖性蛋白激酶、NPR1互作子、谷胱甘肽s-转移酶21等。锌指蛋白在植物生长发育和逆境应答中发挥重要作用,在烟草中CsZFP2基因能够积极响应干旱胁迫,过表达CsZFP2的转基因植株比野生型植株更具抗旱性[32];OsC3H10的过表达通过调控胁迫相关基因提高了水稻的抗旱性[33]。枯草杆菌蛋白酶sbt3.5结构在植物果胶甲基酯酶PME17的处理过程中起作用,在根系发育过程中高度共表达[34]。钙依赖性蛋白激酶是一类主要的钙信号受体,在植物的生长发育和非生物应激反应中发挥着重要作用[35]。低温胁迫下CDPK20基因在山药中具有调控功能,提高山药的耐低温能力[36];水稻基因OsCDPK7/13过表达后,转基因植株提高了对盐胁迫和干旱胁迫的耐受性[37]。NPR1在植物抗病信号转导过程中发挥着重要作用,甘蔗ShNPR1基因在烟草对青枯菌(Ralstoniasolanacearum)和茄病镰刀菌蓝色变种(Fusariumsolanivar.coeruleum)的防御反应中起积极作用[38]。因此推测,ZmbZIP26可能与锌指蛋白、丝氨酸蛋白、钙依赖性蛋白、谷胱甘肽转移蛋白等互作构建了一张调控网络,协同调节玉米生长发育和胁迫应答过程。
综上,从转录组数据中筛选到一个响应干旱和复水处理的bZIP转录因子ZmbZIP26,基因共表达网络分析发现,ZmbZIP26处于网络调节的核心节点位置;qRT-PCR分析发现,该基因属于组成型表达基因,在幼叶、幼茎、幼根、成熟叶、成熟茎、成熟根、雄穗、雌穗中均有表达,且在幼茎、雌穗和根中的表达量较高;通过非生物胁迫处理发现,ZmbZIP26基因积极响应干旱、高温、高盐、氮胁迫和恢复正常过程,可能在植物的抗逆过程中发挥着重要作用;亚细胞定位分析发现,ZmbZIP26属于核蛋白,定位在细胞核上;蛋白质互作预测发现,ZmbZIP26可能与锌指蛋白、丝氨酸蛋白、钙依赖性蛋白、谷胱甘肽转移蛋白等互作构建了一张调控网络,协同调控玉米的生长发育过程和胁迫应答过程。研究结果为揭示ZmbZIP26基因在玉米生长发育过程和非生物胁迫应答反应中的作用机制提供了参考,也为创制抗逆种质提供了分子资源。

