草莓空心病病原菌的生物学特性及其防治药剂筛选





摘要
草莓空心病是近年来草莓栽培过程中的一种新发的细菌性病害,其典型症状与草莓角斑病明显不同。本研究对不同地域来源的草莓种苗上分离的草莓空心病病原菌Xanthomonas fragariae 的16S rRNA、gyrB、rpoD、dnaK、fyuA等5个核心基因序列进行测定。多基因联合进化树分析结果表明,来自上海、山东、四川、浙江和河南的草莓空心病菌菌株与国内已报道的空心病菌菌株YL19聚成一簇,国外报道的草莓角斑病菌菌株聚为另外一簇,表明国内空心病病原菌种类基本一致,但是和国外报道的草莓角斑病菌菌株在进化水平上存在明显差异。选取其代表性菌株SHQP01,开展了草莓空心病病原菌的生物学特性测定及防治药剂筛选。生理生化指标检测表明,该病原菌能利用D-海藻糖、蔗糖、α-D-葡糖等碳源。病原菌的最适生长温度为28℃,致死温度为47℃。药剂毒力测定结果表明,测试的13种试剂中,中生菌素、溴菌腈、络氨铜、申嗪霉素、碱式硫酸铜、氯溴异氰尿酸、王铜、噻唑锌、春雷霉素、噻森铜对病原菌有一定的抑菌效果,而噻菌铜、氢氧化铜和井冈霉素A对该菌没有抑制作用。其中,中生菌素、溴菌腈、络氨铜的抑菌效果较好,EC50值分别为137.465 2、210.961 0 μg/mL和585.350 3 μg/mL。选取抑菌活性最强的前5个药剂进行草莓苗期药效评价,研究结果表明,中生菌素对草莓空心病的防治效果最高,达到80.78%;碱式硫酸铜和络氨铜次之,分别为74.71%和62.27%,但是碱式硫酸铜存在药害风险;申嗪霉素和溴菌腈防效较差,仅有18.52%和3.08%。本研究结果明确了草莓空心病病原菌的生物学特性,为今后该病害的防治化学药剂登记推荐和科学防控提供了重要的理论数据。
关键词
草莓空心病;" Xanthomonas fragariae;" 生物学特性;" 药剂筛选
中图分类号:
S 436.684
文献标识码:" A
DOI:" 10.16688/j.zwbh.2024087
收稿日期:" 20240219""" 修订日期:" 20240415
基金项目:
上海市科技兴农重点攻关项目(2022-02-08-00-12-F01157);上海设施园艺技术重点实验室开放基金(2022KF01)
致" 谢:" 参加本试验部分工作的还有江代礼、谭翰杰、张能和纪烨斌等同学,特此一并致谢。
* 通信作者
E-mail:
fumingdai@163.com
#
为并列第一作者
Biological characteristics of Xanthomonas fragariae causing strawberry crown infection cavity and bactericides-screening for its control
JI Wenjie1," SONG Zhiwei2," LI Cheng3," ZENG Rong2," XU Jinjin3," GAO Ping2," XU Lihui2,
GAO Shigang2," ZHU Jiming3," DAI Fuming2*
(1. College of Fisheries and Life Sciences, Shanghai Ocean University, Shanghai" 201306, China;
2. Eco-Environmental Protection Research Institute, Shanghai Academy of Agricultural Sciences,
Shanghai Key Laboratory of Horticultural Technology, Shanghai" 201403, China; 3. Shanghai
Qingpu District Agricultural Technology Extension Service Center, Shanghai" 201799, China)
Abstract
Strawberry crown infection cavity(CIC)disease is a newly emerged bacterial disease caused by Xanthomonas fragariae, with typical symptoms distinct from those of strawberry angular leaf spot (ALS) disease. In this study, five core genes (16S rRNA, gyrB, rpoD, dnaK, and fyuA) of CIC strains isolated from Shanghai, Shandong, Sichuan, Zhejiang, and Henan were sequenced . Phylogenetic analysis showed that these five strains clustered with YL19 strain from China, while all ALS strains of X.fragariae from other countries formed a separate cluster. This results suggest that strains across different regions in China are genetically uniform but show significant evolutionary differences from foreign ALS strains. To develop a control method, we evaluated biological characteristics of the pathogen SHQP01 and inhibitory effects of thirteen bactericides using the inhibition zone method. The pathogen was found to utilize carbon source such as D-trehalose, sucrose and α-D-glucose. Additionally, the optimal growth temperature for the pathogen is 28℃, with a lethal temperature of 47℃. Among the thirteen tested bactericides, ten exhibited good inhibitory effects in vitro, including zhongshengmycin, bromothalonil, cuaminosulfate, shenqinmycin, basic copper sulfate, chloroisobromine cyanuric acid, copper oxychloride, zinc thiazole, kasugamycin and saisen copper. In contrast, thiodiazole-copper, copper hydroxide, and jingangmycin A exhibited no inhibitory activity. Among them, zhongshengmycin, bromothalonil, and copper oxychloride showed better antibacterial effects, with EC50 values of 137.465 2, 210.961 0 μg/mL, and 585.350 3 μg/mL, respectively. Greenhouse trials using the five most effective bactericides identified zhongshengmycin as the most potent, with an 80.78% of control efficacy, followed by basic copper sulfate (74.71%) and cuaminosulfate (62.27%). All tested bactericides were safe for strawberry plants at the tested concentrations, except for basic copper sulfate, which showed slight phytotoxicity. Shenqinmycin and bromothalonil exhibited poor control efficacy, achieving only 18.52% and 3.08%, respectively. These findings provide basic data for recommending bactericides for official registration and scientific control strategies for strawberry CIC disease.
Key words
strawberry crown infection cavity;" Xanthomonas fragariae;" biological characteristic;" bactericide screening
草莓Fragaria×ananassa,属蔷薇科Rosaceae草莓属Fragaria,为全球广为栽培的浆果类水果。截至2019年,我国草莓栽培面积12.613万hm2,产量32.219万 t[1],是全球最大的草莓生产与消费国。随着草莓栽培面积的扩大和种苗的频繁调运,草莓上的病害日趋多样化和严重化,影响着我国草莓的产量与质量,制约着我国草莓产业的健康发展。近几年在我国辽宁[2]、上海[3]等地的草莓种植区出现了一种新的病害,该病害在种植初期不显症,在草莓现蕾后出现症状,主要表现为新叶发黄、植株生长缓慢、短缩茎中空
一掰即断甚至植株死亡,同时也会伴有沿叶脉两侧的水渍状条斑、菌脓和零星水渍状病斑;严重时病株率可达80%以上乃至毁棚,损失巨大。由于该病害田间普遍出现的典型短缩茎中空现象,生产上把此病称之为“草莓空心病”,目前该病在国内仍处于扩散的趋势。
草莓空心病病原菌鉴定为草莓黄单胞菌Xanthomonas fragariae,属于变形菌门Proteobacteria、黄单胞菌科Xanthomonadaceae、黄单胞杆菌属Xanthomonas[23]。据报道,草莓黄单胞菌是检疫性病害草莓角斑病的病原[45],可造成叶片下表面出现水浸状红褐色不规则形病斑,病斑扩大时受细小叶脉所限,呈角形叶斑,故亦称角斑病[67],罕见短缩茎中空的危害症状,其典型症状与草莓空心病引起的空心症状存在明显差异。近年来,我国多省份大面积发生草莓空心病,但国内外还未见有关该病害防控方面的报道,亟须防控技术的研究。本文开展了草莓空心病病原菌生物学特性和药剂筛选的研究,旨在为该病害后续防治药剂登记和科学治理提供理论依据。
1" 材料与方法
1.1" 供试材料
1.1.1" 供试菌株和植物
草莓空心病菌菌株:SHQP01,2021年分离自上海青浦[3];MH16,2021年分离自山东烟台;ZJ002,2022年分离自浙江建德;SC001,2022年分离自四川德阳;HN52,2022年分离自河南商丘,所有菌株均在-80℃、25%甘油条件下保存于本实验室。其中, SHQP01已完成全基因组测序并递交数据库,GenBank登录号为GCA_022117535.1。
供试植株:‘章姬’草莓穴盘苗,购于上海孙桥现代温室种子种苗有限公司。
1.1.2" 供试培养基
营养肉汤(nutrient broth,NB)培养基:多聚蛋白胨(polypeptone)5 g/L、蔗糖(sucrose)10 g/L、酵母提取物(yeast extract)1 g/L、牛肉浸膏(beef extract) 3 g/L,调pH至7.0,分装30 mL至带瓶盖的培养瓶中,121℃高压灭菌20 min。
营养琼脂(nutrient agar,NA)培养基:NB培养基中添加琼脂粉15 g/L。
1.1.3" 供试杀菌剂
20%噻菌铜悬浮剂(SC),浙江龙湾化工有限公司;15%络氨铜水剂(AS),绿亨科技集团股份有限公司;30%噻唑锌悬浮剂(SC),巴斯夫(中国)有限公司;46%氢氧化铜水分散粒剂(WG),科迪华农业科技有限责任公司;50%申嗪霉素可湿性粉剂(WP),北美农大集团;20%噻森铜悬浮剂(SC),浙江东风化工有限公司;27.12%碱式硫酸铜悬浮剂(SC),澳大利亚纽发姆有限公司;50%氯溴异氰尿酸可溶性粉剂(SP),南京南农农药科技发展有限公司;25%溴菌腈乳油(EC),江苏托球农化股份有限公司;3%中生菌素可湿性粉剂(WP),深圳诺普信农化股份有限公司;30%王铜悬浮剂(SC),江西禾益化工股份有限公司;70%春雷霉素原药(TC),石原(上海)化学品有限公司;15%井冈霉素A可溶性粉剂(SP),浙江省桐庐汇丰生物科技有限公司。
1.2" 田间症状观察
2019至2023年,每年系统调查上海市草莓种植基地空心病的发生情况,观察该病害的田间症状及其危害程度。
1.3" 病原菌多基因联合系统发育分析
1.3.1" 病原菌多基因序列扩增与测序
使用Tiangen细菌基因组 DNA 提取试剂盒(DP302) 提取草莓空心病菌菌株MH16、ZJ002、SC001和HN52的DNA,而后分别进行16S核糖体核糖核酸(16S rRNA)、促旋酶亚基基因(gyrB)、RNA聚合酶σ亚基基因(rpoD)、热休克蛋白基因(dnaK)、强毒力岛(high pathogenicity island)核心基因(fyuA)的序列扩增和测定。
16S rRNA[8]与gyrB等4个基因[9]的扩增引物序列及片段大小见表1。PCR反应体系(25 μL): 2×EasyTaq PCR SuperMix(北京全式金生物技术有限公司)12.5 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 1 μL,ddH2O 9.5 μL。16S rRNA扩增程序:95℃预变性3 min;95℃变性25 s,56℃退火25 s,72℃延伸1 min,30个循环;72℃延伸5 min;其余基因扩增程序:94℃预变性3 min;94℃变性30 s,54℃退火30 s,72℃延伸1 min,30个循环;72℃延伸10 min。引物合成、扩增产物测序由生工生物工程(上海)股份有限公司完成。
1.3.2" 病原菌多基因联合进化树分析
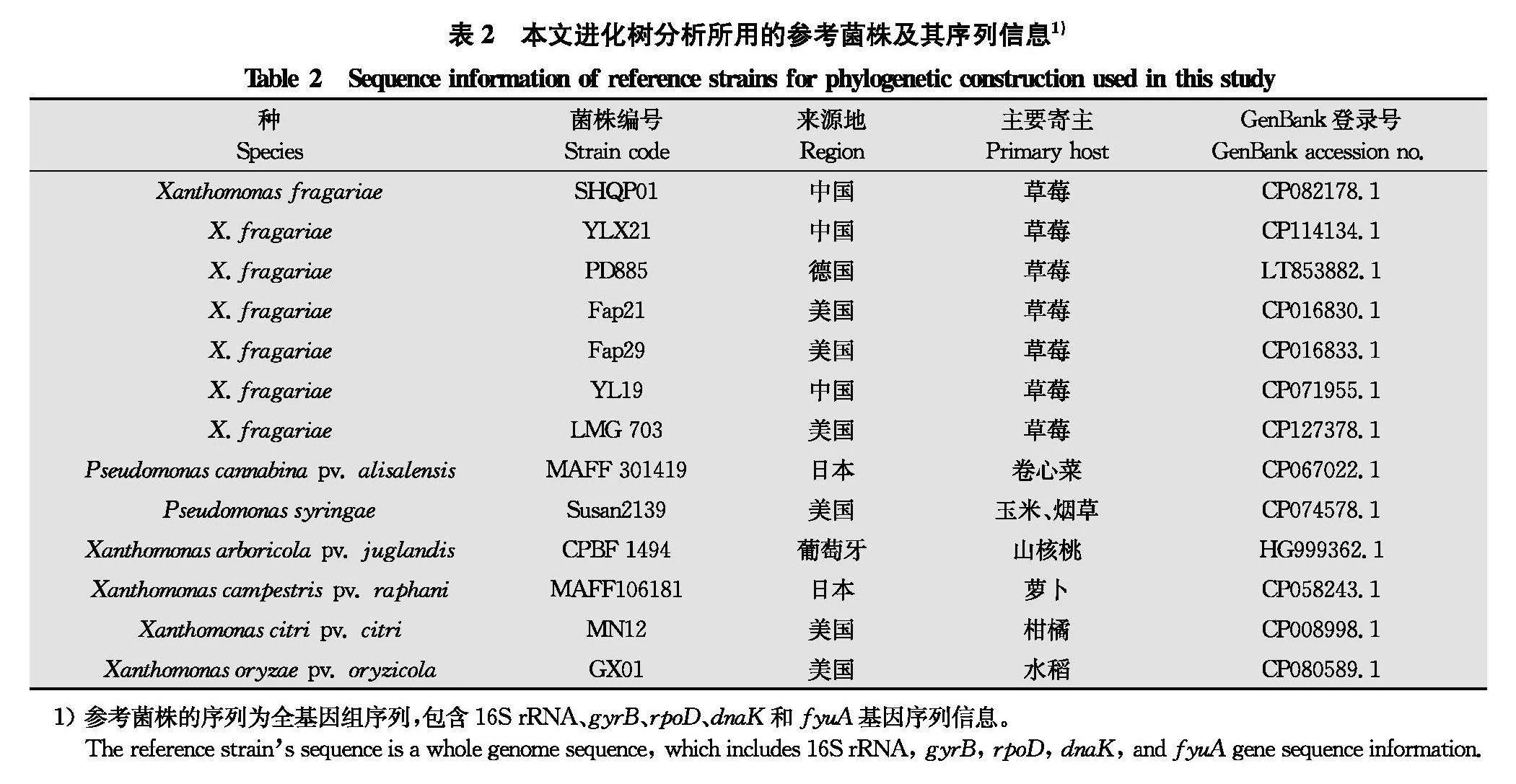
以Pseudomonas属和Xanthomonas属部分其他种的菌株作为外群,相关参考菌株信息见表2,将测序获得的序列与参考菌株的序列进行BLAST比对分析,并下载整理相似性高的作为参考序列,将测序结果与参考序列使用MUSCLE进行比对[10],手动修剪截齐两端。将序列按16S rRNA-gyrB-rpoD-dnaK-fyuA顺序串联成多基因联合序列,基于邻接法(neighbor-joining),自展值(bootstrap value)设置为1 000,用MEGA 11构建系统发育树[11]。
1.4" 草莓空心病病原菌SHQP01的生物学特性测定
1.4.1" 碳源利用测定
参照BIOLOG Gen III MicroPlate鉴定板使用手册,设置4组重复。使用一次性无菌采样拭子轻轻蘸取草莓空心病菌菌落,将其接种至Biolog IF-A培养液中并混匀,直至浊度仪检测透射率达到约90%。将制备好的菌悬液倒入V形贮液槽,用八道移
液器吸取100 μL菌悬液,接种至BIOLOG Gen III鉴定板中,封口后平放于28℃恒温培养箱中培养。
分别于24、48、72 h和96 h后,使用Infinite 200 PRO多功能酶标仪(TECAN)测定吸光度,测定波长为590 nm(颜色+浊度)和750 nm(浊度)。通过590 nm吸光度减去750 nm吸光度的差值表示微生物代谢活性,并综合比对鉴定板中阴性和阳性对照的数值判断碳源代谢情况[1213]。
1.4.2" 最适生长温度测定
通过比浊法[14]测定病原菌不同温度下的生长曲线。向30 mL NB培养基内加入300 μL 109 cfu/mL (OD600=1.0)的菌液,将培养瓶置于恒温振荡器内黑暗条件下培养,温度分别设定为20、24、28、32℃,转速设定为200 r/min,初接种时测定1次OD600,后每间隔12 h测定1次OD600,以未接种的NB液体培养基作为空白对照;每个温度做4个重复试验;根据不同时刻测定的平均OD600绘制生长曲线。
1.4.3" 致死温度的测定
参考蒙姣荣等[15]的方法。将109 cfu/mL的草莓空心病病原菌菌液在45、50、55、60℃分别处理10 min,吸取50 μL于NA板中,涂布均匀;28℃、黑暗状态下培养,观察菌落是否生长,筛选出菌体致死的最小温度区间;根据测得的病菌致死温度区间,以1℃为梯度再次设置温度处理重复试验,确定菌株最低致死温度,每处理3个重复。
1.5" 药剂毒力测定
在直径90 mm NA培养基上接种100 μL 109 cfu/mL的菌液,涂布均匀后晾干备用。参考谭才邓等[16]的方法,用已灭菌直径为6 mm的打孔器,在上述备用培养基中心打孔,小心挑去培养基小块以做成圆孔。按照药剂说明书及预试验结果,将每种药剂稀释成5个浓度梯度,将配制好的药液滴10 μL于孔中,以无菌水为阴性对照,每组药剂3个重复。28℃、黑暗培养24 h后,十字交叉法测量抑菌圈直径,计算相对抑菌率。相对抑菌率=(处理抑菌圈直径-对照抑菌圈直径)/处理抑菌圈直径×100%。以药剂有效成分浓度对数为自变量(x),相对抑菌率的几率值为因变量(y),建立毒力回归方程,计算抑制中浓度(EC50)。
1.6" 苗期药效评价
选择5种对病原菌室内毒力较强的药剂:溴菌腈、中生菌素、申嗪霉素、络氨铜、碱式硫酸铜在温室进行活体防效评价[17]。按照药剂在登记作物上的推荐剂量设置试验浓度(有效成分浓度):25%溴菌腈EC 250 μg/mL (1 000倍液)、3%中生菌素WP 75 μg/mL (400倍液)、50%申嗪霉素WP 2 500 μg/mL (200倍液)、15%络氨铜AS 750 μg/mL (200倍液)、27.12%碱式硫酸铜SC 678 μg/mL (400倍液) 5个药剂处理和1个清水对照,共6种处理,4个重复,每重复25株。将药剂均匀地喷洒在整个植株上,以确保药剂能够覆盖植株的各个部位,包括叶片背面,首次施药时草莓植株苗龄55 d(约6~7张叶片),间隔7 d再施药1次,共2次。用水量4 mL/株。喷雾施药时进行物理隔离,待叶片表面水分晾干后放置回苗床,处理间间隔30 cm左右。
将草莓空心病病原菌在28℃、黑暗、200 r/min条件下培养到109 cfu/mL浓度后接种。每次施药后24 h分别进行1次病菌的人工接种,用喷雾器将菌液均匀喷施到草莓叶片的正反面并保持环境湿度在60%~95%,观察病害发展情况。
末次施药后14 d进行病情调查,每个重复调查所有植株叶片的发病严重度,统计病情指数并计算防治效果。叶片严重度分级标准参考Hildebrand等[17]的方法,略作改动。
0级:无病斑;1级:病斑面积占整个叶面积的1%以下,叶片背面对光观察有轻微水渍状斑点;3级:病斑面积占整个叶面积1%~10%,叶片背面有较明显的水渍状斑点;5级:病斑面积占整个叶面积11%~30%,且叶片水渍状斑点加深变褐色,病斑有轻微菌脓; 7级:病斑面积占整个叶面积30%以上,或病斑变褐色,沿叶脉有菌脓溢出;9级:沿叶脉有菌脓溢出,叶片枯萎,死亡。
病情指数=∑(各病级株数×相应级值)调查总植株数×最高病级值×100;
防治效果=
(对照区病情指数-药剂处理区病情指数)/对照区病情指数×100%。
1.7" 数据统计与分析
试验数据均使用Microsoft Excel软件进行统计,使用GraphPad Prism 8.0进行分析,计算平均值及标准误,并对数据进行方差分析(ANOVA),再进一步使用Duncan氏新复极差法对具有统计学差异的组进行多重比较,显著水平设置为0.05。
2" 结果与分析
2.1" 田间症状
2019年-2023年连续5年对草莓空心病田间危害情况进行观察,该病害主要危害草莓短缩茎,引起短缩茎中空、脆弱易断等症状(图1a),同时也会伴有沿叶脉两侧的水渍状条斑、菌脓和零星水渍状病斑(图1b~d)。严重时发病率可达80%,整株死亡,产量剧减。
2.2" 病原菌系统发育分析
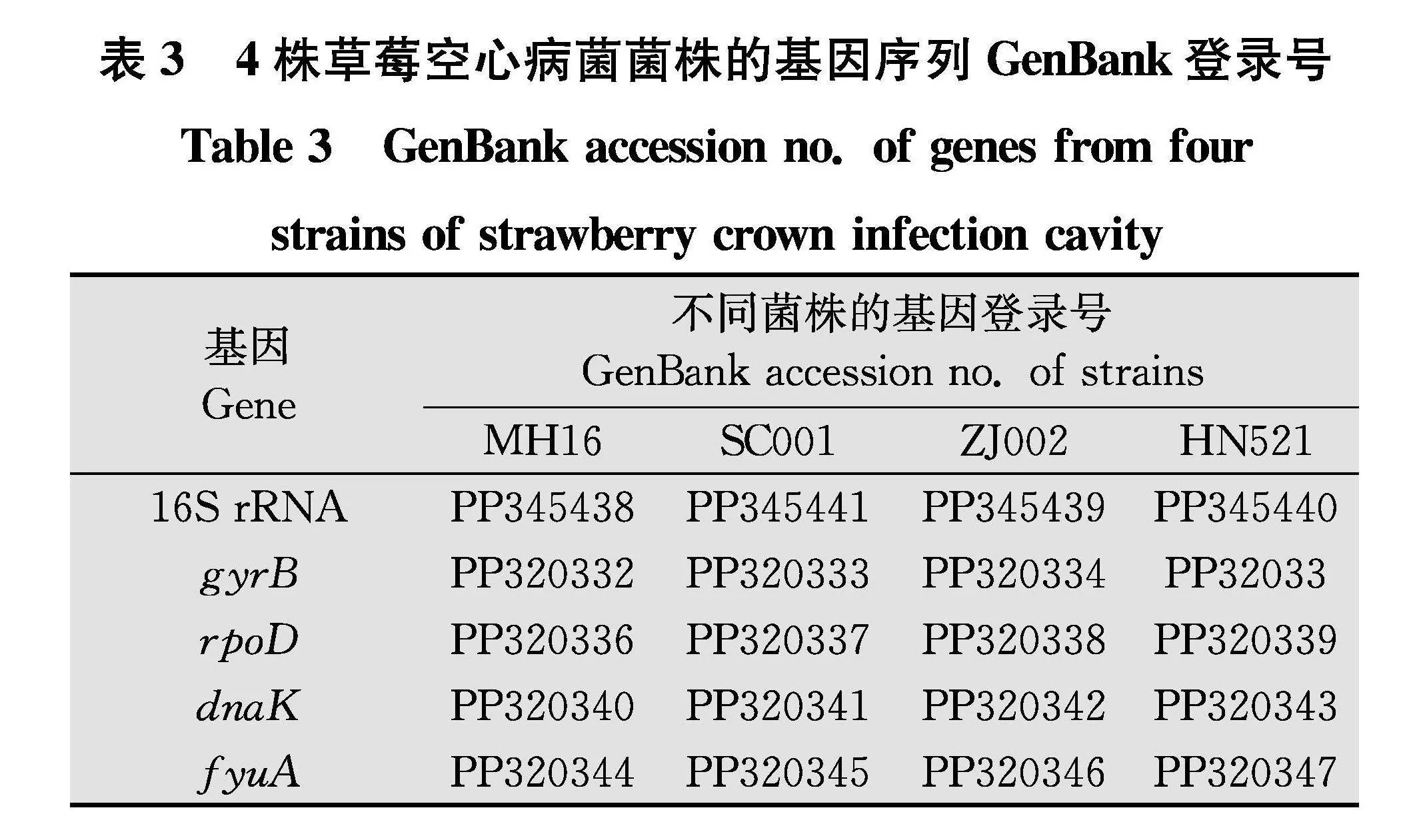
扩增菌株MH16、SC001、ZJ002和HN52的16S rRNA、gyrB、rpoD、dnaK和fyuA基因序列,分别上传至GenBank数据库,登录号信息见表3。
基于16S rRNA、gyrB、rpoD、dnaK、fyuA 5个基因的联合序列,经NJ法构建草莓空心病菌的多基因系统进化树(图2)。在该进化树中,本实验室分离的草莓空心病菌株SHQP01、MH16、SC001、ZJ002、HN52和国内报道的草莓空心病菌株YL19聚为一簇,自展值为96,无鞭毛的特殊菌株YLX21单独成支,而草莓角斑病菌株Fap21、Fap29、LMG703和PD885(标准菌株)单独聚在另一簇,自展值为95,草莓空心病与草莓角斑病的病原都是X.fragariae,但是二者在进化水平上存在明显差异。
2.3" 草莓空心病病原菌的生物学特性
碳源利用测定结果表明:该病原菌能利用D-海藻糖、蔗糖、α-D-葡糖等7种碳源(表4)。
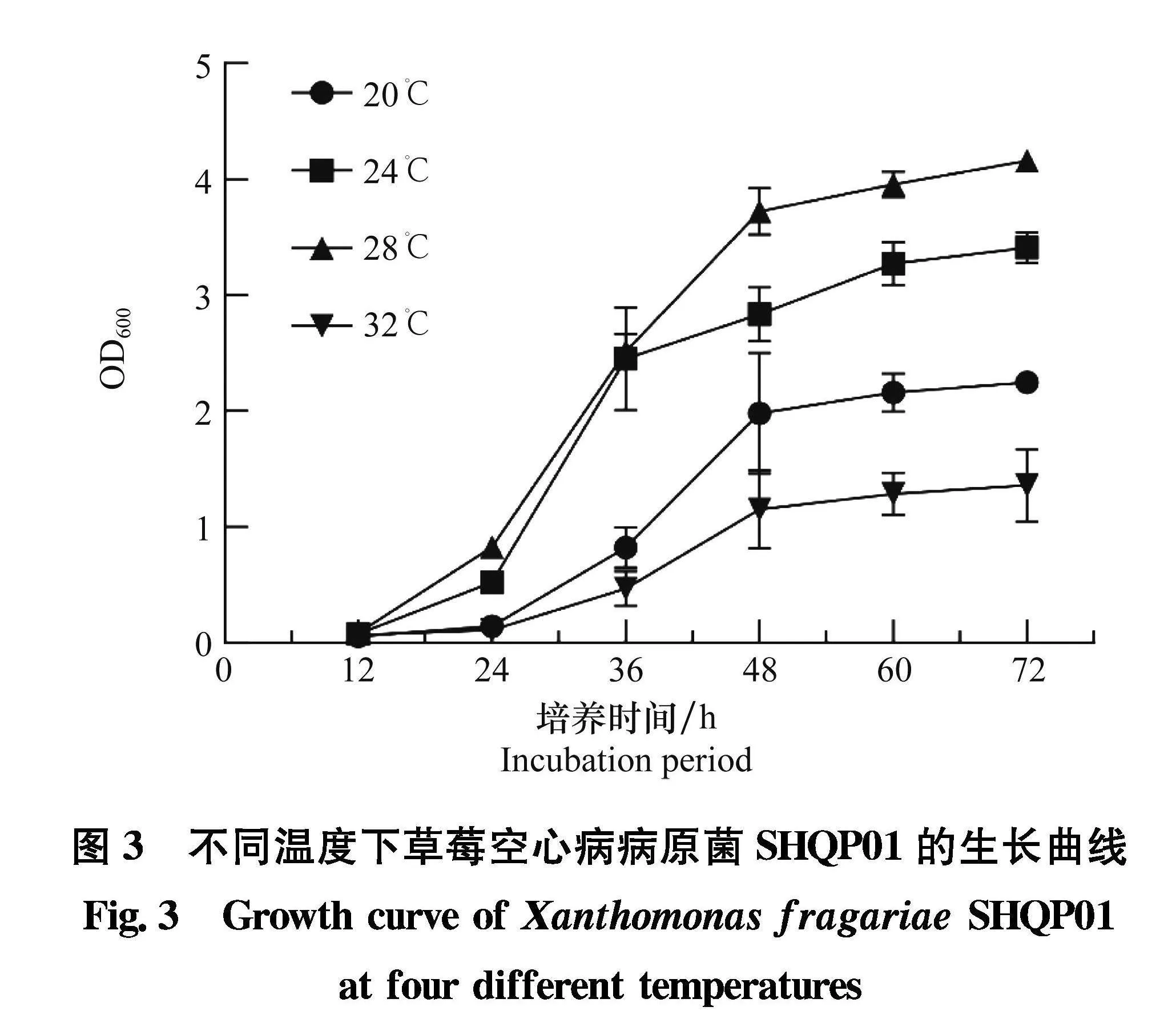
病菌生长温度试验结果(图3)表明,草莓空心病菌SHQP01在20~32℃均能生长,其最适生长温度为28℃;不同温度下热处理病菌,病菌在46℃及以下温度仍能生长,47℃及以上温度热处理10 min不生长。
2.4" 药剂对病原菌的离体活性
通过平板法测定了13种药剂对草莓空心病菌SHQP01的抑菌效果(表5)。结果显示,除46%氢氧化铜WG、20%噻菌铜SC和15%井冈霉素A SP外,其余药剂均表现出不同程度的抑菌活性。其中,3%
at four different temperatures
中生菌素WP和25%溴菌腈EC的抑菌效果最显著,EC50分别为137.465 2 μg/mL和210.961 0 μg/mL;
其次为 15%络氨铜 AS、 50%申嗪霉素 WP和27.12%碱式硫酸铜 SC,EC50分别为585.350 3、694.475 6 μg/mL和736.516 0 μg/mL,抑菌效果较好。相比之下,50%氯溴异氰尿酸SP、30%王铜 SC、30%噻唑锌SC、70%春雷霉素TC、和20%噻森铜SC的抑菌效果较差,EC50分别为831.300 6、931.520 8、1 184.530 3、1 468.817 9 μg/mL和1 964.042 9 μg/mL。综合比较,抑菌效果排名前五的药剂依次为3%中生菌素WP、25%溴菌腈EC、15%络氨铜AS、50%申嗪霉素WP和27.12%碱式硫酸铜SC。
2.5" 药剂的苗期防效
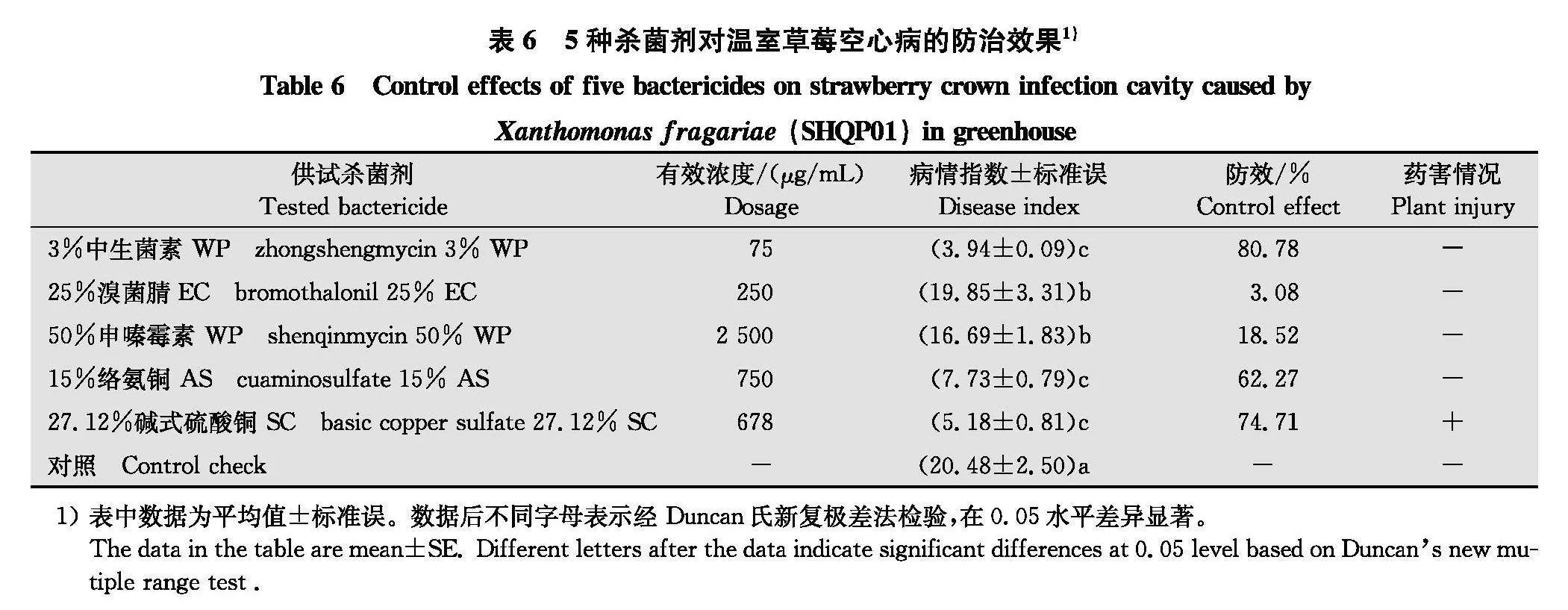
5种药剂草莓苗期防治试验结果(表6)表明:3%中生菌素WP对草莓空心病的防治效果最高,达80.78%;27.12%碱式硫酸铜SC和15%络氨铜AS对草莓空心病的防治效果次之,分别达到74.71%和62.27%,经统计分析,这3种药剂防效之间差异不显著。50%申嗪霉素WP和25%溴菌腈EC防治效果较差,仅为18.52%和3.08%,显著低于3%中生菌素WP、27.12%碱式硫酸铜SC和15%络氨铜AS的防治效果。经观察,3%中生菌素WP、15%络氨铜AS、50%申嗪霉素WP和25%溴菌腈EC对草莓植株生长没有任何不良影响,但碱式硫酸铜喷药后3~6 d叶片出现局部褐变、叶缘黄化焦枯等药害症状。
3" 结论与讨论
近年来,在上海及国内其他地区草莓上发生的空心病与国外报道的草莓角斑病田间危害症状有明显区别,草莓短缩茎内部中空、新叶黄化、沿叶脉水渍状并伴有菌脓、植株矮化、易折断是该病的典型症状,叶片上偶尔产生的水渍状角斑是次要症状,而叶片上水渍状角斑是草莓角斑病的典型症状,罕见草莓短缩茎内部中空等症状[5]。
多基因序列联合建树鉴定病原菌的方法已经广泛应用于植物病害的研究[1819],本研究经NJ法构建草莓空心病菌的多基因系统进化树,结果显示,来自我国不同地域的草莓空心病菌菌株聚成一簇,而国外报道的草莓角斑病菌株另成一簇,表明在我国侵染草莓导致短缩茎空心的病原菌种类基本一致,虽然与报道的草莓角斑病菌株属于同种,但存在明显差异。Wei等[20]对草莓空心病菌菌株与角斑病菌菌株进行了生物信息学分析,表明两者在基因组水平上存在差异,将侵染草莓导致短缩茎空心的病原菌X.fragariae中国菌株定为草莓黄单胞菌的一个新亚种。由于草莓空心病近几年在我国暴发和蔓延,针对该病害的防控研究非常紧迫,本研究显示我国不同地区引起草莓空心病的菌株具有高度的一致性,靶向空心病菌菌株SHQP01的药剂筛选与药效评价结果可为国内不同地区草莓空心病的防控提供参考。
草莓空心病有两个发病时期,分别是露地繁苗期(5月-7月)和大棚栽培期(10月-11月),本研究发现,草莓空心病菌的最适生长温度为28℃,与草莓露地繁苗及大棚栽培期间的环境温度基本相吻合。Turechek等[21]的研究表明,56℃和52℃下分别处理15 min和60 min,可完全杀死草莓角斑病菌,但这个温度对植物有损伤,44℃下处理4 h或者48℃下处理2 h就可大幅减少病原菌数量,且这个处理条件对种苗生长影响较小。本研究表明,47℃下处理10 min能够完全杀死草莓空心病病原菌,故生产上也可以考虑通过高温处理措施预防该病害的发生,比如通过热处理的措施进行草莓种苗消毒杀菌,还可对夏季大棚高温闷棚进行土壤消毒,以减少土壤中病原菌菌量。
据报道,草莓空心病自然发生时除了会出现典型的短缩茎中空症状外,通常还会出现叶部水渍状角斑、叶脉两侧水渍状条斑等症状[23],且叶部感染是草莓空心病病原菌传播的重要途径,叶部防治是控制草莓空心病病情蔓延的手段之一;Wang等[22]分别采用短缩茎伤口接种、伤根接种等方法接种空心病菌,人工接种条件下60 d至90 d才出现空心症状,形成空心症状时间较长,本研究采用叶部喷雾接种法接种后4~5 d叶片即可出现水渍状斑点症状,可大大缩短试验周期,提升药剂评估效率。综上所述,防治草莓空心病的药剂评估选用调查叶部病情的方法合理快速且具可操作性。
作者前期在草莓苗期采用先接菌后施药的方案,对文中5种抑菌活性最好的药剂进行治疗效果试验,结果显示,5种药剂处理病情指数与对照无显著差异,表明这些药剂防治空心病的治疗效果较差,建议生产上对草莓空心病的防治应采取预防为主的策略。本文采用了先施药后接菌的方法对不同药剂防治效果进行评价。试验表明:3%中生菌素WP的防治效果优良,15%络氨铜AS与27.12%碱式硫酸铜SC的防效次之,25%溴菌腈EC和50%申嗪霉素 WP效果差,但施用27.12%碱式硫酸铜SC对草莓植株产生了药害,综合评价3%中生菌素WP和15%络氨铜AS可以作为将来草莓空心病防治推荐登记的候选药剂种类。25%溴菌腈EC和50%申嗪霉素WP虽然在室内毒力测定中表现出较好的抑菌效果,但在温室中防治效果较低,可能与草莓叶片表面的蜡质层和毛状体影响药剂吸附及渗透效果有关[23]。此外,温室条件下药剂需通过叶面渗透或传导作用到达靶标,而非直接作用于病原菌,这可能限制了药效。试验设计中施药24 h后接种病原菌的设置也可能影响防治效果。温室环境中显著的温湿度波动及强烈的紫外线照射,可能降低药剂的稳定性和持续作用。一些药剂在强光或高温条件下易降解,导致有效成分含量下降,从而削弱防效[24],这一因素需要在后续研究中进一步关注。
对空心病的药剂防治尚未见报道,已有的报道多是针对草莓角斑病。杨万风等[25]报道72%农用链霉素SP对草莓角斑病菌具有较好的杀菌活性,但该药剂在我国已禁止用于农业上病害的防治[26];Kim等[27]报道噁喹酸和井冈霉素A对草莓角斑病的防效可分别达到87%和95%,目前国内还没有关于噁喹酸作为农药的登记信息,因此本研究未将农用链霉素和噁喹酸纳入药剂筛选范围,此外通过打孔法测定了井冈霉素A对草莓空心病菌的抑菌活性,结果显示其对草莓空心病菌无抑制效果,表明井冈霉素A对草莓空心病菌和草莓角斑病菌抑制效果有差异。空心病病菌和角斑病病菌对井冈霉素A的敏感性不同,可能与这两种病原菌差异性有关[28]。关于两者之间的差异,是一个值得探究的方向,未来还需要作进一步的研究。
参考文献
[1]" 王鸣谦, 薛莉, 赵珺, 等. 世界草莓生产及贸易现状[J]. 中国果树, 2021(2):104108.
[2]" FENG Jiayue, LI Yulian, WANG Danjuan, et al. First report of Xanthomonas fragariae strain YL19 causing crown infection pockets in strawberry in Liaoning province, China [J]. Plant Disease, 2021,105(8): 2237.
[3]" SONG Zhiwei, YANG Chen, ZENG Rong, et al. First report of strawberry crown rot caused by Xanthomonas fragariae in China [J]. Plant Disease, 2021, 105(9): 2711.
[4]" 中华人民共和国农业部. 中华人民共和国农业部公告第862号: 中华人民共和国进境植物检疫性有害生物名录[EB/OL].(20070628) [20240415]. http:∥www.moa.gov.cn/nybgb/2007/dliuq/201806/t20180613_6151927.htm.
[5]" KENNEDY B W, KING T H. Angular leaf spot of strawberry caused by Xanthomonas fragariae sp. nov. [J]. Phytopathology, 1962, 52: 873875.
[6]" BESTFLEISCH M, RICHTER K, WENSING A, et al. Resistance and systemic dispersal of Xanthomonas fragariae in strawberry germplasm (Fragaria L.) [J]. Plant Pathology, 2015, 64(1): 7180.
[7]" ZIMMERMANN C, HINRICHS-BERGER J, MOLTMANN E, et al. Nested PCR (polymerase chain reaction) for detection of Xanthomonas fragariae in symptomless strawberry plants [J]. Journal of Plant Diseases and Protection, 2004, 111(1): 3951.
[8]" JIANG Hongchen, DONG Hailiang, ZHANG Gengxin, et al. Microbial diversity in water and sediment of Lake Chaka, an athalassohaline lake in northwestern China [J]. Applied and Environmental Microbiology, 2006, 72(6): 38323845.
[9]" YOUNG J M, PARK D C, SHEARMAN H M, et al. A multilocus sequence analysis of the genus Xanthomonas [J]. Systematic and Applied Microbiology, 2008, 31(5): 366377.
[10]EDGAR R C. MUSCLE: multiple sequence alignment with high accuracy and high throughput [J]. Nucleic Acids Research, 2004, 32(5): 17921797.
[11]TAMURA K, STECHER G, KUMAR S. MEGA11: Molecular evolutionary genetics analysis version 11 [J]. Molecular Biology and Evolution, 2021, 38(7): 30223027.
[12]GAMO M, SHOJI T. A method of profiling microbial communities based on a most-probable-number assay that uses BIOLOG plates and multiple sole carbon sources [J]. Applied and Environmental Microbiology, 1999, 65(10): 44194424.
[13]O’CONNELL S P, GARLAND J L. Dissimilar response of microbial communities in Biolog GN and GN2 plates [J]. Soil Biology amp; Biochemistry, 2002, 34(3): 413416.
[14]ROUSK J, BTH E. Growth of saprotrophic fungi and bacteria in soil [J]. FEMS Microbiology Ecology, 2011, 78(1): 1730.
[15]蒙姣荣, 蒙月月, 朱丽玲, 等. 广西桑树细菌性枯萎病菌生物学特性及防治药剂筛选[J].广西植保, 2015, 28(3): 17.
[16]谭才邓, 朱美娟, 杜淑霞, 等. 抑菌试验中抑菌圈法的比较研究[J]. 食品工业, 2016, 37(11): 122125.
[17]HILDEBRAND P D, BRAUN P G, RENDEROS W, et al. A quantitative method for inoculating strawberry leaves with Xanthomonas fragariae, factors affecting infection, and cultivar reactions [J]. Canadian Journal of Plant Pathology, 2005, 27(1): 1624.
[18]AH-YOU N, GAGNEVIN L, GRIMONT P A, et al. Polyphasic characterization of xanthomonads pathogenic to members of the Anacardiaceae and their relatedness to species of Xanthomonas [J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(Pt 2): 306318.
[19]TIMILSINA S, JIBRIN M O, POTNIS N, et al. Multilocus sequence analysis of xanthomonads causing bacterial spot of tomato and pepper plants reveals strains generated by recombination among species and recent global spread of Xanthomonas gardneri [J]. Applied and Environmental Microbiology, 2015, 81(4): 15201529.
[20]WEI Feng, LIANG Xia, SHI Jiangcheng, et al. Pan-genomic analysis identifies the Chinese strain as a new subspecies of Xanthomonas fragariae [J]. Plant Disease, 2024, 108(1): 4549.
[21]TURECHEK W W, PERES N A. Heat treatment effects on strawberry plant survival and angular leaf spot, caused by Xanthomonas fragariae, in nursery production [J]. Plant Disease, 2009, 93(2): 299308.
[22]WANG Danjuan, SHI Jiancheng, FAN Li, et al. Systemic colonization of Xanthomonas fragariae strain YL19 causing dry cavity rot of strawberry crown tissue in China [J]. Plant Disease, 2023, 107(11): 35423552.
[23]FARHA W, ABD EL-ATY A M, RAHMAN M M, et al. An overview on common aspects influencing the dissipation pattern of pesticides: a review [J/OL]. Environmental Monitoring and Assessment, 2016, 188(12): 693. DOI: 10.1007/s10661-016-5709-1.
[24]SHARMA A, GUPTA A K, DEVI B. Current trends in management of bacterial pathogens infecting plants [J]. Antonie van Leeuwenhoek, 2023, 116(4): 303326.
[25]杨万风, 刘艳, 刘翔, 等. 草莓角斑病菌室内抑菌药剂筛选[J].江苏农业科学, 2011, 39(5): 161162.
[26]本报讯. 农用硫酸链霉素正式退出舞台[N].中国农资, 2016-7-1(21).
[27]KIM D R, GANG G H, JEON C W, et al. Epidemiology and control of strawberry bacterial angular leaf spot disease caused by Xanthomonas fragariae [J]. Plant Pathology, 2016, 32(4): 290299.
[28]WANG Zhijiang, JI Sunyoung, SI Yuexiu, et al. The effect of validamycin A on tyrosinase: inhibition kinetics and computational simulation [J]. International Journal of Biological Macromolecules, 2013,55: 1523.
(责任编辑:田" 喆)

