多种情感与认知任务驱动下大脑可泛化神经表征的发育模式*
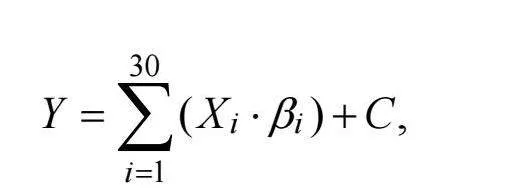

摘 "要""从脑智发育视角来讲, 神经系统随着心理发展会产生出一系列具有功能特异化(specialization)且高度协同的模块。这些模块之间究竟如何协同支撑儿童情感与认知功能发展呢?本研究综合利用多个经典的情感与认知任务范式(含注意网络测试、情绪匹配和工作记忆任务)以及层级化(hierarchical)的多体素神经表征建模方法, 重点考察7~12岁学龄儿童多元需求(multi-demand)额顶系统在情感与认知任务驱动下的通用性(task-general)作用以及分层级神经表征的组织方式。结果表明:儿童低年龄组、儿童高年龄组和成人组被试均表现出了多元需求额顶系统(包括顶内沟和额眼区域)共同参与多种情感与认知任务的现象, 即跨任务共同激活; 值得强调的是, 学龄儿童多元需求额顶系统表现出了更低水平的跨任务神经表征可泛化性(generalizability), 而作为控制分析的前扣带回、背外侧前额叶和前脑岛则没有表现出组间的可泛化性差异。我们推测多元需求额顶系统在发育中可能作为一个潜在的通用性“枢纽”, 通过组构性(compositionality)的信息组织方式, 实现不同任务目标驱动下分层级的神经表征与计算, 进而支撑情感与认知功能随龄的发展。本研究突破了当前单任务范式视角下的发展认知神经科学研究框架, 有望为理解跨情感与认知领域的脑智发育工作原理和开发人工智能新型算法提供新的启示。
关键词""情感与认知, 脑智发育, 特异化, 神经表征, 可泛化
分类号""B842; B845
1 "前言
从儿童期到成年期, 人类大脑功能性发育为不同情感与认知能力的发展及成熟奠定了生物学基础(Paus, 2005; Toga et al., 2006), 这其中包括神经模块的特异化(Kanwisher, 2010; Richards, 2001)以及神经系统的分离、整合和协作等过程(Baum et al., 2017, 2020; Cole amp; Schneider, 2007; Fair et al., 2009; Qin et al., 2012, 2014)。到目前为止, 研究者们达成的共识是神经模块可以在发育进程中支持特定认知功能的成熟, 但是, 在多神经生物模式下如何共存以支持跨情感与认知领域下不同能力的发展, 还未有研究进行探索。要解决这一问题, 需要从跨领域发展的视角出发, 结合多种情感与认知范式、任务态磁共振成像和层级化的统一模型建构, 考察多类别情感与认知领域下的通用性神经发育基础。
在发展认知神经科学领域, 神经特异化的概念最早是由弗朗兹·瑟夫·加尔(Franz Joseph Gall)提出的, 他认为大脑是思维的载体, 思维是由不同的心智能力组成的, 而不同的心智能力各自位于特定的大脑皮层中(Kanwisher, 2010)。之后形成的“成熟理论” (The maturational perspective)也同样认为, 大脑特定区域的成熟与新的感觉、运动或高级认知功能的出现是有直接联系的(Johnson, 2001; Kanwisher, 2010)。这些研究认为, 在儿童期的特定年龄阶段, 新认知功能的出现取决于新大脑皮层区域的成熟, 其神经解剖发育程度可以用于确定该区域对应认知功能的发育程度(Diamond amp; Goldman-Rakic, 1989; Johnson, 2001), 而且不同的认知能力特异于各自的大脑皮层区域(Atkinson, 1984; Johnson, 1990; Richards, 2001)。大脑皮层特异化成熟有许多极具代表性的脑区, 比如, 梭状回面孔识别区(Fusiform face area, FFA)和旁海马空间加工区(Parahippocampal"place area, PPA) (Kanwisher, 2010; Kanwisher et al., 1997)。虽然神经特异化理论被许多科学家所认可, 但是它也并不能完美的解释功能性大脑发育研究所有的发现。一些研究表明, 神经解剖学认为发育最晚的脑区, 比如前额叶皮层, 实际上在婴儿出生后不久就被某些认知功能诱发了激活(Johnson, 2001)。因此, 新情感与认知功能的出现, 并不一定是由于神经发育过程中原本不成熟的“沉默”区域发展为成熟的“活跃”区域而形成的。例如, 婴儿在出生后的几个月就能够对情绪的表达进行感知, 左右脑均会变得活跃, 但是针对不同情绪则会发展出不同的左右脑偏向神经反应模式(Missana amp; Grossmann, 2015)。尽管如此, 在儿童脑智发育过程中, 神经特异化现象不可否认是一定存在的, 只是可能大脑的神经发育过程中不只存在这一种成熟机制。随着发育认知神经科学领域研究的不断深入, 许多研究者开始向神经特异化提出质疑。例如, 有研究发现每一个纹状体外皮层区域都在执行许多不同类型的视知觉任务, 而不像视觉系统中的多数神经元那样执行唯一性的单功能分析(Schiller, 1996)。此外, 尽管我们通常认为布洛卡区的左侧额叶是特异于语言认知加工的脑区, 但也有研究发现语言处理相关的大脑区域同时参与到了其他多种认知领域当中(Gazzaniga, 2004)。
基于发展认知神经科学的理论和实证研究进展, 有研究者提出了用于解释人类功能性大脑发育机制的通用性理论——式特异化理论(The interactive specialization theory), 旨在解释可观测行为发展的功能性大脑发育基础(Johnson, 2001, 2011)。之所以将这种广泛性的观点称为“架构(Frameworks)”或“通用性理论(General theories)”, 因为其来源是基于对大量数据的思考和观点总结(Johnson, 2011; Morton amp; Frith, 1995)。交互式特异化理论认为, 功能性脑发育是以脑区或神经系统间的相互作用为基础而发展成熟的, 婴儿期新认知能力的产生与多个脑区激活模式的变化紧密相关, 而不是仅仅与一个或多个脑区的激活强度的变化有关(Johnson, 2000)。Friston等研究者指出, 某个脑区对于特定认知能力的响应属性取决于该脑区与其他脑区的协作模式及其当前的激活状态 (Friston amp; Price, 2001)。杏仁核与前额叶皮质作为情感过程的关键性神经环路, 在神经发育过程中会出现网络连接模式由正向负的“发展性转变” (Gee et al., 2013)。将这一主张延伸到脑智发育上来, 意味着我们应该观察个体发育过程中皮层激活模式的变化, 因为脑区之间会通过相互协作和竞争以获取其在新的计算能力中的角色。在儿童期的脑发育中, 皮层对刺激加工的动态变化与脑区间相互作用以塑造区域连通的规律是一致的, 比如, 多脑区构成的神经系统协同支持特定基础认知的发展(Hao et al., 2024)。此外, 来自于遗传导致功能性大脑发育障碍的研究发现, 多个皮层和皮层下脑区间的异常协作均会导致自闭症和威廉斯氏综合征等发育障碍的发生(Filipek, 1999; Rumsey amp; Ernst, 2000)。
多元需求系统(Multiple demand system)是一个以不同神经表征模式参与多种情感与认知任务的共激活神经系统, 认知方面包括感知觉、注意、工作记忆和执行控制等过程, 情感方面包括情绪识别、情绪调节等过程(Adolphs, 2002; Camilleri et al., 2018; Duncan, 2010; Duncan amp; Owen, 2000; Sugiura et al., 2023)。单细胞和功能性磁共振成像方面的证据表明, 多元需求系统在参与和控制各种认知任务时起着关键的“枢纽”作用, 比如, 专注于当前认知操作的具体内容, 会随着注意力的转移而快速重新组织并有效分离连续的任务步骤(Duncan, 2010, 2013; Fedorenko et al., 2013)。许多功能性神经影像学研究的发现都集中在有些许差异的额顶系统上, 该系统在执行各种任务时会出现共激活现象, 比如, 选择性注意、执行功能、按键抑制、冲突监控以及新颖问题解决等(Cole amp; Schneider, 2007; Dosenbach"et al., 2006; Duncan amp; Owen, 2000; Fedorenko et al., 2013; Hugdahl et al., 2015)。在探索复杂的人类行为背后的神经发育基础这个问题上, 不仅仅是要探索神经系统如何控制孤立的思想或行为步骤, 还必须弄清楚核心的神经系统是如何将任务分解为子部分并依次解决这些子问题的, 而多元需求系统的神经活动很有可能就是此类情感与认知过程的基础, 用以解释跨不同情感与认知领域的广泛激活以及在人类复杂行为背后的核心作用。到目前为止, 还未有研究对多元需求额顶系统在儿童脑智发育过程是如何成熟以及对儿童多种情感与认知发展的影响进行过探索。
最近, 神经科学领域的研究者们开始关注神经系统组构性(Compositionality)编码和神经表征泛化(Generalization)机制对多种情感与认知能力的通用性支持作用(Kragel et al., 2018; Yang et al., 2019)。此外, 额顶多元需求系统, 被认为是支持不同认知能力切换的灵活性“枢纽”, 这可能是通过基于神经元群体的组构性编码机制实现的, 该机制能够通过组织神经元群体在不同模式下的神经计算信息以支持多种情感与认知功能(Cole, Reynolds, et al., 2013)。一个神经元在执行多种不同任务时可能被激活也可能未被激活, 不同的任务可能被各自“私有”的神经元集群所支持, 也可能涉及其相关神经系统中的每个神经元, 又或介于这两种模式之间。如果多个任务需要一个共同的基础认知过程, 那这不同的任务会使用一部分共享的神经元集群, 而组构性(Compositionality)这一概念被研究者引入就为共享的神经元集群如何支持多个任务提供了途径(Reverberi et al., 2012), 该规则随后又在机学习的神经网络模型中得到了印证(Yang et al., 2019)。在人类神经影像研究中, 位于额顶皮层的前额叶参与了许多情感与认知功能, 不同的神经表征模式可以发挥各种功能, 例如通过向大脑的其他部分提供自上而下的指令, 引导着认知过程正常进行(Miller amp; Cohen, 2001; Stuss amp; Knight, 2013), 它在多种任务表征中还支持着规则的理解和运用等(Cole et al., 2011; Sakai, 2008; Tschentscher et al., 2017; Wallis et al., 2001), 此外, 还有外侧前额叶皮层中复杂认知表征对组构性编码的有效支持(Cole et al., 2011; Reverberi et al., 2012)。有研究者将功能性磁共振成像数据在不同任务下神经激活的多变量表征模式分解为不同层级成分, 识别了潜在的可泛化认知子领域但特异于认知领域的多变量表征形式, 他们发现, 内侧额叶皮层表征可泛化支持到单类研究和认知子领域层级水平, 但却特异于不同的认知领域(Kragel et al., 2018)。将神经泛化指标应用到脑智发育领域, 可以理解为某一特定神经系统通过组构性的编码机制, 在发育中逐渐成熟从而支持多种情感与认知发展的过程。这一发现为神经整合理论的发展提供了可能性, 该理论解释了通过不同神经元群体融合的机制来达成特定计算目标的过程, 即在某一特定的神经系统中实现跨情感与认知领域神经信息加工和计算的功能, 以支持多种心理行为的执行。
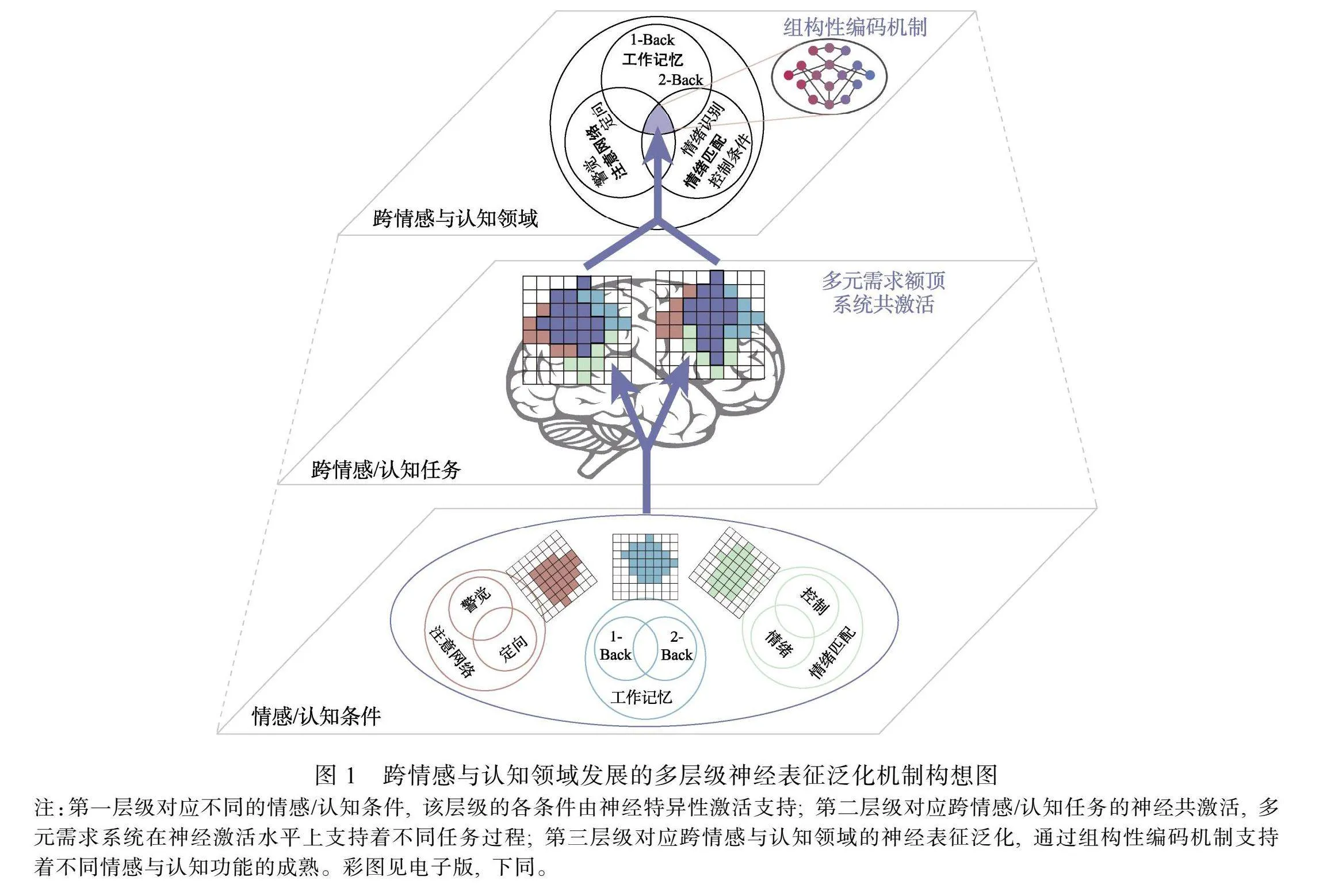
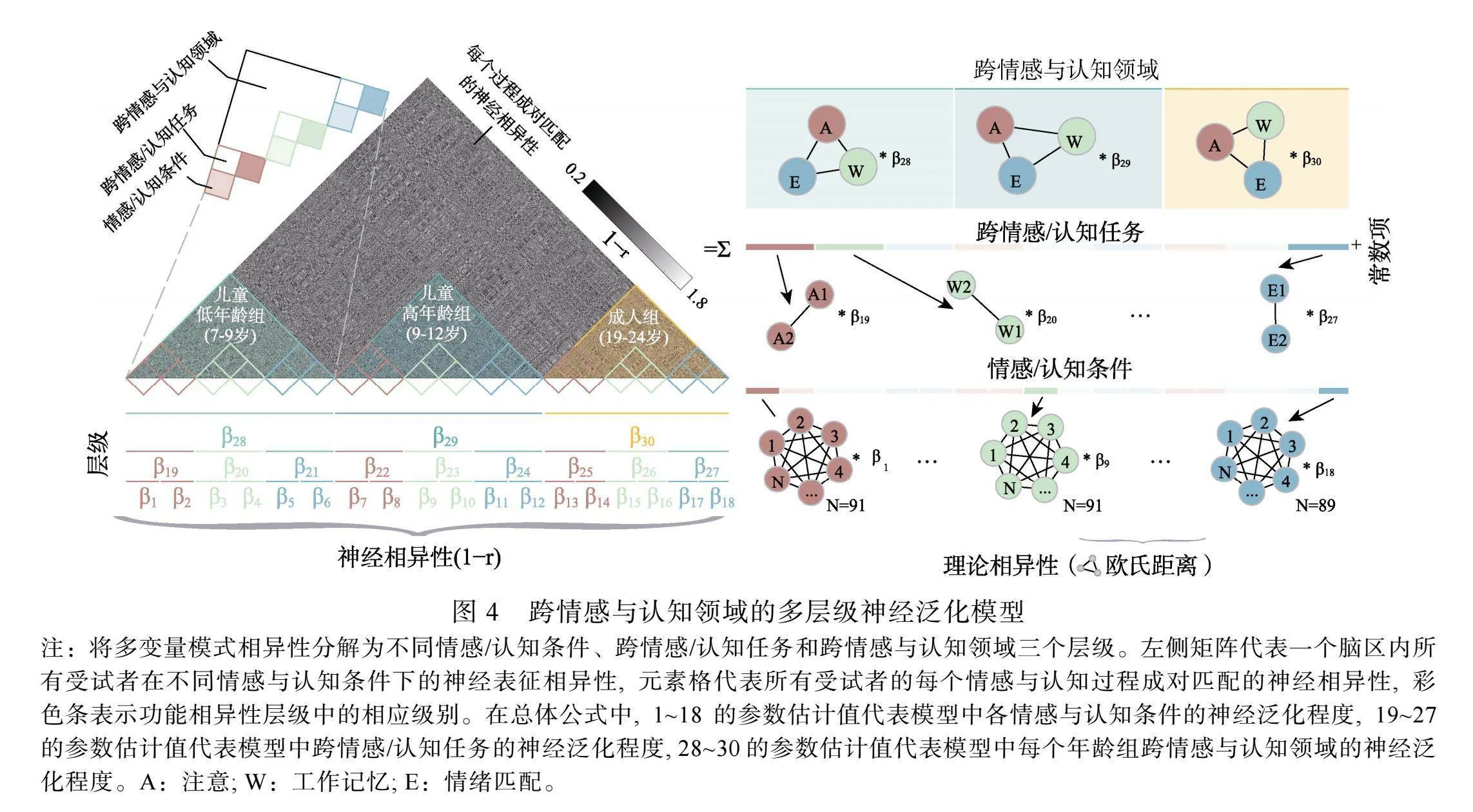
关于功能性脑发育理论的探索, 尽管基于不同皮层区域的相继成熟导致相关情感与认知功能发展的理论已经获得了许多实证性研究的支持, 但是, 越来越多的证据为儿童脑智发育的探索指出了新的方向, 即新情感与认知功能的出现是不同脑区或神经系统间相互作用新模式的结果。而且, 这些脑区或神经系统之间相互作用导致的各类情感与认知功能神经表征激活模式的改变, 也可能是人类习得新情感与认知功能的内在特征, 即学习泛化的神经基础。综合多元需求系统和交互式特异化理论构想(Johnson, 2011), 已有研究已经充分证明特定神经系统可以在发育进程中支持特定情感或认知功能的成熟, 我们推测, 还存在着一种特殊的神经系统, 可以在差异化的神经表征共激活模式下, 通过组构性编码机制对不同情感或认知功能相应的神经表征信息进行组织, 从而支持不同情感与认知领域的成熟。也就是说, 儿童大脑发育过程中, 除神经特异化进程外, 可能还存在着另外一种潜在的支持多情感与认知发展的脑发育进程。如图1所示, 是我们结合了多元需求系统、交互式特异化理论和本研究的实验设计提出的构想, 试图描绘一个跨情感与认知领域发展的多层级神经表征泛化机制的模型。针对多元需求系统参与的情感与认知过程, 我们选取了具体代表性的认知领域内的注意和工作记忆任务, 以及情绪领域的情绪识别任务对上述问题进行了探索。
2 "方法
2.1""被试
本研究共招募了548位正常发育的儿童被试(7~12岁, 平均值 ± 标准差(M ± SD) = 9.20 ± 1.33岁)和104名健康的成年人(19~25岁, M ± SD"= 21.91 ± 1.81岁), 所有被试均来自学校和社区招募, 入组被试的人口统计学信息见表1。被试在执行情感与认知任务的同时进行功能性磁共振成像扫描,
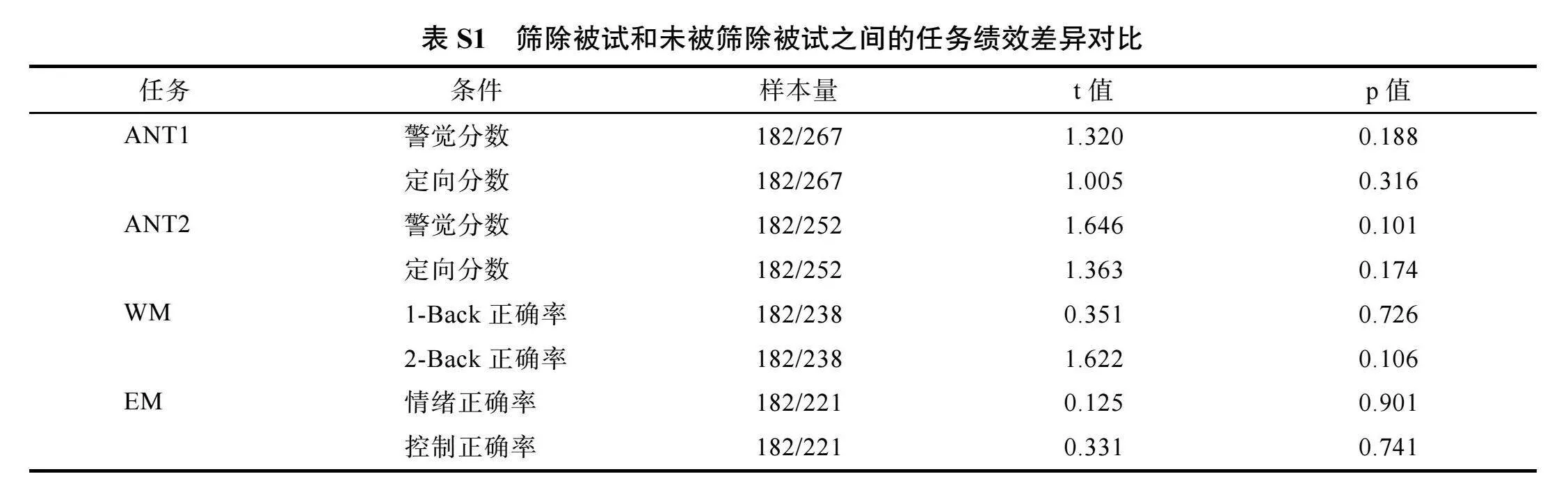
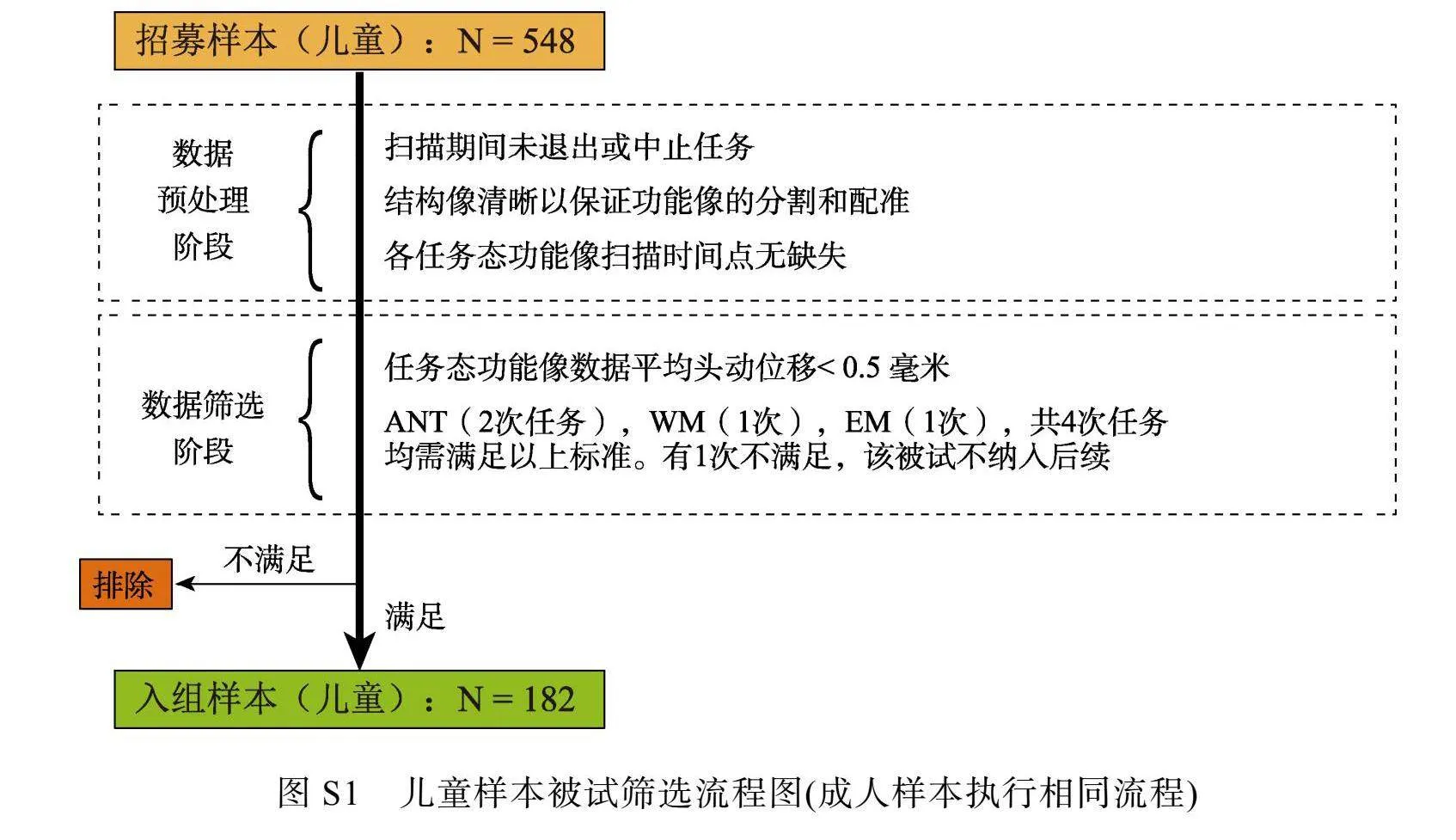
这些任务包括注意网络测试(Attention network test, ANT)、数字N-Back工作记忆(Working memory, WM)和情绪匹配(Emotion matching, EM)任务。根据赫尔辛基宣言的标准, 实验程序已获当地伦理批准, 实验前被试会仔细阅读并签署书面知情同意书, 对于儿童, 由其父母之一或法定监护人签署。被试均报告无视力问题史、无神经或精神疾病史、无影响按键反应的手部运动疾病史、目前未使用任何药物或毒品。由于需要统一构建多层级结构模型, 因此纳入分析的被试需要完成所有任务并且满足头动剔除标准, 平均头动位移(framewise displacement, FD)值小于0.5 mm (ANT任务两次实验均需满足标准), 最终满足入组标准的被试包括89名被试的成人组(19~24岁, M ± SD"= 21.74 ± 1.64岁)和182名儿童, 儿童按照出生天数平均分到了儿童低年龄组(7~9岁, M ± SD"= 8.22 ± 0.67岁)和儿童高年龄组(9~12岁, M ± SD"= 10.24 ± 0.74岁)。相对于总体样本, 最终纳入分析的样本量剔除比例较高, 其原因是由于儿科神经影像学检查通常极具挑战性, 例如, 扫描过程中头部运动过多、扫描任务意外中止、以及需要4个任务同时满足剔除标准等。我们目前的研究(剔除比例66%)以及国际上类似的儿童研究(剔除比例49%)均会遇到这样的问题(Zhang et al., 2019), 头部运动对fMRI数据收集的质量和后续数据分析的可靠性有着至关重要的影响, 因此我们选择了相对严格的纳入标准, 具体的被试筛选流程见补充材料(见网络版图S1)。此外, 为了排除未被筛除被试和筛除被试在认知或情感上特质差异对实验结果的影响, 我们对比了两组被试各个任务的绩效, 未发现显著性的任务绩效差异, 结果报告见补充材料(见网络版表S1)。
2.2""功能磁共振影像扫描参数
我们通过使用Siemens 3.0 T磁共振成像扫描仪(Magnetom Prisma syngo MR D13D, 德国埃尔兰根), 采用64通道线圈, 获取了基于血氧水平依赖响应的T2*敏感平面回波快速成像序列的功能性全脑神经影像。通过以下参数获取了平行于前后联合(anterior commissure, AC; posterior commissure, PC)并覆盖整个大脑的33个轴向切片(层厚为3.5 mm, 层距为0.7 ms):重复时间(repetition time, TR)为2000 ms, 回波时间(echo time, TE)为30 ms, 翻转角(flip angle, FA)为90°, 体素尺寸(voxel size)为3.5"m × 3.5 mm × 3.5 mm, 视场(field of view, FOV)为224 mm × 224 mm。每个受试者的高分辨率解剖图像是通过三维矢状T1加权磁化准备快速梯度回波序列采集的, 共采集192层, 重复时间为2530"s, 回波时间为2.98 ms, 翻转角为7°, 反转时间(inversion time, TI)为1100 ms, 体素尺寸为1.0 mm × 1.0 mm × 1.0 mm, 采集矩阵(acquisition matrix)为256×224, 视场为256 mm × 224 mm, 每层层厚为1 mm。
2.3""功能磁共振影像数据预处理
我们使用了基于Nipype 1.2.0的fMRIPrep 1.4.1 (Esteban et al., 2019, 2020; Gorgolewski et al., 2011)对功能影像数据进行了预处理。对于每个受试者的每个有效数据, 前4个功能图像会被剔除, 以减轻机器磁化准备和受试者适应扫描噪声对图像数据质量的影响, 并执行了以下预处理流程。首先, 使用fMRIPrep的自定义脚本生成参考体及其剥离颅骨的版本, 基于共同映射到血氧水平依赖(blood oxygenation level-dependent, BOLD)参考的场图, 使用源自Greve的epidewarp.fsl脚本的定制工作流(Glasser et al., 2013), 估计了用于校正磁化率变形的变形场, 然后基于估计的磁化率失真指数, 计算出未变形的BOLD图像, 以实现与结构数据更准确地配准。然后, 使用flirt (FSL 5.0.9)和基于边界的配准方法将BOLD图像配准到T1加权结构图像(Greve amp; Fischl, 2009; Jenkinson amp; Smith, 2001)。配准一共设置了9个自由度, 以解决BOLD图像中的失真问题。在使用mcflirt (FSL 5.0.9)进行时空滤波之前, 先估算相对于BOLD参考图像的头动参数(变换矩阵及6个平移和转动参数) (Jenkinson et al., 2002)。使用AFNI_20160207的3dTshift功能对每个任务的功能像进行了时间层校正(Cox amp; Hyde, 1997)。通过应用单一复合变换来校正头动和磁化率失真, 并将所得图像重采样到原始空间。之后, 将图像重采样到标准空间中, 并在“MNI152NLin6Asym”空间中生成经过预处理的BOLD图像。
在去除非稳态图像并使用6 mm的半高全宽高斯核进行空间平滑之后, 自动对MNI (Montreal Neurological Institute)标准空间时间序列上的预处理图像执行基于独立成分分析的ICA-AROMA (Automatic removal of motion artifacts)算法去除了头动伪影(Pruim et al., 2015)。此外, 还计算了“aggressive”噪声回归因子, 并将其加入到混淆变量文件中。基于预处理的图像, 还计算了几个混淆变量的时间序列:包括FD值、DVARS和3个全局信号(脑脊液、白质和全脑平均信号), FD和DVARS是针对每个整体功能图像序列计算的, 均使用了Nipype中的相关程序包实现(Power et al., 2014)。另外, 自动获取了一系列生理噪声回归量, 包括时间(tCompCor)和解剖(aCompCor)成分, 时间成分是皮层下区域Mask中前5%的可变体素计算出的6个成分。解剖成分是在将上述Mask与在T1w空间中计算的CSF和WM的交集内计算的6个成分, 用以进行基于成分的干扰信号噪声校正(Behzadi et al., 2007)。该校正过程是对进行过预处理的图像(使用截止时间为128s的离散余弦滤波器)的时间成分和解剖成分进行高通滤波后, 进行了主成分的估计。对于每个CompCor分解, 保留了具有最大奇异值的k个分量(算法自动计算, 每个被试会有所差异), 使得噪声成分的时间序列足以解释干扰Mask (脑脊液、白质等)中50%的变异, 干扰Mask (脑脊液、白质)是基于解剖像进行自动化分割得到的。超出0.5 mm FD值或1.5倍标准化DVARS阈值的图像被标注为运动异常值, 随后通过组合相关变换(包括头部运动变换矩阵、可用的敏感度失真校正以及与解剖和输出空间的联合配准)进行插值。体素重采样使用了“antApplyTransforms”的Lanczos插值算法进行, 以最大程度地减小其他平滑核的平滑影响(Lanczos, 1964)。
2.4""单变量一般线性模型分析
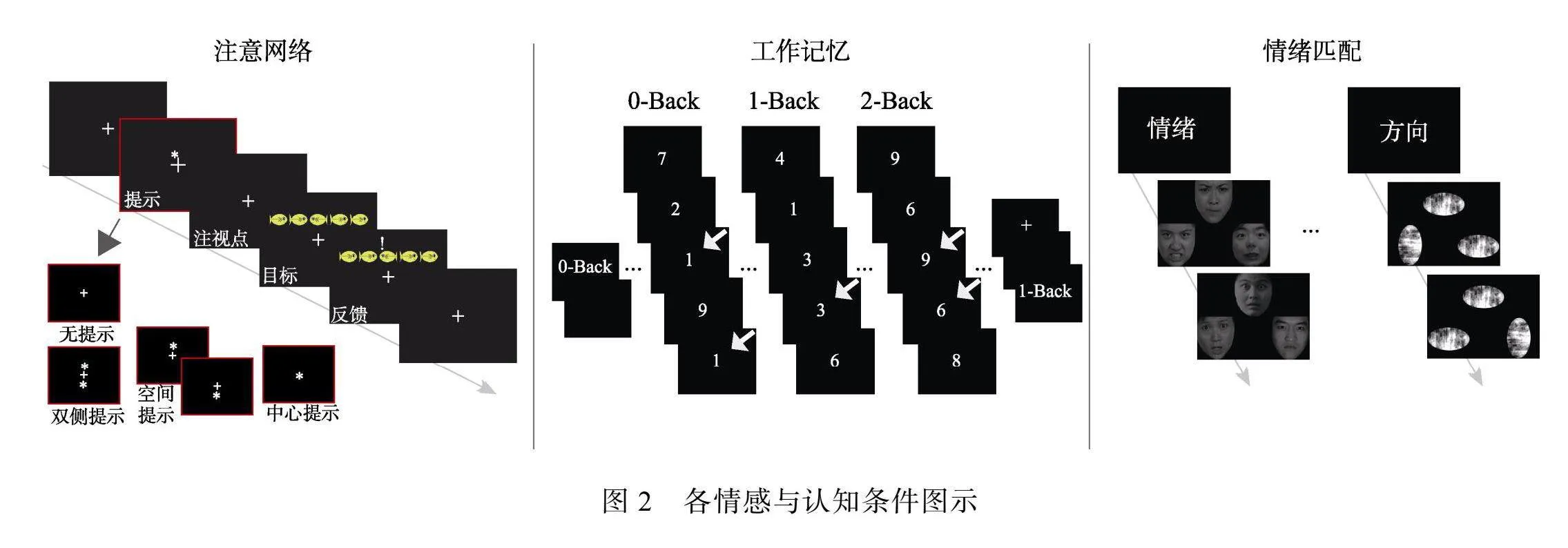
各情感与认知任务的实验流程如下(图2):(1)ANT的每个试次均以中央注视点开始, 随机持续约400至1000 ms, 随后出现150 ms的提示线索, 线索消失后出现450 ms的固定注视点, 随后, “小鱼”靶刺激出现并一直持续显示, 直到参与者按下反应按钮或达到1000 ms的时间限制, 最后, 固定注视点再次出现, 持续时间为1000 ms减去相应的受试者反应时间。受试者按键之后, 计算机显示屏呈现视觉反馈。对于每次试验, 受试者必须按向左或向右按钮以指示靶刺激阶段中居中呈现小鱼的方向, 我们要求受试者在每次试验中尽可能快速、准确地做出决定。每个受试者参与两次试验以达到足够的试次数和统计强度, 每次实验共96个试次, 每个提示条件各24个试次, 持续时间大约6 min。(2)WM需要完成3个工作记忆负荷(0-, 1-和2-Back)任务, 每次循环由8~12 s的静息基线开始。在每个Block中, 通过屏幕向受试者呈现由15个数字组成的随机序列, 每个数字在屏幕中央持续400 ms, 然后间隔1400 ms。每个Block持续27 s, 共12个Block持续时间大约6 min。在0-Back条件下, 要求受试者判断当前屏幕中央呈现的数字是否为“1”, 如果是则按键确认; 在1-Back条件下, 要求受试者判断屏幕中央呈现数字是否与前一次呈现为同一个数字; 在2-Back条件下, 要求受试者判断屏幕中央呈现的数字是否与往前第二个呈现的为同一个数字。(3)EM任务包括情绪和方向识别两个条件, 在情绪识别的Block中, 受试者被要求观看3张情绪面孔, 并判断底部的两个面孔中哪一个与顶部的目标面孔表达了相同类别的情绪(愤怒或恐惧)。在方向识别控制条件的Block中, 受试者被要求观看由混乱的面孔素材填充的3个椭圆图形(垂直或水平呈现), 并要求他们在底部选择与上部目标方向相同的一个。每个Block都以5 s的条件提示开始, 指示该Block是情绪或方向识别条件, 每个Block中刺激呈现6次, 每次5 s。每个Block持续35 s, 共10个Block, 持续时间大约6 min。
为评估ANT, WM和EM中与任务相关的大脑激活反应, 我们分别构建了3个任务中各实验条件的回归因子。对于ANT, 将条件(无提示、双侧提示、中心提示、空间提示)建模为独立的事件相关回归因子, 包括警觉(双侧提示 v.s. 无提示)和定向(空间提示 v.s. 中心提示)条件; 对于WM任务, 分别将两个条件(1-Back和2-Back)以及作为基线的0-Back建模为单独的回归变量; 对于EM任务, 将情绪和方向识别控制条件建模为单独的回归变量。对于以上任务各条件, 相关的对比参数估计图像最初是在个体水平上生成的, 为了保证后续激活和建模分析中各年龄组人数的平衡, 我们将儿童分为两个组, 分别是儿童低年龄组(7~9岁, N"= 91), 儿童高年龄组(9~12岁, N"= 91), 以及成人组(19~24岁, N"= 89), 随后按照分组进行了组水平激活分析, 用于寻找不同情感与认知领域下多元需求额顶系统的神经共激活模式和神经泛化水平的计算。3个任务的回归因子与SPM12中的典型血液动力学响应函数(hemodynamic response function, HRF)进行了卷积。此外, 还包含了每个受试者的在脑脊液和白质中提取的全局信号、6个头动序列参数(包括3个平动以及3个转动参数), 以消除与噪声和头部运动相关变异性的影响。我们使用1/128 Hz的高通滤波, 并在一般线性模型框架中使用一阶自回归模型(first-order autoregressive model, AR (1) )进行了序列相关校正。显著的激活簇是通过严格的1 discovery rate (FDR)多重比较校正(阈值q"= 0.05, 激活簇 gt; 45个体素)来确定的。
2.5""多元需求额顶神经系统ROIs的定义
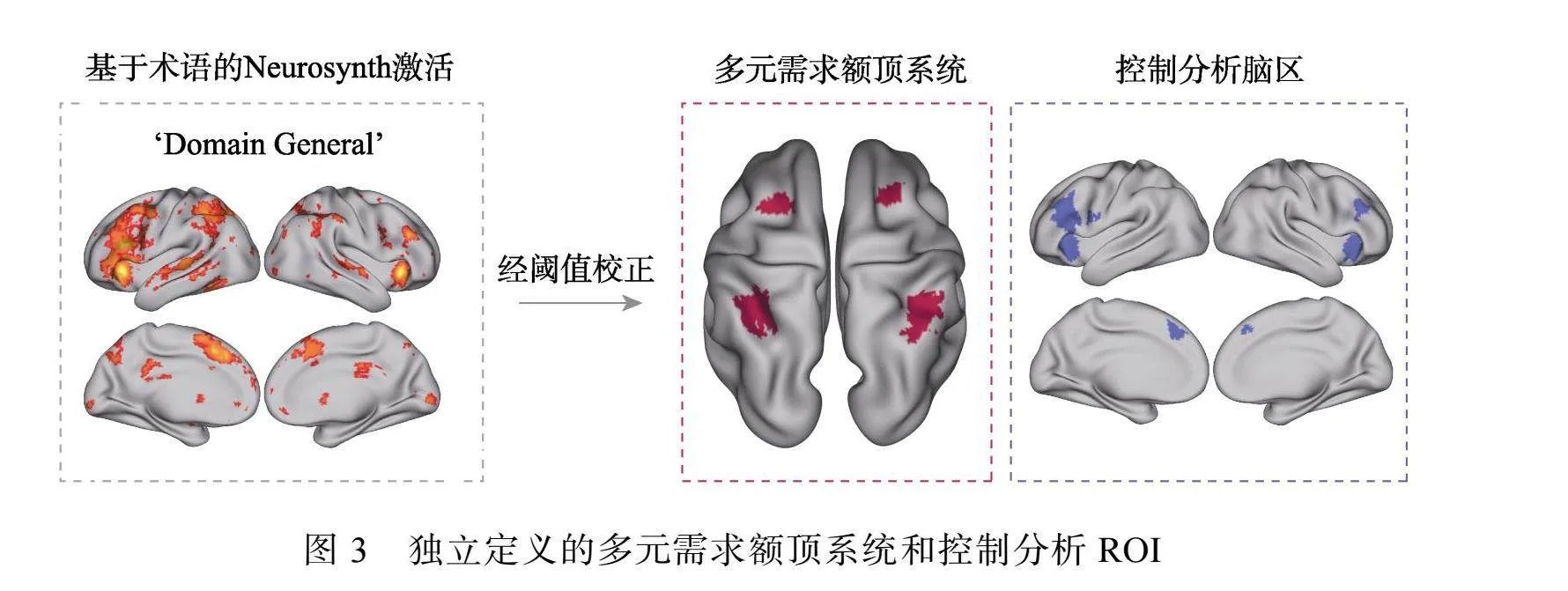
在对多元需求额顶系统的感兴趣区(region of interesting, ROI)进行定义时, 为了避免双浸(double dipping)对于统计结果的影响, 我们使用了基于术语的Neurosynth平台(www.neurosynth.org)对ROI进行了独立定义, 我们直接在该平台使用“domain general”一词进行了搜索并找到相关的大脑激活图(图3)。然后, 在此基础上我们只取强度最高的前50%的体素以过滤掉低相关的区域, 最终选定了多元需求额顶系统的代表性皮层区域, 包括双侧的顶内沟(intraparietal sulcus, IPS)和双侧的额眼区域(frontal eye field, FEF), 此外, 我们还选取了支持注意、工作记忆和情绪功能的相关脑区作为本研究的控制分析ROI, 这些ROI在前人文献中也充分地参与着这些功能的执行, 是具有代表性的脑区(Barbey et al., 2013; Petersen amp; Posner, 2012; Uddin et al., 2017), 包括双侧的侧前扣带回(dorsal anterior cingulate cortex, dACC)、背外侧前额叶皮层(dorsolateral prefrontal cortex, DLPFC)和前部脑岛(anterior insula, AI)。对于多元需求额顶系统的代表性皮层区域, 本研究试图探索是整个额顶网络还是其中的关键脑区存在神经表征泛化现象, 因此分别针对IPS+FEF、IPS、FEF均进行了跨情感与认知领域的神经泛化水平进行测量。
2.6""跨情感与认知领域的多层级神经泛化模式分析
我们通过构建跨情感与认知领域的多层级结构表征分析方法(Kragel et al., 2018), 评估了任务诱发的多体素神经活动模式在不同情感与认知进程中的可泛化性, 然后检查了本研究中儿童低年龄组、儿童高年龄组和成人组之间跨情感与认知领域的神经泛化水平的发育性差异。在预先定义好的ROI下, 分别构建了3个年龄组被试的多个情感与认知领域内不同条件下的多体素激活模式层级结构模型。该模型被组织为3个层级结构(图4左), 包括不同的情感/认知条件作为第一层, 跨情感/认知任务作为第二层, 以及可泛化的跨情感与认知领域作为最高的第三层(测量的是跨不同情感与认知领域的多体素激活模式泛化程度)。
我们使用了一般线性模型(General linear model, GLM)进行了建模后的参数估计(图4)。表征相异性矩阵(Representational dissimilarity matrices, RDM)代表神经差异的观测值(Y), 是通过皮尔逊相关系数(r)计算所有被试的情感与认知过程成对匹配的空间距离之后, 再用1减去该值得到的(1 − r)。GLM是根据3个层级的理论相异性(X)的加权总和构建的, 包括从二元向量计算欧氏距离得出的理论相异性矩阵, 代表着第一层的不同情感/认知条件(18个RDM)、第二层的跨情感/认知任务(9个RDM)、第三层的跨情感与认知领域(3个RDM), 共30个以及一个常数项(C)之间的相对关系。此GLM公式如下:
其中, Y代表着神经相异性矩阵的空间距离, Xi代表着模型中每个层级的每个理论相异性的欧式距离,  代表着每个Xi对应的参数估计值, 即我们主要关注的神经模式的可泛化性, C代表一个常数项。这种方法使我们能够探索多体素激活模式的可泛化性指标, 以及不同的情感与认知领域之间共享多元需求机制的有效性, 层级结构模型的参数估计(β)提供了神经模式泛化水平的估计。
代表着每个Xi对应的参数估计值, 即我们主要关注的神经模式的可泛化性, C代表一个常数项。这种方法使我们能够探索多体素激活模式的可泛化性指标, 以及不同的情感与认知领域之间共享多元需求机制的有效性, 层级结构模型的参数估计(β)提供了神经模式泛化水平的估计。
在本研究中, 我们主要关注代表可泛化的跨情感与认知领域的第三层级参数估计, 在此层级上, 各回归因子可评估跨不同情感与认知领域的泛化程度, 正值代表不同过程之间共享的空间模式可泛化水平。参数估计值(β)的显著性推论是通过使用bootstrapping重新构建所有受试者的神经激活模式来进行的, 该过程涉及针对所有受试者的神经激活模式的5000次迭代来重建神经相异性的观测值(Y)。在每次重建中, 通过对每组被试在不同情感与认知条件下进行组内抽样, 再使用神经激活表征模式来构建了一个新的RDM并进行相应GLM的参数估计。然后, 5000次bootstrapping中生成的参数估计值(β)作为样本分布, 并通过使用正态近似进行推断, 将显著性定义为参数估计值中小于0的样本的比率。为了检查发育性的变化, 我们比较了3组受试者之间的参数估计的差异, 每次我们使用独立样本t检验从5000次迭代中针对这3组每组随机选择100个值进行组间的两两比较并获得p值, 这个过程会重复1000次, 因此, 相应的显著性定义为差异不显著结果(我们使用了p"= 0.001的阈值决定是否显著)的总数量除以1000。这么做的原因在于我们使用的方法在5000次迭代中本身就具有一定的随机性, 每次迭代会对每个情感与认知条件成对匹配的神经相异性进行随机化, 因此所产生的参数估计值(β)也有所不同, 这就构成了5000次结果的样本分布因此, 进行组间差异比较时, 要随机抽取100个值进行t检验。
3 "结果
3.1""不同情感与认知领域下多元需求额顶系统的神经共激活
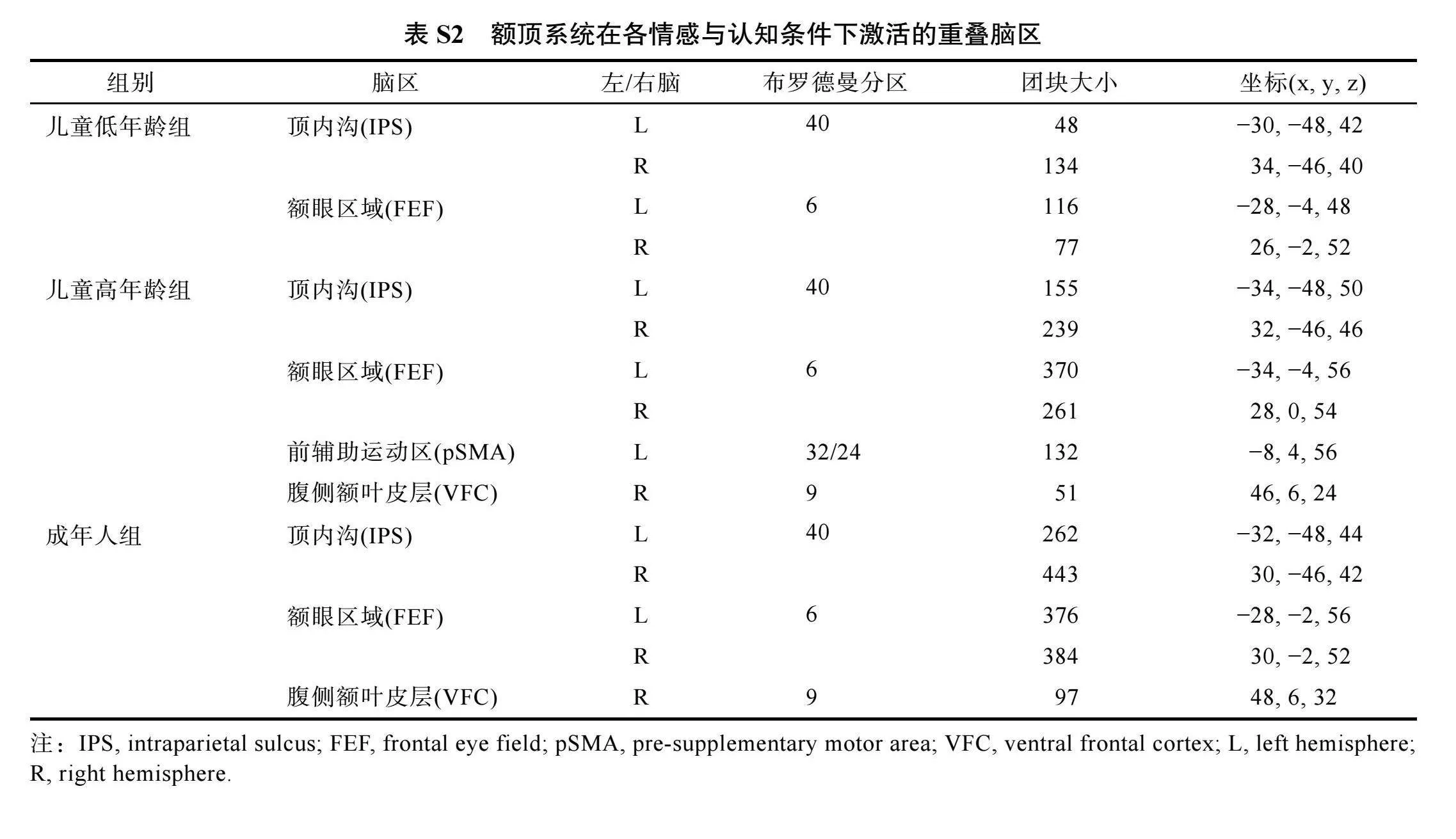
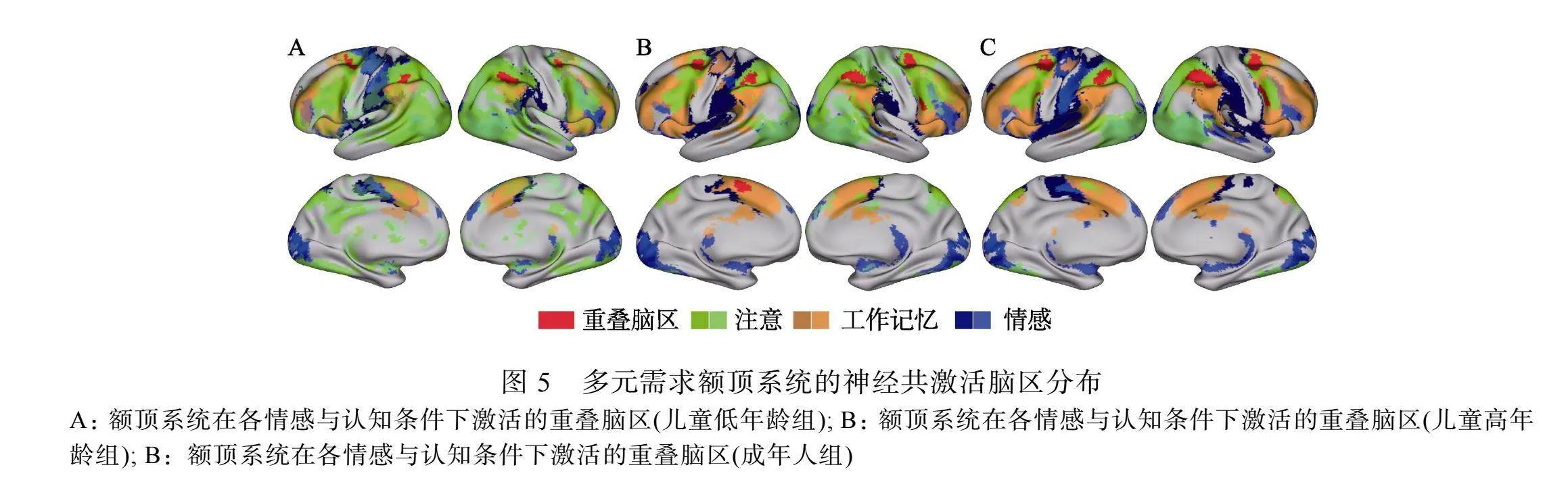
我们试图寻找不同情感与认知领域下多元需求额顶系统的神经共激活模式, 以考察该系统对于跨情感与认知领域发展的通用性支持作用。因此, 我们选择了认知领域中注意的警觉和定向条件、工作记忆的1-Back和2-Back条件以及情感领域中情绪识别和控制条件, 显著的激活簇是通过1 discovery rate (FDR)多重比较校正(阈值q"lt; 0.05, 激活簇 gt; 45个体素)来确定的, 通过叠加这些任务的神经激活以获取神经共激活的结果。如图5所示, 红色区域表示被试在6个条件中均被激活的脑区的重叠部分, 即各条件的激活交集。在3组被试中, 我们发现双侧顶内沟、双侧额眼区域均出现了跨情感与认知领域的神经共激活模式, 另外, 右侧腹侧额叶皮层(ventral frontal cortex, VFC)和左侧前辅助运动区(pre-supplementary motor area, pSMA)也表现出了部分组别的共激活现象, 但未在所有组别出现(如图5所示, 各组别重叠脑区报告表格见网络版表S2), 说明了这些脑区共同参与了这些任务的执行, 该结果与以往有关多元需求系统的研究发现表现出了高度一致的神经激活模式(Duncan, 2010; Fedorenko et al., 2013), 顶内沟和额眼区域是我们最为关注的多元需求额顶系统的核心组成部分。我们认为, 对其神经发育规律的探索, 需要从该系统中不同层级神经元的差异性共激活出发, 最终找出多元需求系统在儿童跨情感与认知领域发展中的影响机制。
3.2""跨情感与认知领域神经泛化水平的发育性差异
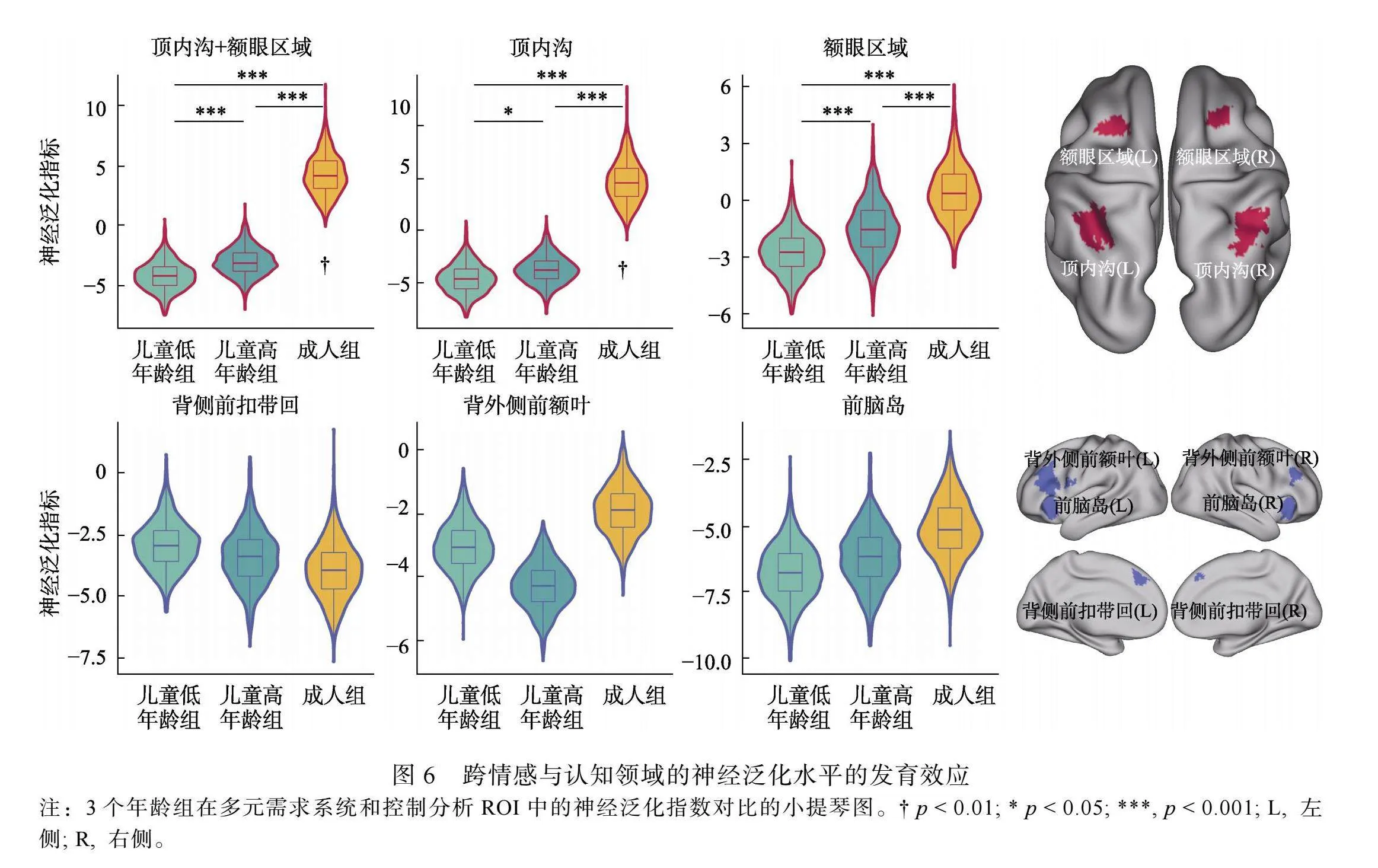
我们在检查跨情感与认知领域的神经表征泛化水平的发育性差异时发现, 成人在多元需求额顶系统(双侧IPS + 双侧FEF: p"= 0.0018)中表现出了显著高于随机水平的跨情感与认知的神经泛化水平, 特别是在双侧IPS中(p"= 0.004), 但是, 在控制分析的ROI (包括双侧dACC、双侧DLPFC和双侧AI, ps≥0.991)中却未发现统计上显著的皮层区域(图6)。有趣的是, 我们在两个儿童组的多元需求系统和控制分析的ROI中也均未发现显著的皮层区域(ps ≥ 0.854)。随后, 我们使用了bootstrapping方法检查了儿童低年龄组、儿童高年龄组和成人组之间泛化水平的发育性差异, 结果表明, 儿童在多元需求额顶系统中各个脑区均表现出了更低的跨情感与认知领域的神经泛化水平(ps"≤"0.05) (图6)。
4 "讨论
本研究通过融合发展心理学、无创功能性磁共振成像、跨情感与认知领域的多任务范式(包括注意网络、工作记忆和情绪匹配任务)和创新性的层级化神经表征统一建模等跨学科技术方法, 基于多元需求系统在不同任务的共激活规律和交互式特异化理论的观点, 从神经系统不同层级的信息加工机制出发, 依靠更为底层的基于神经元族群的共激活信息编码规则, 考察了多元需求系统在儿童跨情感与认知领域发展中的神经表征基础, 以探讨适合于儿童领域通用性发展的神经表征架构及其发育规律。具体而言, 利用跨情感与认知领域的多层级分布式神经表征建模方法, 我们发现了儿童在多元需求额顶系统中的顶内沟和额眼区域表现为更低的神经表征泛化水平, 即更弱的跨情感与认知领域的神经泛化程度。基于此, 我们推测在儿童脑智发育过程中, 多元需求系统可能作为一个潜在的领域通用性架构, 通过组构性的信息编码加工方式, 来进行不同层级情感与认知功能对应神经表征信息的分离和整合, 从而支持着儿童跨情感与认知领域的一般性发展。
在本研究中, 我们旨在通过多个情感与认知领域下不同任务的神经激活情况, 检查儿童心理发展过程中的多元需求额顶系统基础。儿童接受功能磁共振成像扫描的同时, 执行了3个情感和认知任务, 包括注意网络测试、数字N-Back工作记忆和情绪匹配任务。由于儿童被试均为7~12岁的学生, 头动控制能力相对成人较弱, 因此我们使用了最新的名为fMRIPrep (Esteban et al., 2019, 2020)的预处理工作流程, 能够有效减轻头动和伪影对数据质量的影响, 针对多个情感与认知领域的各年龄组构建一般线性模型检查了儿童和成人在不同条件下的神经共激活。我们发现了多元需求额顶系统(双侧顶内沟和额眼区域)在3组被试中均出现了跨情感与认知领域的神经共激活模式, 另外, 右侧腹侧额叶皮层(ventral frontal cortex, VFC)和左侧前辅助运动区(pre-supplementary motor area, pSMA)也表现出了部分组别的共激活现象, 但未在所有组别出现。后续研究发现, 多元需求额顶系统IPS和FEF存在3个组别的可泛化水平差异, 说明了IPS和FEF存在差异性共激活现象, 通过神经泛化作用支持着多种情感与认知功能的发展成熟。虽然腹侧额叶皮层和前辅助运动区也部分存在共激活现象, 但是一个脑区在多个任务下被激活并不代表该脑区存在神经泛化, 还可能存在其他的神经支持机制, 对于这些机制的探索为我们未来的研究提供了新的思路和方向。这一现象与许多先前的发现是一致的, 比如, Duncan发现多元需求系统的激活与流体智力关系密切, 而流体智力也是许多认知能力的生理基础(Duncan, 2010), 与此同时, 多元需求系统在执行选择性注意、任务切换、反应抑制、冲突监控、新异问题解决等大量的认知任务中均出现了共激活现象(Cole amp; Schneider, 2007; Dosenbach et al., 2006; Duncan amp; Owen, 2000; Fedorenko et al., 2013; Hugdahl et al., 2015)。此外, 随着年龄的增长, 该系统的激活在多种条件下表现出了不同模式(线性或非线性)的发育性变化(Hao et al., 2021), 在一定程度上又说明了该系统的神经计算机制在儿童情感与认知发展中发生着复杂的变化。这些发现进一步说明了, 对儿童跨情感与认知领域发展的神经发育基础的探索, 单纯的检查皮层区域激活的强度无法阐明其中的复杂机制, 需从不同层级的加工机制出发, 依靠更为底层的基于神经元族群的共激活信息编码规则, 最终找出多元需求额顶系统在儿童跨情感与认知领域发展中的影响机制。
通过应用多层级神经表征泛化模型的分析方法, 我们检查了儿童与成人之间不同条件下多变量神经表征模式的发育性差异, 发现了儿童在多元需求额顶系统中表现了更弱的跨情感与认知领域相关的神经泛化水平, 特别是其内部的顶内沟皮层区域最为显著。多元需求额顶系统共同参与着多种情感与认知功能过程(Cole amp; Schneider, 2007; Dosenbach et al., 2006; Duncan amp; Owen, 2000; Fedorenko et al., 2013; Hugdahl et al., 2015), 本研究的结果在注意、工作记忆和情绪任务中印证了这一现象。只有成人在多元需求额顶系统中, 特别是顶内沟皮层区域, 表现出了显著的跨情感与认知领域的神经泛化水平, 此外, 3组被试在多元需求额顶系统中也表现出了显著的发育性差异, 说明了儿童该脑区的组构性信息编码加工机制还未成熟, 在支持不同情感与认知任务时未能执行稳定的差异性共激活模式(Reverberi et al., 2012), 其表现就是虽然在各过程均被激活, 但是却未能对不同层级情感或认知功能相应的神经表征信息进行有效的信息组织。本研究评估了反映多元需求系统中潜在共享结构对不同情感与认知领域的可泛化性, 我们发现了涉及不同神经元群体出现的差异性共激活机制, 该机制可能支撑着多元需求额顶系统对表征信息的分离和整合加工, 并影响着从童年到成年期过程中的情感与认知发展。对于神经泛化的解释可以源自计算神经科学的组构性编码机制与多个认知过程在组织上的分离和整合有关(Yang et al., 2019)。额顶皮层作为多元需求系统的核心节点, 对于多种情感与认知功能的底层神经支持是至关重要的(Duncan, 2010; Miller amp; Cohen, 2001), 这与我们的发现也是一致的。
以往的实证性研究和计算模型研究提出了额顶皮层的组构性编码机制(Cole, Laurent, et al., 2013; Kragel et al., 2018; Yang et al., 2019), 该机制作为一种基础性的神经特质, 支撑着多种高级情感与认知功能的切换, 以适应多样性的外界需求。人脑神经影像学研究还表明, 背外侧前额叶皮层中复杂认知任务的表征也是基于组构性编码支持的(Cole et al., 2011; Reverberi et al., 2012)。基于前人研究中的理论和实证性证据, 表明多元需求额顶系统在多种情感与认知任务的执行中起着关键作用, 可能存在一种不同情感与认知功能的组构性编码机制, 支持着神经信息的组织和协调以适应多种任务需求。基于本研究的发现, 我们推断, 多元需求额顶系统在促进从儿童到成年期的情感与认知功能的高度整合和成熟中起到了重要作用。此外, 我们还建立了神经元族群差异性共激活与组构性编码机制之间的联系, 作为一种潜在的机制来支持跨情感与认知领域的整合性发展。神经泛化过程是儿童跨情感与认知领域发展的基础架构, 支持发育过程中多种情感与认知功能的增强和完善, 或许也作为通用性的机制支持着学习泛化能力的产生与发展。
5 "结论
本研究通过融合多种情感与认知任务范式, 以大样本的7~12岁正常发育的学龄儿童和18~22岁健康成人为主要研究对象, 结合发展心理学、认知行为实验、无创功能性磁共振成像以及层级化的多体素神经表征建模等跨学科技术手段和方法, 基于交互式特异化理论模型和多元需求额顶系统理论通用性建构的研究背景, 系统考察了儿童跨情感与认知领域发展的层级化分布式神经表征发育基础。本研究推论:多元需求额顶系统通过神经元群体共激活的组构性编码机制, 影响着儿童跨情感与认知领域的发展, 这可能是儿童脑智发育的基本特征。本研究突破了现有儿童认知发展的交互式特异化理论模型, 为发展认知神经科学领域有关脑智发育机理的解析, 提供了来自功能性影像学和发展心理学方面的新证据, 并帮助促进提高基础教育质量水平和启发基于脑智发育的人工智能新型算法和理论模型。
本研究促进了我们对儿童跨情感与认知领域发展规律的理解, 然而, 目前的研究还存在着一些局限性:例如, 本研究仅采用了3种情感与认知领域的6个过程, 未来的研究应该纳入更多的情感与认知条件来验证本研究的假设, 探索实验结论是否普适于更多的领域。由于各情感与认知任务的设计不同, 存在regressor、contrast数量不一致的情况, 这对统计检验力和本研究中重要结果是否存在影响是值得商榷的, 需要后续改进实验设计来验证此问题。此外, 本研究使用了多个情感与认知任务, 并非是在一次任务中进行了多个情感与认知过程, 因此, 本研究并不能说明多元需求额顶系统的泛化发育能够更好地支持认知灵活切换。由于本研究的分析时基于组水平的结果, 尽管通过bootstrapping可以得到显著性, 但并不能得到每个个体的泛化水平的指标, 这限制了它作为客观生物标记的可能性。最后, 我们考察了儿童跨情感与认知领域的分布式神经表征发育基础, 然而目前的无创脑功能成像技术的时空分辨率有限, 仍然无法完全表征精确的神经元激活, 亟待新的技术革新和更优化的研究设计来解决这个问题。
参""考""文""献
Adolphs, R. (2002). Neural systems for recognizing emotion. Current Opinion in Neurobiology, 12(2), 169−177.
Atkinson, J. (1984). Human visual development over the first 6 months of life. A review and a hypothesis. Human Neurobiology, 3(2), 61−74.
Barbey, A. K., Koenigs, M., amp; Grafman, J. (2013). Dorsolateral"prefrontal contributions to human working memory. Cortex, 49(5), 1195−1205.
Baum, G. L., Ciric, R., Roalf, D. R., Betzel, R. F., Moore, T. M., Shinohara, R. T., ... Satterthwaite, T. D. (2017). Modular segregation of structural brain networks supports the development of executive function in youth. Current Biology, 27(11), 1561−1572.
Baum, G. L., Cui, Z., Roalf, D. R., Ciric, R., Betzel, R. F., Larsen, B., ... Satterthwaite, T. D. (2020). Development of structure−function coupling in human brain networks during youth. Proceedings of the National Academy of Sciences, 117(1), 771−778.
Behzadi, Y., Restom, K., Liau, J., amp; Liu, T. T. (2007). A component based noise correction method (CompCor) for BOLD and perfusion based fMRI. Neuroimage, 37(1), 90−101.
Camilleri, J. A., Müller, V. I., Fox, P., Laird, A. R., Hoffstaedter, F., Kalenscher, T., amp; Eickhoff, S. B. (2018). Definition and characterization of an extended multiple- demand network. Neuroimage, 165, 138−147.
Cole, M. W., Etzel, J. A., Zacks, J. M., Schneider, W., amp; Braver, T. S. (2011). Rapid transfer of abstract rules to novel contexts in human lateral prefrontal cortex. Frontiers in Human Neuroscience, 5, 142.
Cole, M. W., Laurent, P., amp; Stocco, A. (2013). Rapid instructed task learning: A new window into the human brain’s unique capacity for flexible cognitive control. Cognitive, Affective, amp;behavioral Neuroscience, 13(1), 1−22.
Cole, M. W., Reynolds, J. R., Power, J. D., Repovs, G., Anticevic, A., amp; Braver, T. S. (2013). Multi-task connectivity reveals flexible hubs for adaptive task control. Nature Neuroscience, 16(9), 1348−1355.
Cole, M. W., amp; Schneider, W. (2007). The cognitive control network: Integrated cortical regions with dissociable functions. Neuroimage, 37(1), 343−360.
Cox, R. W., amp; Hyde, J. S. (1997). Software tools for analysis and visualization of fMRI data. NMR in Biomedicine, 10(4‐5), 171−178.
Diamond, A., amp; Goldman-Rakic, P. S. (1989). Comparison of human infants and rhesus monkeys on Piaget’s AB task: Evidence for dependence on dorsolateral prefrontal cortex. Experimental Brain Research, 74(1), 24−40.
Dosenbach, N. U., Visscher, K. M., Palmer, E. D., Miezin, F. M., Wenger, K. K., Kang, H. C., ... Petersen, S. E. (2006). A core system for the implementation of task sets. Neuron, 50(5), 799−812.
Duncan, J. (2010). The multiple-demand (MD) system of the primate brain: Mental programs for intelligent behaviour. Trends in Cognitive Sciences, 14(4), 172−179.
Duncan, J. (2013). The structure of cognition: Attentional episodes in mind and brain. Neuron, 80(1), 35−50.
Duncan, J., amp; Owen, A. M. (2000). Common regions of the human frontal lobe recruited by diverse cognitive demands. Trends in Neurosciences, 23(10), 475−483.
Esteban, O., Ciric, R., Finc, K., Blair, R. W., Markiewicz, C. J., Moodie, C. A., ... Gorgolewski, K. J. (2020). Analysis of task-based functional MRI data preprocessed with fMRIPrep. Nature Protocols, 15(7), 2186−2202.
Esteban, O., Markiewicz, C. J., Blair, R. W., Moodie, C. A., Isik, A. I., Erramuzpe, A., ... Gorgolewski, K. J. (2019). fMRIPrep: A robust preprocessing pipeline for functional MRI. Nature Methods, 16(1), 111−116.
Fair, D. A., Cohen, A. L., Power, J. D., Dosenbach, N. U., Church, J. A., Miezin, F. M., Schlaggar, B. L., amp; Petersen, S. E. (2009). Functional brain networks develop from a “local to distributed” organization. PLoS Computational Biology, 5(5), e1000381.
Fedorenko, E., Duncan, J., amp; Kanwisher, N. (2013). Broad domain generality in focal regions of frontal and parietal cortex. Proceedings of the National Academy of Sciences, 110(41), 16616−16621.
Filipek, P. A. (1999). Neuroimaging in the developmental disorders: The state of the science. The Journal of Child Psychology and Psychiatry and Allied Disciplines, 40(1), 113−128.
Friston, K. J., amp; Price, C. J. (2001). Dynamic representations and generative models of brain function. Brain Research Bulletin, 54(3), 275−285.
Gazzaniga, M. S. (2004). The cognitive neurosciences. MIT Press.
Gee, D. G., Humphreys, K. L., Flannery, J., Goff, B., Telzer, E. H., Shapiro, M., ... Tottenham, N. (2013). A developmental shift from positive to negative connectivity in human amygdala−prefrontal circuitry. Journal of Neuroscience, 33(10), 4584−4593.
Glasser, M. F., Sotiropoulos, S. N., Wilson, J. A., Coalson, T. S., Fischl, B., Andersson, J. L., ... Polimeni, J. R. (2013). The minimal preprocessing pipelines for the Human Connectome Project. Neuroimage, 80, 105−124.
Gorgolewski, K., Burns, C. D., Madison, C., Clark, D., Halchenko, Y. O., Waskom, M. L., amp; Ghosh, S. S. (2011). Nipype: A flexible, lightweight and extensible neuroimaging"data processing framework in python. Frontiers in Neuroinformatics, 5, 13.
Greve, D. N., amp; Fischl, B. (2009). Accurate and robust brain image alignment using boundary-based registration. Neuroimage, 48(1), 63−72.
Hao, L., Li, L., Chen, M., Xu, J., Jiang, M., Wang, Y., ... Qin, S. (2021). Mapping domain-and age-specific functional brain activity for children’s cognitive and affective development. Neuroscience Bulletin, 37(6), 763−776.
Hao, L., Peng, S., Zhou, Y., Chen, X., Qiu, J., Luo, W., ... Qin, S. Z. (2024). Neural specialization with generalizable representations underlies children’s cognitive development of attention. American Psychologist, doi: 10.1037/amp0001283.
Hugdahl, K., Raichle, M. E., Mitra, A., amp; Specht, K. (2015). On the existence of a generalized non-specific task- dependent network. Frontiers in Human Neuroscience, 9, 430.
Jenkinson, M., Bannister, P., Brady, M., amp; Smith, S. (2002). Improved optimization for the robust and accurate linear registration and motion correction of brain images. Neuroimage, 17(2), 825−841.
Jenkinson, M., amp; Smith, S. (2001). A global optimisation method for robust affine registration of brain images. Medical Image Analysis, 5(2), 143−156.
Johnson, M. H. (1990). Cortical maturation and the development"of visual attention in early infancy. Journal of Cognitive Neuroscience, 2(2), 81−95.
Johnson, M. H. (2000). Functional brain development in infants: Elements of an interactive specialization framework."Child Development, 71(1), 75−81.
Johnson, M. H. (2001). Functional brain development in humans. Nature Reviews Neuroscience, 2(7), 475−483.
Johnson, M. H. (2011). Interactive specialization: A domain- general framework for human functional brain development? Developmental Cognitive Neuroscience, 1(1), 7−21.
Kanwisher, N. (2010). Functional specificity in the human brain: A window into the functional architecture of the mind. Proceedings of the National Academy of Sciences, 107(25), 11163−11170.
Kanwisher, N., McDermott, J., amp; Chun, M. M. (1997). The fusiform face area: A module in human extrastriate cortex specialized for face perception. Journal of Neuroscience, 17(11), 4302−4311.
Kragel, P. A., Kano, M., Van Oudenhove, L., Ly, H. G., Dupont, P., Rubio, A., ... Wager, T. D. (2018). Generalizable representations of pain, cognitive control, and negative emotion in medial frontal cortex. Nature Neuroscience, 21(2), 283−289.
Lanczos, C. (1964). Evaluation of noisy data. Journal of the Society for Industrial and Applied Mathematics, Series B: Numerical Analysis, 1(1), 76−85.
Miller, E. K., amp; Cohen, J. D. (2001). An integrative theory of prefrontal cortex function. Annual Review of Neuroscience, 24(1), 167−202.
Missana, M., amp; Grossmann, T. (2015). Infants’ emerging sensitivity to emotional body expressions: Insights from asymmetrical frontal brain activity. Developmental Psychology,"51(2), 151−160.
Morton, J., amp; Frith, U. (1995). Causal modeling: A structural approach to developmental psychopathology."In D. Cicchetti"amp; D. J. Cohen (Eds.), Developmental psychopathology, Vol. 1. Theory and methods"(pp. 357–390). John Wiley amp; Sons.
Paus, T. (2005). Mapping brain maturation and cognitive development during adolescence. Trends in Cognitive Sciences, 9(2), 60−68.
Petersen, S. E., amp; Posner, M. I. (2012). The attention system of the human brain: 20 years after. Annual Review of Neuroscience, 35(1), 73−89. https://doi.org/10.1146/annurev-"neuro-062111-150525
Power, J. D., Mitra, A., Laumann, T. O., Snyder, A. Z., Schlaggar, B. L., amp; Petersen, S. E. (2014). Methods to detect, characterize, and remove motion artifact in resting state fMRI. Neuroimage, 84, 320−341.
Pruim, R. H., Mennes, M., van Rooij, D., Llera, A., Buitelaar, J. K., amp; Beckmann, C. F. (2015). ICA-AROMA: A robust ICA-based strategy for removing motion artifacts from fMRI data. Neuroimage, 112, 267−277.
Qin, S., Cho, S., Chen, T., Rosenberg-Lee, M., Geary, D. C., amp; Menon, V. (2014). Hippocampal-neocortical functional reorganization underlies children’s cognitive development. Nature Neuroscience, 17(9), 1263−1269.
Qin, S., Young, C. B., Supekar, K., Uddin, L. Q., amp; Menon, V. (2012). Immature integration and segregation of emotion- related brain circuitry in young children. Proceedings of the National Academy of Sciences, 109(20), 7941−7946.
Reverberi, C., Görgen, K., amp; Haynes, J. -D. (2012). Compositionality"of rule representations in human prefrontal cortex. Cerebral Cortex, 22(6), 1237−1246.
Richards, J. E. (2001). Cortical indexes of saccade planning in infants. Infancy, 2(2), 123−133.
Rumsey, J. M., amp; Ernst, M. (2000). Functional neuroimaging of autistic disorders. Mental Retardation and Developmental"Disabilities Research Reviews, 6(3), 171−179.
Sakai, K. (2008). Task set and prefrontal cortex. Annual Review of Neuroscience, 31, 219−245.
Schiller, P. H. (1996). On the specificity of neurons and visual areas. Behavioural Brain Research, 76(1−2), 21−35.
Stuss, D. T., amp; Knight, R. T. (2013). Principles of frontal lobe function. Oxford University Press, USA.
Sugiura, M., Katayori, Y., Muratsubaki, T., Shiratori, M., Hanawa, S., Nejad, K. K., ... Fukudo, S. (2023). Automatic adaptive emotion regulation is associated with lower emotion-related activation in the frontoparietal cortex and other cortical regions with multi-componential organization. Frontiers in Behavioral Neuroscience, 17, 1059158.
Toga, A. W., Thompson, P. M., amp; Sowell, E. R. (2006). Mapping brain maturation. Trends in Neurosciences, 29(3), 148−159.
Tschentscher, N., Mitchell, D., amp; Duncan, J. (2017). Fluid intelligence predicts novel rule implementation in a distributed frontoparietal control network. Journal of Neuroscience, 37(18), 4841−4847.
Uddin, L. Q., Nomi, J. S., Hébert-Seropian, B., Ghaziri, J., amp; Boucher, O. (2017). Structure and function of the human insula. Journal of Clinical Neurophysiology, 34(4), 300−306.
Wallis, J. D., Anderson, K. C., amp; Miller, E. K. (2001). Single neurons in prefrontal cortex encode abstract rules. Nature, 411(6840), 953−956.
Yang, G. R., Joglekar, M. R., Song, H. F., Newsome, W. T., amp; Wang, X. -J. (2019). Task representations in neural networks trained to perform many cognitive tasks. Nature Neuroscience, 22(2), 297−306.
Zhang, Y., Padmanabhan, A., Gross, J. J., amp; Menon, V. (2019). Development of human emotion circuits investigated using a big-data analytic approach: Stability, reliability, and robustness. Journal of Neuroscience, 39(36), 7155−7172.
Developmental differences in generalizable neural representations driven by multiple emotional and cognitive tasks
HAO Lei1,2, XU Tianwei3, ZHOU Wenlong3, YANG Jie3, PENG Siya2, LIU Minglan4, XU Jiahua5,WANG Yanpei2, TAN Shuping5, GAO Jiahong6, HE Yong2, TAO Sha2, DONG Qi2, QIN Shaozheng2
(1"College of Teacher Education, Southwest University, Chongqing 400715,"China) (2"State Key Laboratory of Cognitive Neuroscience and Learning amp; IDG/McGovern Institute for Brain Research, Beijing Normal University, Beijing 100875, China)(3"Qiongtai Normal University Key Laboratory of Child Cognition amp; Behavior Development of Hainan Province, Haikou 571127, China) (4"Beibei Teacher Training College, Chongqing 400700, China) (5"Beijing HuiLongGuan Hospital, Peking University, Beijing 100096,"China) (6"Center for MRI Research, Academy for Advanced Interdisciplinary Studies amp; McGovern Institute for Brain Research, Peking University, Beijing 100871, China)
Abstract
From the perspective of development, childhood is one of the most critical stage during brain development: neural system and cognitive"behavior undergo a prolonged and intricate developmental process. A central question in developmental cognitive neuroscience pertains to how our brain develop highly specialized yet interacting neural modules to support a wide spectrum of cognitive and emotional functions. It is still inconclusive how these neural systems interplay and work together to promote cognitive and emotional maturation.
The early maturational perspective believed that as the anatomical structure of a specific cortical area matures, each neural module will “perform their duties” to support the development of corresponding cognitive functions. Later, the interactive specialization theory argued that there is a special brain function module with the properties of a general"developmental architecture to support the development of different cognitive abilities, which can co-activate in multiple neurobiological models. Recently, researchers proposed a multi-demand system model, where the frontal-parietal network system supports various cognitive functions through diverse neural activation modes, fostering cognitive flexibility, and playing a role in coordinating and integrating different levels of neural computing resources across cognitive domains during children’s brain development. Based on the interactive specialization and multi-demand system model, the present study put forward the scientific questions: whether the multi-demand frontal-parietal system have a general neural representation pattern under different cognitive subdomain tasks, and how this pattern supports the development of children’s multiple cognitive domains through a hierarchical distributed neural representation organization.
Integrating traditional developmental psychology with non-invasive functional magnetic resonance imaging in cognitive neuroscience, we used multiple task paradigm (attention network test, numerical N-Back working memory and emotion matching tasks) across cognitive domains and innovative hierarchical distributed neural representation modeling to explore a general neural representation framework and its developmental rules for multiple cognitive domains. By building hierarchical distributed neural representation modeling method across multiple cognitive domains, we systematically investigate the developmental patterns of neural information representation in children and adults. The results indicated that both children and adults exhibited the phenomenon of the multiple-demand frontoparietal system (including the intraparietal sulcus and frontal eye area) jointly participating in a variety of emotional and cognitive tasks, that is, co-activation across tasks; it is worth emphasizing that the multiple-demand frontoparietal system in children showed lower levels of generalizability of neural representations across tasks, whereas the anterior cingulate gyrus, dorsolateral prefrontal cortex, and anterior insula, which were used as control analyses, did not show differences in generalizability between the groups.
We speculate that the multi-demand frontoparietal system may serve as a potential universal “hub” during development. Through compositional information coding organization, it can enable hierarchical neural representation and computation driven by different task goals, thereby supports the development of emotional and cognitive functions"with age. This study breaks through the current research framework of developmental cognitive neuroscience from the perspective of a single-task paradigm and is expected to provide new insights into the working principles of brain development across emotional and cognitive domains, as well as to inspire the new artificial intelligence algorithms.
Keywords "emotion and cognition, cognitive and brain development, specialization, neural representation, generalization

