(2-乙基己基胺基)甲基膦酸单-2-乙基己基酯浸渍树脂对钪的选择性吸附及应用
摘要 将(2-乙基己基胺基)甲基膦酸单-2-乙基己基酯(HEHAMP,H2L2)浸渍到大孔树脂Pre-XAD-16上制得了浸渍树脂(SIRs-HEHAMP),研究了在硫酸介质中SIRs-HEHAMP对钪的吸附性能,考察了反应时间、溶液酸度、硫酸氢根离子浓度、树脂用量以及温度等因素对钪吸附的影响,发现SIRs-HEHAMP浸渍树脂对Sc3+的吸附量随着反应时间的增加而逐渐增大; 在高酸度范围下,SIRs-HEHAMP浸渍树脂对Sc3+的吸附率随着酸度的增大而略有降低,而在pH值范围内对Sc3+的吸附率几乎没有影响; 在吸附过程中硫酸氢根没有参与配位;温度对Sc3+的吸附几乎没有影响; SIRs-HEHAMP吸附Sc3+的过程符合准二级动力学模型; 测定了浸渍树脂对钪的饱和负载量(以Sc2O3计)为36. 29 mg/g,并对SIRs-HEHAMP浸渍树脂、HEHAMP萃取剂以及支撑基质Pre-XAD-16进行了红外光谱与TG-DSC表征,结果表明,HEHAMP成功浸渍到支撑基质Pre-XAD-16上。 将SIRs-HEHAMP浸渍树脂用于从模拟赤泥浸出液中吸附和分离钪。 Sc3+的吸附率为51. 71%,TiO2+吸附率为42. 50%,几乎不吸附Al3+,Fe3+和稀土离子吸附率均在20%以下,Sc/Ti分离系数为1. 45; 加入质量分数为6%的H2O2时,SIRs-HEHAMP浸渍树脂对Sc3+吸附率提升到63. 17%,TiO2+和Fe3+的吸附率下降,其余金属离子基本不吸附,Sc/Ti分离系数提高至6. 94,表明该浸渍树脂可以应用于从赤泥浸出液中分离回收钪。
关键词 (2-乙基己基胺基)甲基膦酸单-2-乙基己基酯;钪;浸渍树脂;吸附;分离
中图分类号:O658. 1 文献标识码:A 文章编号:1000-0518(2025)01-0095-12
国家自然科学基金(No. 92262301)资助
钪(Sc)及其化合物在合金、电化学、生物发酵以及催化等方面有着广泛的应用。 例如,将Sc加入到铝合金中能提高合金的强度和耐热性[1-2],在镁合金中加入钪能提高合金的抗腐蚀性[3]; 在钛酸盐型固体氧化物电解池(SOEC)的阴极材料中掺杂钪可提高电极对CO2的选择性[4]; 在微生物发酵过程中加入钪提高微生物的代谢能力[5]; 三氟甲磺酸钪(Sc(OTf)3)能增强反应的对映选择性[6]。 地壳中Sc的质量分数为0. 0022%,排第34位,但钪在地壳中分布极为分散,以钪为主要成分的矿石(如钪钇矿、水磷钪石等)含量稀少,难以满足工业需求[7]。通常Sc以副产物的形式回收,主要来源有赤泥[8]、钛白废酸[9]、钨废渣[10]和离子吸附矿[11]等,回收流程一般是先萃取富集,随后对粗产物进行提纯,从而得到高纯钪产品。
溶剂萃取法因具有处理量大、可连续操作等优势而获得了广泛的应用。 Le等[12]使用(2-乙基己基)胺基甲基膦酸二(2-乙基己基)酯(Cextrant230)萃取分离金属离子的顺序为: Ti4+>Sc3+>Fe3+>Al3+>Cu2+>Mg2+,经过1级萃取后萃余液中Sc3+质量浓度从3. 57 mg/L降低至0. 3 mg/L,再经过1级乙二胺四乙酸二钠(EDTA·2Na)反萃、草酸沉淀和灼烧,成功制得了纯度为94%的Sc2O3。 Peng等[13]选用N,N,N′,N’-四环已基二甘酰胺(TCHGDA)萃取Sc3+,以1 mol/L的HNO3溶液洗涤,随后用草酸进行反萃,经沉淀、灼烧之后,成功将粗Sc2O3(纯度≥95%)提纯至99. 99%,但因Sc3+强烈水合作用,TCHGDA萃取Sc3+平衡时间接近40 min。 Zhang等[14]通过模拟离子吸附型矿的盐酸浸出液,采用2-(乙基己基)膦酸-单-(2-乙基己基)酯(HEHEHP)回收Sc3+,发现HEHEHP对Y3+、La3+等金属离子几乎没有萃取,在363 K下5 mol/L NaOH对Sc3+的反萃率为92. 1%。 Salman等[15]采用二(2-乙基己基)磷酸(D2EHPA)萃取分离赤泥盐酸浸出液中的Sc3+时发现相比对Sc3+和Ti4+萃取率影响较大,在65 ℃下2. 5 mol/L NaOH对Sc3+的反萃率为95%。
萃取色层法是将溶剂萃取的选择性和离子交换的高效性相结合[16],同时可避免萃取剂损失以及分相差的问题。 其中浸渍型树脂具有制备简单、效率高、载体与萃取剂种类可任意搭配等优点[17]。 Bao等[18]将酸性萃取剂二(2,4,4-三甲基戊基)膦酸(Cyanex 272)浸渍制得TP-272浸渍树脂,应用于在硫酸介质中吸附Sc3+。当初始pH=2. 5,Sc3+质量浓度为50 mg/L时,TP-272浸渍树脂吸附Sc3+需12 h达到吸附平衡,吸附符合Langmuir模型,对Sc3+的饱和吸附容量为11. 09 mg/g。 Yu等[19]将TRPO(Cyanex 923,三烷基氧化膦)浸渍在支撑基底SiO2-P上制得了TRPO/SiO2-P浸渍树脂,探究了硫酸介质中Sc3+的吸附性能。浸渍树脂吸附Sc3+达到平衡的时间为2 h,静态吸附容量13. 3 mg/g。 未加入H2O2时,Sc/Ti分离系数>98,加入质量分数为0. 2%的H2O2之后,Sc/Ti分离系数>1166。 在动态柱分离实验中混合溶液里Al3+、Sc3+、Fe3+、Ce3+、La3+和Ti4+浓度均为2 mmol/L时,树脂对Sc3+有较强的选择性,pH=2的硫酸溶液能解吸完全。Adonis等[20]将D2EHPA浸渍至苯乙烯系非离子型大孔吸附树脂Amberlite-XAD-4上,制得了萃取剂同树脂质量比为11. 5∶1(即萃取剂质量分数为92%)的浸渍树脂D2EHPA-XAD-4,研究了硫酸介质中Sc3+的吸附行为,发现浸渍树脂吸附Sc3+达到平衡的时间为2 h,符合Langmuir模型,吸附动力学模型为准二级动力学模型,并测得吸附容量为0. 05 mg/g。 Zhang等[21]先采用光刻技术制备微柱阵列基底,随后加入十八烷基三氯硅烷(OTS)以降低其表面能,最后将萃取剂Cyanex 272浸渍至基底表面的纹路中,制得了新型二维吸附材料EIS。 该材料对赤泥浸出液中Sc3+的最大吸附率为96. 6%,进行了10次吸附解吸循环后,该材料对Sc3+的吸附率仍保持在95%以上。
Zhao等[22]成功制备了新型酸性含氮有机磷萃取剂(2-乙基己氨基)甲基膦酸单-2-乙基己基酯(HEHAMP),发现在盐酸介质中钪更容易被萃取,Sc和稀土之间表现出较好的分离效果。 随着水相酸度增加稀土离子萃取率明显降低(除了钪),HEHAMP的酸度曲线趋势与其他酸性磷类萃取剂相似。 通常二次资源中钪的含量较低,采用溶剂萃取法回收钪的萃取剂损耗大、回收效率低,还存在界面现象差,如分相困难、产生第三相等问题。 针对上述限制,结合浸渍树脂的优势,将萃取剂HEHAMP固定至经预处理的大孔苯乙烯系树脂Pre-XAD-16上制得了溶剂浸渍型树脂SIRs-HEHAMP(Solvent impregnated resins),研究其在硫酸介质中对Sc3+的吸附行为以及从模拟赤泥浸出液中分离回收钪,为钪的分离提供一种新途径。
1 实验部分
1. 1 仪器和试剂
PerkinElmer Optima8000型电感耦合等离子体发射光谱仪(ICP-OES,美国珀金埃尔默公司)用于测定溶液中Sc3+浓度和SIRs-HEHAMP浸渍树脂经硝酸消解后树脂中的磷含量;Bruker Vector 22/N型傅里叶红外变换光谱仪(FT-IR,瑞士布鲁克公司)用于吸附钪前后的浸渍树脂、萃取剂HEHAMP以及树脂Pre-XAD-16的分析。 Netzsch STA 449F3型热重-差示量热扫描仪(TG-DSC,德国耐驰公司)用于测定Pre-XAD-16、HEHAMP以及SIRs-HEHAMP浸渍树脂的分解温度。
XAD-16大孔吸附树脂(250~850 μm)、Sc2O3(≥99. 9%)、La2O3(≥99. 9%)、Gd2O3(≥99. 9%)、Yb2O3(≥99. 9%)和Y2O3(≥99. 9%)均购自阿拉丁生化科技有限公司。 硫酸(分析纯)、丙酮(分析纯)和无水乙醇(分析纯)均购自广东西陇化工有限公司,EDTA·2Na(乙二胺四乙酸二钠,分析纯)、KHSO4(分析纯)和Fe2(SO4)3(分析纯)购自天津光复科技发展有限公司,Al2(SO4)3·18H2O(分析纯)、MgSO4(分析纯)和二甲酚橙(分析纯)购自北京化工厂,CaSO4·2H2O(化学纯)购自国药集团有限公司,硫酸氧钛-硫酸水合物(TiOSO4·xH2SO4·xH2O,纯度≥93%)购自麦克林试剂有限公司。 除特别说明外,所有试剂均为市售分析纯。 HEHAMP参照文献[22]制备。
1. 2 实验部分
1. 2. 1 金属离子储备液制备
将Sc2O3和稀土氧化物分别加入一定量硫酸加热溶解,过滤冷却,用去离子水定容,得到Sc3+和单一稀土离子储备溶液。 用乙二胺四乙酸二钠(EDTA·2Na)标准溶液滴定储备液中离子浓度,二甲酚橙为指示剂,使用时稀释到所需浓度。 以质量分数5%的中性草酸钾溶液掩蔽溶液中金属离子,NaOH标准溶液滴定溶液酸度。 将TiOSO4·xH2SO4·xH2O溶于40 ℃热水中得到TiO2+储备液,使用时以去离子水稀释到所需浓度,以ICP-OES测定金属离子浓度。 以质量分数5%的中性草酸钾和质量分数为5%的中性柠檬酸钠混合溶液掩蔽混合溶液中的金属离子,NaOH标准溶液滴定溶液酸度。
1. 2. 2 XAD-16的预处理
XAD-16参考文献[17]进行预处理。 称取一定量的XAD-16树脂,无水乙醇浸泡16 h使之充分溶胀,加入2 mol/L盐酸浸泡4 h,过滤,以去离子水洗涤,直至滤液中无Cl-。 最后,以无水乙醇洗涤3次,于室温下干燥。 预处理后的树脂表示为Pre-XAD-16。
1. 2. 3 SIRs-HEHAMP浸渍树脂的制备
将一定量的HEHAMP溶于丙酮(V(HEHAMP)∶V(丙酮)=1∶20)中,加入一定量的Pre-XAD-16树脂,制备3种不同比例的树脂SIRs-1、SIRs-2以及SIRs-3(萃取剂的物质的量同基质Pre-XAD-16的质量比例分别为0. 2、0. 5和1 mmol/g)。 室温静置24 h,于30 ℃减压蒸馏,室温静置12 h。 除特别说明外,文中所提及的SIRs-HEHAMP浸渍树脂为SIRs-3浸渍树脂。
1. 2. 4 吸附实验

1. 2. 5 硫酸氢根离子浓度对Sc3+吸附的影响实验
称取(100±1) mg SIRs-HEHAMP浸渍树脂,保持水相中Sc3+浓度为0. 005 mol/L,pH值为2,改变水相中硫酸氢根离子浓度(0. 01~1. 5 mol/L),在(303. 15±1) K条件下振荡60 min,测定吸附前后水相中Sc3+浓度,计算SIRs-HEHAMP浸渍树脂对Sc3+的吸附率。
2 结果与讨论
2. 1 吸附时间对SIRs-HEHAMP浸渍树脂吸附Sc3+的影响
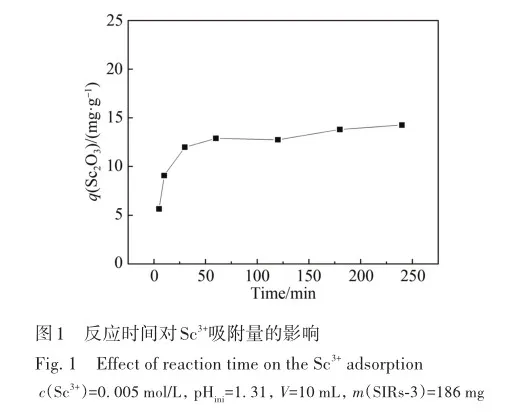
吸附平衡时间是评价吸附材料性质的重要指标之一。 为了研究时间对Sc吸附的影响,将一定量的浸渍树脂与Sc3+溶液混合,分别振荡5、10、30、60、120、180和240 min,测定吸附前后Sc3+离子的摩尔浓度(图1),计算吸附量(以氧化物计)。 由图1可见,在起始pH(pHini)=1. 31,溶液体积为10 mL的条件下,吸附量随着反应时间的增加而逐渐增大,当反应时间由0 min增加至60 min时,吸附量由5. 64 mg/g急剧增加到12. 90 mg/g; 当反应时间大于60 min后,浸渍树脂对Sc3+的吸附增长趋于平缓。 当t=240 min时,树脂的吸附量达到14. 26 mg/g。综合考虑,后续实验反应时间选为60 min。
2. 2 溶液酸度和硫酸氢根离子浓度对SIRs-HEHAMP浸渍树脂吸附Sc3+的影响
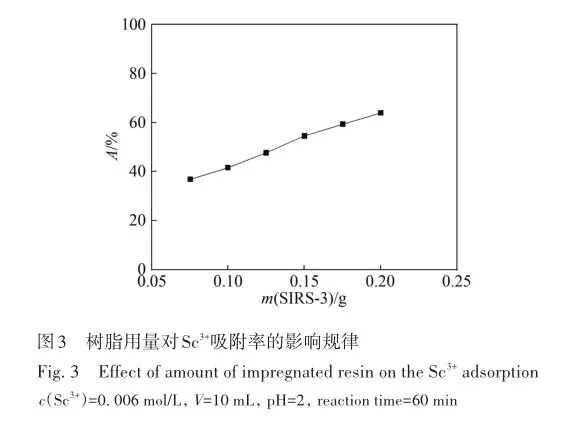
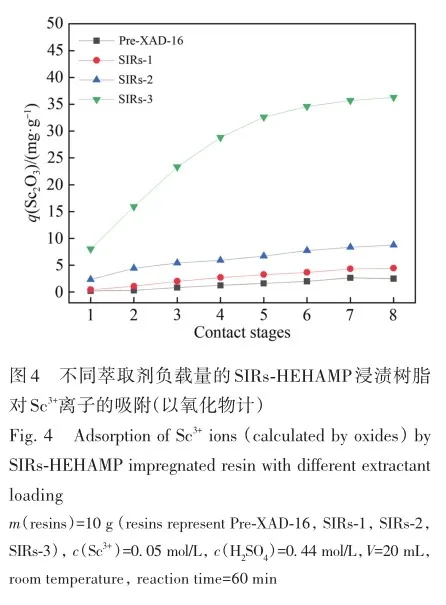
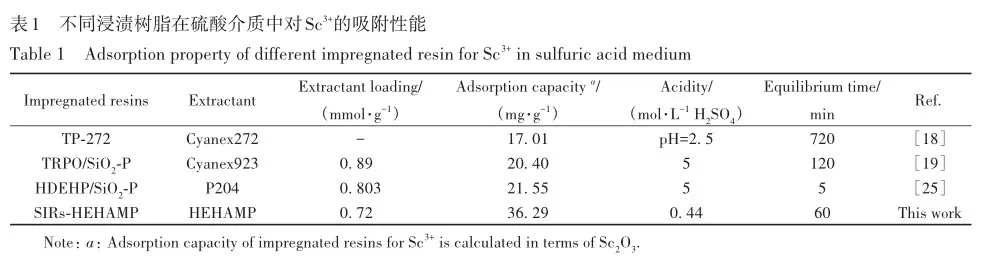
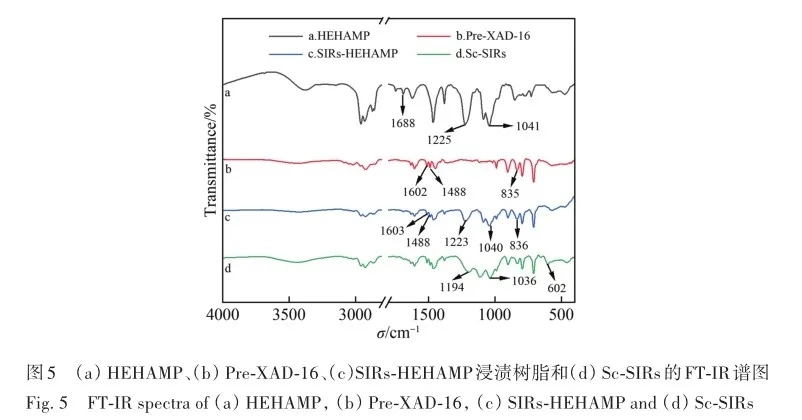
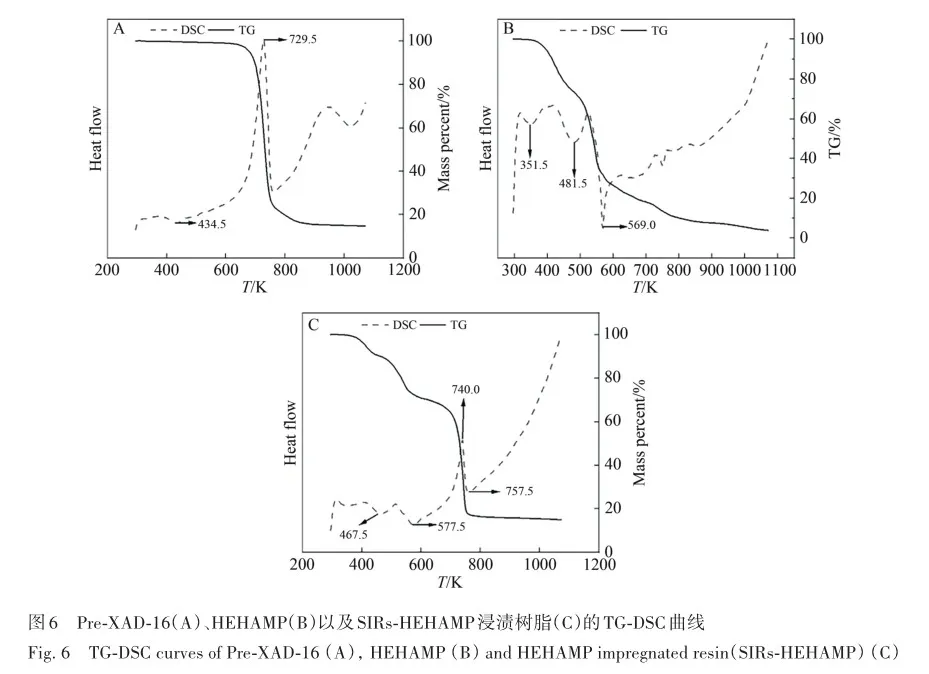
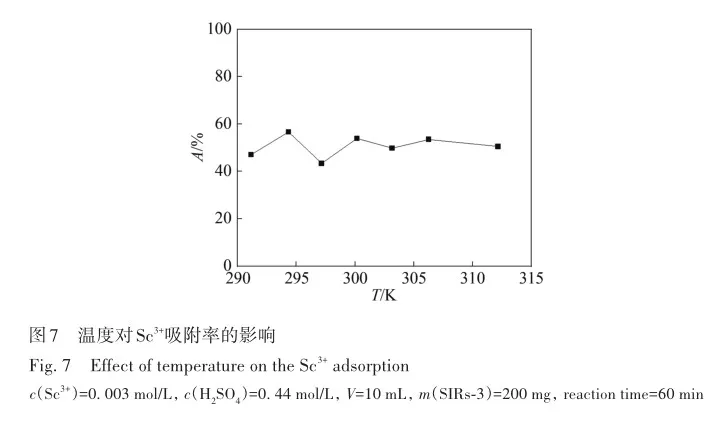
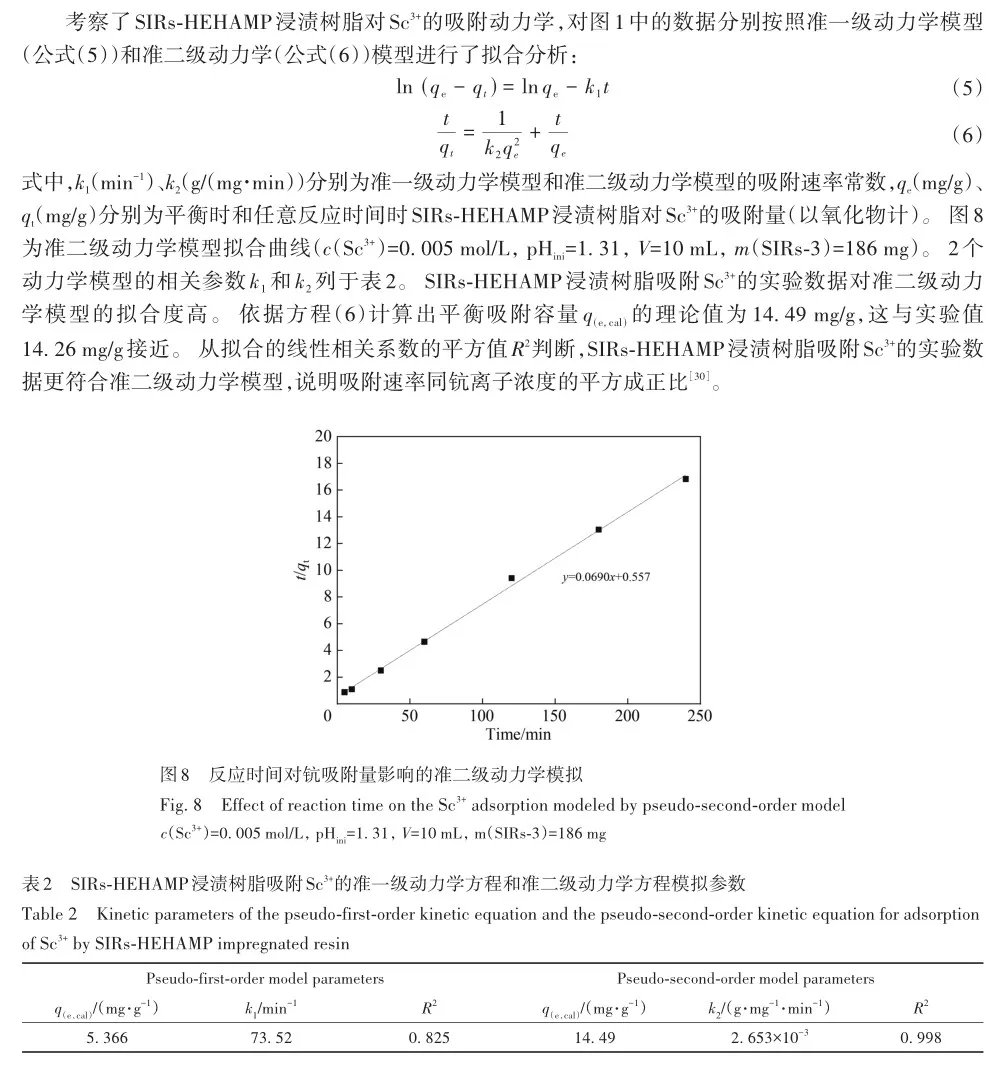
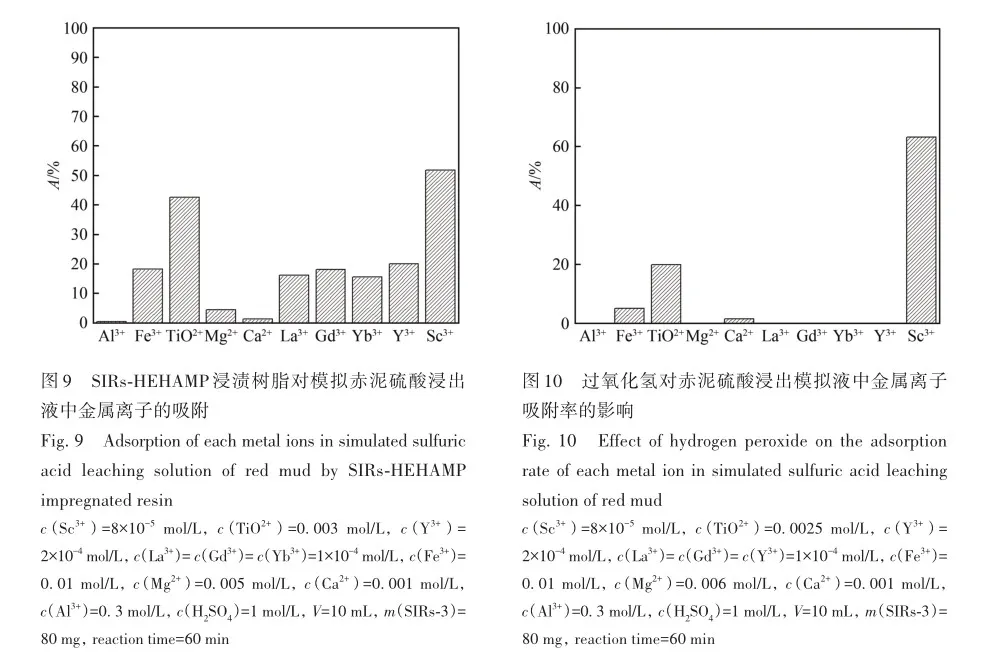
考察了溶液酸度、硫酸氢根离子浓度对SIRs-HEHAMP浸渍树脂吸附Sc3+的吸附率的影响,并与溶剂萃取法中水相pH值对Sc3+萃取率的影响相比较,如图2所示。 从图2A可以看出,在高酸范围下随着硫酸浓度的增大,SIRs-HEHAMP浸渍树脂对Sc3+吸附率略有降低; 由图2B可知,在0. 5 2. 3 树脂用量对SIRs-HEHAMP浸渍树脂吸附Sc3+的影响 浸渍树脂经硝酸消解后,测得树脂中磷的质量分数为2. 245%,由于1个HEHAMP分子中含有1个磷原子,支撑基质Pre-XAD-16为苯乙烯-二乙烯苯的交联共聚物[24]而不含磷元素,因此根据磷元素的质量分数和磷的摩尔质量(30. 97 g/mol)计算可得HEHAMP负载量为0. 72 mmol/g,而根据萃取剂和支撑基质的用量推算出浸渍树脂中萃取剂的理论负载量为0. 75 mmol/g,二者很相近。 保持溶液中初始钪离子浓度和溶液酸度不变,改变树脂用量,即考察浸渍树脂中萃取剂物质的量的改变对钪吸附的影响。由图3可知,随着树脂用量的增大,SIRs-HEHAMP浸渍树脂对Sc3+吸附率依次升高。 2. 4 饱和吸附量的测定 为了考察浸渍树脂对钪的饱和吸附量,分别合成了不同HEHAMP萃取剂质量分数的浸渍树脂,并进行钪的吸附实验。 发现当萃取剂和Pre-XAD-16基质的比大于1 mmol/g时,SIRs-HEHAMP浸渍树脂分散性变差,出现粘结现象。 同时也测定和比较了空白Pre-XAD-16对Sc3+的吸附。 由图4可知,随着浸渍树脂中萃取剂含量的增加,浸渍树脂对Sc3+的吸附量逐渐增加,经过7次吸附后树脂对Sc3+的吸附量变化趋于平缓。 图4中SIRs-1(萃取剂和基质的比值为0. 2 mmol/g)、SIRs-2(比值为0. 5 mmol/g)以及SIRs-3(比值为1 mmol/g)的最大吸附量(以氧化物计)分别为4. 44、8. 75和36. 29 mg/g,空白树脂对Sc3+的最大吸附量为2. 64 mg/g。 表1为不同浸渍树脂在硫酸介质中对Sc3+的吸附性能,对比了吸附平衡时间、萃取剂的负载量、吸附酸度和Sc3+的吸附容量。 文献中的吸附量以Sc3+计,为方便比较换算成以Sc2O3计。由表1可知,相比其他3种浸渍树脂而言,SIRs-HEHAMP浸渍树脂的萃取剂负载量最低,但对Sc3+的吸附容量最大,其吸附酸度低于TRPO/SiO2-P树脂和HDEHP/SiO2-P树脂,其平衡时间远远短于TP-272树脂和TRPO/SiO2-P浸渍树脂。 由于N原子的引入提高了SIRs-HEHAMP浸渍树脂对Sc3+的吸附。 当萃取剂HEHAMP和Pre-XAD-16基质的比例为1 mmol/g时,SIRs-HEHAMP浸渍树脂对Sc3+吸附量达到最大,后续实验选用HEHAMP萃取剂和Pre-XAD-16基质的比值为1 mmol/g。 2. 5 SIRs-HEHAMP浸渍树脂、HEHAMP以及Pre-XAD-16的表征 图5中谱线分别为支撑基质HEHAMP、SIRs-HEHAMP浸渍树脂和Sc-SIRs(表示已饱和吸附钪后的SIRs-HEHAMP浸渍树脂)的红外谱图。 由文献[26-27]可知,在HEHAMP萃取剂的红外光谱(图5谱线a)中的1041、1225和1688 cm-1处分别为P—O—C、P== O的振动吸收峰以及二聚体中氢键的振动吸收。 另据文献[28]可知,图5谱线b的 Pre-XAD-16红外吸收光谱中1602 cm-1处为苯环的骨架振动吸收,1487 cm-1处为C—H的面内弯曲振动吸收,835 cm-1处为对位二取代的苯环的振动吸收。 SIRs-HEHAMP浸渍树脂(图5谱线c)的苯环的骨架振动吸收、C—H的面内弯曲振动吸收和对位二取代的苯环的振动吸收分别对应1603、1488和836 cm-1,红外吸收峰基本没有偏移,结合吸附前后萃取剂和基质的特征峰,表明Pre-XAD-16和萃取剂未发生化学反应,萃取剂同Pre-XAD-16基质以范德华力相结合。 并且图5谱线c中1040和1223 cm-1处分别对应P—O—C、P== O的红外振动吸收峰,1688 cm-1处的红外振动吸收峰几乎消失,说明SIRs-HEHAMP树脂中几乎没有二聚体氢键的振动吸收峰,由此推测出浸渍树脂中HEHAMP主要以单体形式存在。 从Sc-SIRs(图5谱线d)和SIRs-HEHAMP浸渍树脂红外谱图(图5谱线c)可以看出P== O键吸收峰从1223 cm-1红移到1194cm-1处,证明P== O键参与了吸附反应。并且Sc-SIRs红外谱图中在602 cm-1处出现了新的吸收峰,可归因于SO24-的振动吸收[12],表明SO24-参与了吸附反应。 此外,在吸附钪后(图5谱线d),红外光谱中并未检测到650 cm-1处的硫酸氢根离子的吸收峰[12],说明硫酸氢根没有参与吸附反应。 红外表征的结果表明,SIRs-HEHAMP浸渍树脂中HEHAMP与钪的结合可能是钪以硫酸盐的形式与吸附在树脂表面的HEHAMP络合的推测相吻合。 图6中分别为基质Pre-XAD-16 (A)、萃取剂HEHAMP (B)以及SIRs-HEHAMP浸渍树脂(C)的TG-DSC曲线。 图中DSC曲线向下的峰为吸热峰,向上的峰为放热峰。 由图6A可知,在基质Pre-XAD-16的DSC曲线中,434. 5 K 出现了一个很微弱的吸热峰,且此时基质Pre-XAD-16的质量几乎没有变化,因此判断此过程对应着基质Pre-XAD-16的熔化过程。 温度继续升高,在729. 5 K时基质Pre-XAD-16开始分解。由图6B可知,HEHAMP的热重曲线的第1个DSC峰出现在351. 5 K,分解峰较为平缓且萃取剂质量几乎没有损失(此时萃取剂的剩余质量分数为99. 8%),此过程对应着萃取剂HEHAMP的相变过程。 当温度超过351. 5 K时,萃取剂HEHAMP合成过程中生成的少量异辛醇开始分解,481. 5 K的吸热峰对应着异辛醇的分解。 随着温度的继续升高,569. 0 K时HEHAMP发生分解。 由图6C可知,467. 5 K的吸热峰对应着萃取剂HEHAMP合成中产生的少量杂质异辛醇的分解,577. 5 K的吸热峰对应着萃取剂HEHAMP的分解,740. 0 K的放热峰则对应着支撑基底Pre-XAD-16的分解(对应图6A中729. 5 K的分解峰),在757. 5 K时SIRs-HEHAMP浸渍树脂分解完毕。 综上所述,红外光谱与TG-DSC数据均表明,HEHAMP成功浸渍到基质Pre-XAD-16树脂上。 2. 6 温度对SIRs-HEHAMP浸渍树脂吸附Sc3+的影响 在291. 2~312. 2 K温度条件下研究温度对Sc3+吸附率的影响,以吸附率A对反应温度T作图(图7)。由图7可知,温度对SIRs-HEHAMP浸渍树脂吸附Sc3+的影响不大。 可能的解释是,钪离子在溶液中以水合离子形式存在,在吸附过程中水合离子会吸收热量脱去部分配位水,而脱水后的离子与萃取剂络合而吸附在树脂上的过程为放热过程[29],二者吸热与放热的热量值相当,因而体系的温度变化对Sc3+的吸附率影响不明显。 2. 7 吸附动力学 2. 8 模拟赤泥浸出液中钪的分离 根据文献[12]配制模拟赤泥硫酸浸出液(其中Sc3+浓度为8×10-5 mol/L),硫酸浓度为1 mol/L,采用SIRs-HEHAMP浸渍树脂对其中的金属离子进行吸附。由图9可知,当溶液中Al3+浓度较高时,浸渍树脂对Al3+的吸附率仍然较低,Fe3+和稀土离子(RE3+)吸附率均在20%以下,Sc3+吸附率为51. 71%,TiO2+吸附率为42. 50%。 Sc/Ti分离系数为1. 45,Sc/Fe分离系数为4. 83,Sc/REE分离系数>4. 25。 为抑制模拟浸出液中钛的吸附,向模拟赤泥硫酸浸出液中加入质量分数为6%的H2O2溶液。 由图10可知,Sc3+吸附率为63. 17%,TiO2+吸附率为19. 82%,Fe3+吸附率为5. 04%,其余金属离子基本不吸附。 在前期的研究中发现萃取剂HEHAMP对钪和三价稀土表现出较好的分离效果,对二价金属元素的萃取率不高。 制备的SIRs-HEHAMP浸渍树脂不仅保留了萃取剂HEHAMP的性质,而且形成的浸渍树脂孔穴也对金属离子半径有选择。 加入过氧化氢可以和TiO2+发生反应,并且Fe3+可能催化过氧化氢分解形成过渡络合物也影响了Fe3+的吸附[31]。 在硫酸介质中双氧水的加入使得H2O2和TiO2+作用生成水溶性的过氧化钛配合物Ti(OH)4(H2O2)SO4[32],抑制了TiO2+的吸附,使得了SIRs-HEHAMP浸渍树脂对钛的吸附率下降。 Sc/Ti分离系数从1. 45提高至6. 94,Sc/Fe分离系数提升至32. 31,表明添加过氧化氢促进了Sc/Ti的分离。 3 结 论 采用真空浸渍法成功制备了SIRs-HEHAMP浸渍树脂,SIRs-HEHAMP浸渍树脂中萃取剂的负载量为0. 72 mmol/g。 SIRs-HEHAMP浸渍树脂在0. 44 mol/L硫酸介质中对Sc3+饱和吸附容量(以氧化物计)为36. 29 mg/g。 SIRs-HEHAMP浸渍树脂吸附Sc3+的过程与准二级动力学模型相吻合。 在添加6%H2O2(质量分数)的条件下,该浸渍树脂可从模拟赤泥浸出液中回收钪,Sc/Ti分离系数达到6. 94,基本能实现钪钛分离。 参考文献 [1]林河成. 金属钪的应用与市场[J]. 世界有色金属, 2012(11): 58-59. LIN H C. Application and market of scandium[J]. World Nonferrous Met, 2012(11): 58-59. [2]王祝堂. 铝-钪合金的性能与应用[J]. 铝加工, 2012(3): 4-14. WANG Z T. Property and application of Al-Sc alloy[J]. Aluminium Fabrication, 2012(3): 4-14. [3]柏振海, 罗兵辉, 谭敦强. Al-Mg-(Sc)合金退火组织和性能[J]. 中南工业大学学报(自然科学版), 2002(6): 600-603. BAI Z H, LUO B H, TAN D Q. Tempering on the microstructure and properties of Al-Mg-(Sc) alloy[J]. J Central South Univ (Nat Sci Ed), 2002(6): 600-603. [4]LU J H, LI S S, TAO S W, et al. Efficient CO2 electrolysis with scandium doped titanate cathode[J]. Int J Hydrogen Energy, 2017, 42: 8197-8206. [5]熊瑞, 周正东, 郭诗琪, 等. 稀土钪元素在发酵工业中的应用[J]. 食品与发酵科技, 2017, 53(4): 92-93. XIONG R, ZHOU Z D, GUO S Q, et al. Applicability of rare earth element scandium to fermentation industries[J]. Food Fermentation Sci Technol, 2017, 53(4): 92-93. [6]PELLISSIER H. Recent developments in enantioselective scandium-catalyzed transformations[J]. Coordination Chem Rev,2016, 313: 1-37. [7]WANG W W, PRANOLO Y, CHENG C Y. Metallurgical processes for scandium recovery from various resources: a review[J]. Hydrometallurgy, 2011, 108(1/2): 100-108. [8]RAMASAMY D L, PUHAKKA V, REPO E, et al. Selective separation of scandium from iron, aluminium and gold rich wastewater using various amino and non-amino functionalized silica gels-a comparative study[J]. J Cleaner Prod, 2018, 170:890-901. [9]ONGHENA B, BORRA C R, VAN GERVEN T, et al. Recovery of scandium from sulfation-roasted leachates of bauxite residue by solvent extraction with the ionic liquid betainium bis(trifluoromethylsulfonyl)imide[J]. Sep Purif Technol, 2017,176: 208-219. [10]LIU H, LIU H L, NIE C X, et al. Comprehensive treatments of tungsten slags in China: a critical review[J]. J Environ Manage, 2020, 270(110927): 1-12. [11]LIAO C S, JIA J T, ZHANG Y, et al. Extraction of scandium from ion-adsorptive rare earth deposit by naphthenic acid[J]. J Alloys Compounds, 2001, 323(C): 833-837. [12]LE W H, KUANG S T, ZHANG Z F, et al. Selective extraction and recovery of scandium from sulfate medium by Cextrant 230[J]. Hydrometallurgy, 2018, 178: 54-59. [13]PENG X J, LI L, ZHANG M, et al. Preparation of ultra-high pure scandium oxide with crude product from titanium white waste acid[J]. J Rare Earths, 2023, 41: 764-770. [14]ZHANG W, ZHU H, LIU S F, et al. Scandium recovery from ion-adsorption rare earth concentrate with HEHEHP as extractant[J]. J Central South Univ, 2021, 28: 679-689. [15]SALMAN A D, JUZSAKOVA T, JALHOOM M G, et al. A selective hydrometallurgical method for scandium recovery from a real red mud leachate: a comparative study[J]. Environ Pollut, 2022, 308(119596): 1-16. [16]王俊莲, 孙春宝, 徐盛明. 基于稀土分离的萃淋树脂制备与应用研究[J]. 中国稀土学报, 2015, 33(2): 129-145. WANG J L, SUN C B, XU S M. Advances in preparation and application of solid-liquid extraction resins based on rare earth separation[J]. J Chin Soc Rare Earths, 2015, 33(2): 129-145. [17]WANG J L, XIE M Y, MA J, et al. Extractant(2,3-dimethylbutyl)(2,4,4′-trimethylpentyl) phosphinic acid (INET-3)impregnated onto XAD-16 and its extraction and separation performance for heavy rare earths from chloride media[J]. J Rare Earths, 2017, 35(12): 1239-1247. [18]BAO S X, HAWKER W, VAUGHAN J. Scandium loading on chelating and solvent impregnated resin from sulfate solution[J]. Solvent Extra Ion Exch, 2017, 36: 100-113. [19]YU Q, NING S Y, ZHANG W, et al. Recovery of scandium from sulfuric acid solution with a macro porous TRPO/SiO2-P adsorbent[J]. Hydrometallurgy, 2018, 181: 74-81. [20]ADONIS S, OOSTHUYSEN T. Evaluation of scandium sorption using modified Amberlite XAD-4 resin[J]. Monatshefte Für Chem-Chem Monthly, 2022, 153: 1185-1196. [21]ZHANG R, KHAN S, AZIMI G. Microstructured silicon substrates impregnated with bis(2,4,4-trimethylpentyl) phosphinic acid for selective scandium recovery[J]. Appl Surface Sci, 2023, 622(156852): 1-15. [22]ZHAO Q, ZHANG Z F, LI Y L, et al. Solvent extraction and separation of rare earths from chloride media usingα-aminophsphonic acid extractant HEHAMP[J]. Solvent Extra Ion Exch, 2018, 36(2): 136-149. [23]CHEN L Y, DENG B C, KUANG S T, et al. Efficient extraction and separation of heavy rare earths from chloride medium with N,N′-di(2-ethylhexyl)aminomethyl phosphonic acid mono-2-ethylhexyl ester[J]. Hydrometallurgy, 2023, 22(106173):1-9. [24]ZHANG W, YU S, ZHANG S, et al. Separation of scandium from the other rare earth elements with a novel macro-porous silica-polymer based adsorbent HDEHP/SiO2-P[J]. Hydrometallurgy, 2019, 185: 117-124. [25]DAMINESCU D, DUTEANU N, CIOPEC M, et al. Adsorption of scandium ions by amberlite XAD7HP polymeric adsorbent loaded with tri-n-octylphosphine oxide[J]. Molecules, 2024, 29(7): 1578. [26]SUN X Q, JI Y, HU F C, et al. The inner synergistic effect of bifunctional ionic liquid extractant for solvent extraction[J]. Talanta, 2010, 81: 1877-1883. [27]YIN S H, WU W Y, BIAN X, et al. Effect of complexing agent lactic acid on the extraction and separation of Pr(Ⅲ)/Ce(Ⅲ)with di-(2-ethylhexyl) phosphoric acid[J]. Hydrometallurgy, 2013, 131/132: 133-137. [28]刘丰五, 刘玉坤. 氯甲基化苯乙烯-二乙烯基苯共聚体的红外光谱研究[J]. 河南科学, 2001, 19(1): 56-58. LIU F W, LIU Y K. IR spectroscopic study on chloromethylated styrene-divinylbenzene copolymer[J]. Henan Sci, 2001,19(1): 56-58. [29]NASEEM R, TAHIR S S. Removal of Pb(Ⅱ) from aqueous/acidic solutions by using bentonite as an adsorbent[J]. Water Res, 2001, 35: 3982-3986. [30]邱森, 刘美玭, 蒋小岗, 等. 离子液浸渍树脂对稀土吸附性能的研究[J]. 稀土, 2019, 40(2): 142-147. QIU S, LIU M P, JIANG X G, et al. The adsorption of lonic liquid impregnated resin for rare earth[J]. Chin Rare Earths,2019, 40(2): 142-147. [31]王春. 借助手持技术探究外界条件对三价铁离子催化过氧化氢分解的影响[J]. 化学教育(中英文), 2022, 43(9):86-89. WANG C. Effect of external conditions on decomposition of hydrogen peroxide catalyzed by ferric ion by hand held technology[J]. Chin J Chem Educ, 2022, 43(9): 86-89. [32]WANG L J, WANG Y, CUI L, et al. A sustainable approach for advanced removal of iron from CFA sulfuric acid leach liquor by solvent extraction with P507[J]. Sep Purif Technol, 2020, 251(117371): 1-10. Selective Adsorption of Scandium by (2-Ethylhexylamino) Methyl Phosphonic Acid Mono-2-Ethylhexyl Ester Impregnated Resin and Its Application YANG Jian-Feng1,2, LI Yan-Ling1*, HAN Jing-Lu1,2, LI Song-Song1,2, LIAO Wu-Ping1,2,3* 1(State Key Laboratory of Rare Earth Resource Utilization, Changchun Institute of Applied Chemistry,Chinese Academy of Sciences, Changchun 130022, China)2(School of Applied Chemistry and Engineering, University of Science and Technology of China,Hefei 230026, China)3(Ganjiang Innovation Academy, Chinese Academy of Sciences, Ganzhou 341000, China) Abstract The (2-ethylhexylamino) methyl phosphonic acid mono-2-ethylhexyl ester (HEHAMP) impregnated resin was prepared by loading α-amino acid phosphine extractant, known as HEHAMP, onto macroporous resin Pre-XAD-16. The study investigates the adsorption properties of scandium in a sulfuric acid medium, examining the impacts of reaction time, acidity, concentration of hydrogen sulfate ions, resin dosage and temperature. It was found that the adsorption capacity of scandium increased gradually with the increase of reaction time. Under high acidity conditions, the adsorption rate of Sc3+ by SIRs-HEHAMP impregnated resin slightly decreased with increasing acidity, while within the pH range there was almost no effect on the adsorption rate of Sc3+. During the adsorption process, HSO4- did not participate in coordination. Temperature had almost no effect on the adsorption of Sc3+. The adsorption process of Sc3+ by SIRs-HEHAMP followed a pseudo-second-order kinetic model. The saturated adsorption capacity of the resin for scandium (expressed as Sc2O3) was 36. 29 mg/g. Infrared spectroscopy and TG-DSC characterization were conducted on SIRs-HEHAMP impregnated resin,HEHAMP extractant, and the macroporous resin Pre-XAD-16. The results indicated that HEHAMP was successfully impregnated onto the supporting matrix Pre-XAD-16. The application of HEHAMP impregnated resin to the adsorption and recovery of Sc(Ⅲ) from a simulated sulfuric acid leaching solution of red mud was also explored. The adsorption rate of Sc(Ⅲ) was determined to be 51. 71%, while that of Ti(Ⅳ) was 42. 50% and Al(Ⅲ) showed negligible adsorption ,the adsorption rates for Fe(Ⅲ) and rare earth ions were below 20%,and the separation factor between Sc(Ⅲ) and Ti(Ⅳ) (SF(Se/Ti)) was 1. 45. By introducing 6% (mass percent)hydrogen peroxide, the adsorption rate of Sc(Ⅲ) improved to 63. 17%, the adsorption rates of Ti(Ⅳ) and Fe(Ⅲ)weredecreased, while other metal ions showed negligible adsorption. The separation factors between Sc(Ⅲ)and Ti(Ⅳ) (SF(Se/Ti)) reached 6. 94, indicating an enhancement in selectivity for scandium over titanium in the adsorption process. Keywords (2-Ethylhexylamino) methyl phosphonic acid mono-2-ethylhexyl ester; Scandium; Impregnated resin; Adsorption; Separation Received 2024?08?13; Accepted 2024?12?19 Supported by the National Natural Science Foundation of China( No. 92262301)