表面增强拉曼光谱的基底设计及其血液检测研究进展
摘要 表面增强拉曼光谱(SERS)因其独有的快速检测、高灵敏度、低检测限和无损分析等优点,在医学检验领域有着广泛的研究。 SERS增强基底的成功构建是SERS技术实现以上优点的前提。 本文介绍了SERS的增强机制,在血液检测中,对其增强基底的设计进行了分类及讨论,将其分为无标签基底和有标签基底两大类,并根据材料应用的不同和基底设计的方式不同进行进一步的细分。 对近年来血液检测中SERS检测应用相关文献进行了回顾,综述了在血液检验中不同类型增强基底的设计方法及应用特征。 最后,对SERS增强基底在血液检验中的设计进行了总结与展望。
关键词 表面增强拉曼光谱;增强机制;无标签基底;有标签基底;血液检测
中图分类号:O657. 3 文献标识码:A 文章编号:1000-0518(2025)01-0001-13
陕西省重点科技创新团队项目(No. 2020TD-033)和国家口腔疾病临床医学研究中心一般基金项目(No. LCB202209)资助
人体中存在可直接反映细胞生物状态的生物小分子,称为代谢物[1]。 血液中的代谢物可用于健康评估和临床诊断。 血液作为体液的一种,占人体质量的7%~8%,主要由血细胞与血浆组成,它们共同协作,维持身体的正常生理功能[2-4]。 通过血液检测不仅对身体的营养状况、免疫状态有所了解,还可对感染、炎症和肿瘤等疾病进行判断。 许多疾病,例如糖尿病、肝炎、菌血症、镰状细胞病及癌症等,均可以通过明显变化的血液成分生化指标来测定[3-5]。 目前,常用的血液检测方法包括血常规检测、生化检测和肿瘤标志物检测等[5-6]。 但以上检测方法存在预处理流程复杂、检测耗时、费用昂贵和灵敏性差等问题[7]。 在一些极端情况下,缓慢的血液检测流程可能会增加患者的死亡率,特别是在急诊、急救和重症监护中,血液检测诊断的速度和准确性变得至关重要[5-8]。 因此,需要能够进行即时血液检测的方案,以通过更快的结果来提供更早的治疗干预患者的预后。 1928年,Fleischmann等[9]首次发现光通过纯化的液体或蒸汽时会产生频率降低的散射光。 散射光频率的变化反映出不同种类原子团的独一性振动,这使得拉曼散射光谱具有“指纹”特性[10-12]。 由于水分子的拉曼响应性较弱[13-14],因此对于血液样本无需脱水处理,极大简化了此类样品的预处理过程。 然而,拉曼光谱信号弱[15]、检测灵敏度低[16]和荧光背景强[17]等缺点,限制了其在血液检测中的广泛应用[18]。
相较于普通拉曼光谱,表面增强拉曼光谱(Surface-enhanced Raman spectroscopy, SERS)具有信号更强、更准确、更快及检测限更低的优势,检出限甚至可低至1×10-15~1×10-18 mol/L[19-21]。 目前,普遍公认SERS增强效应的原理主要包括电磁场增强(Electromagnetic enhancement, EM)和化学增强(Chemical enhancement, CM)[22-24]。 EM是由于光照射在金属上时原本平衡的电子发生位移,但由于正电荷中心库仑力的作用,电子又被牵拉至原来位置,导致电子在分离的正负电荷之间反复振荡。 当入射光的频率与金属表面电子的振荡频率相匹配时,就会产生共振效应,即表面等离子体共振(Surface plasmon resonance, SPR)。贵金属纳米颗粒所产生的感应电荷可被限制在颗粒表面,即产生局域表面等离子体共振(Localized surface plasmon resonance, LSPR)[25],使得局部电场增强[26],引起拉曼信号指数级增强[27-29]。 CM是由于待测物与基底之间发生了电荷转移,增加了待测物分子的极化率而导致拉曼信号的增强,一般认为CM增强有3种模式: 1)化学成键导致非共振增强(Chemical bonding enhancement, CB);2)表面络合物共振增强(Surface complexes enhancement, SC); 3)光诱导电荷转移的共振增强(Photoninduced charge transfer enhancement, PICT)[30-32]。 化学增强产生的增强因子在10~100[33]。 SERS信号强度很大程度上取决于检测基底的材质、形貌、尺寸以及基底与分子之间的吸附特性[34]。 因此,SERS检测基底的独特性设计不仅是拉曼信号强度的关键,同样是SERS基底研究的热点与难点。
在生物医学检验领域,SERS技术已广泛应用于血液检测并在癌症早期诊断中发挥重要的作用[35-37]。面对检测成分复杂、动态变化大和个体差异明显的血液,如何合理化地设计增强基底成为关键。 随着纳米技术和激光雕刻技术不断进步,各类型的纳米增强基底不断涌现,促使SERS的检测能力大幅提升。 基于此,本文对近年来在血液检测中所用的SERS增强基底按组成进行了详尽分类,重点阐述其在血液检验中的设计方法及具体应用,基于本综述的讨论,将为SERS在血液检验中的基底设计和应用提供借鉴。
1 SERS基底分类
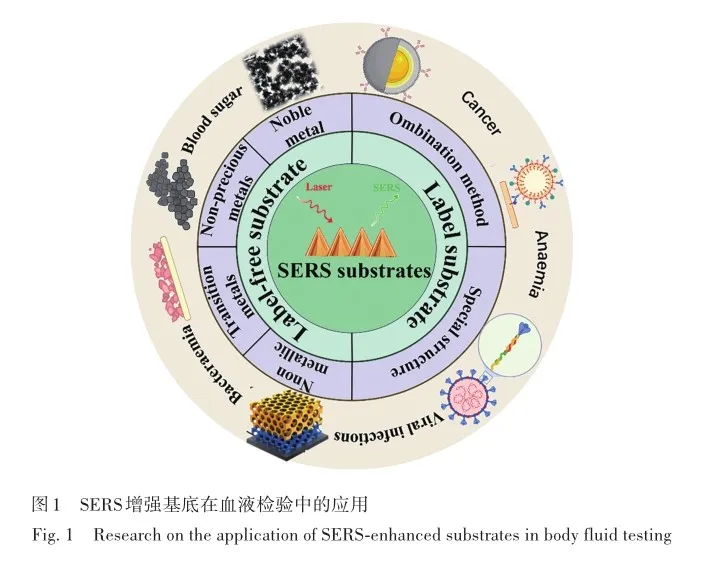
SERS的基底根据材质分类主要包括金属基底半导体基底以及非金属基底[28]。 其中,常见的金属材料有金银等贵金属、碱金属以及过渡金属[38-40]; 常见的半导体基底有二氧化钛(TiO2)和氧化锌(ZnO)等[32]; 非金属材料常见有石墨烯等[41]。 根据是否使用探针标记物,可以分为无标签SERS基底和有标签SERS基底[42]。 其中,待检测生物分子靠近无标签SERS基底中纳米粒子时,可以展现其固有指纹谱[43]。方便快捷且信息量大,但从总体分子信息中提取某些低浓度物质的信号仍是一项艰巨任务。 相反,有标签SERS基底表面通常被抗体或其他配体功能化修饰,当配体与待测生物分子靶向结合后,基底上携带的报告分子就会发出强烈的拉曼信号[44],从而特异性地表达待测物信息,实现微量物质的有效检测。 因此,有标签的SERS基底具有特异性好和灵敏度高的优点,可直接对目标分子进行定量检测[14],但其存在制作工艺复杂、合成步骤繁琐及造价昂贵等不足。 据此可知,SERS的基底设计展现出高度的多样性与丰富性,然而在目前的综述性文献中,特别是在血液检测这一特定领域内,关于SERS基底的全面而细致的分类工作尚属空缺。 因此,基于现有的研究报道,将血液检测中SERS的基底分为无标签基底及有标签基底两大类别。 同时根据应用材料的不同将无标签基底细分为贵金属、非贵金属、过渡金属以及非金属无标签基底,根据信号增强方式不同将有标签基底细分为特异性结合和特殊结构的有标签基底,最终将SERS增强基底在血液检验中的应用研究总结如图1所示。
2 无标签SERS基底在血液检验中的设计及应用
2. 1 常规构型材料应用的SERS基底
2. 1. 1 贵金属纳米材料基底的设计及应用
贵金属纳米颗粒被最早应用于SERS增强基底。 贵金属纳米基底的EM增强主要集中在被称为“热点”的狭小空间区域,这些“热点”区域内的局部电场强度显著超越外部电场,当分子处于“热点”中,会产生强烈的拉曼散射,进而获得大幅增强的拉曼光谱信号。 研究发现,这些“热点”存在于纳米颗粒尖锐的尖端、颗粒间的间隙或是其与金属底板之间的间隙[45]。 目前,在SERS进行血液检测的研究中,贵金属纳米颗粒增强基底的设计可归纳为3种。
2.1.1.1 增强基底与待测物的结合程度
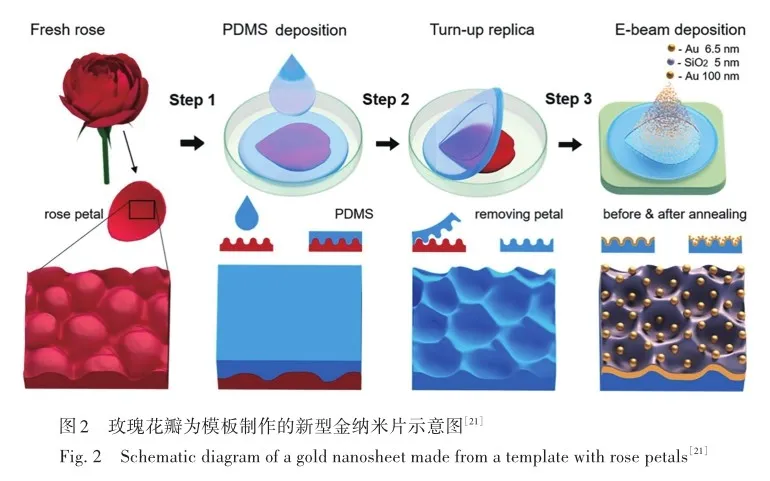
实验表明,金属粒子电磁效应作用范围为1~10 nm[46],与待测物距金属表面距离的3次方成反比[47-48],因此应尽量增强基底与待测物结合,以减小待测物与基底的作用距离,从而提高EM效应。Barshutin等[21]使用玫瑰花瓣作为模板,在玫瑰花瓣的硅胶复制品(PDMS)上通过顺序沉积和退火工艺,制作了覆盖有金薄膜和球形金纳米颗粒(Au NPs)的微腔凹槽(图2),该结构可以促进红细胞在其表面上的捕获和固定,能够对单个红细胞进行研究并检测细胞膜氧化的最初迹象,这有助于糖尿病、高血压和肥胖症等各种代谢疾病的早期诊断。 Zhang等[49]通过物理刮擦光滑的银片制成新型银纳米片(Ag NS)基底,该方法制备的Ag NS表面形成多个纳米级凹槽结构,保证“热点”数目的前提下,巧妙地通过液体的表面张力和重力捕获葡萄糖分子,提高EM效应,使光谱信号增强,在去离子水中对葡萄糖的检出限达到0. 5 amol/L,是已报道的无标签基底SERS检测的最低检出限。 在血清中也表现出类似的出色灵敏度,检出限低至0. 05 fmol/L。
2.1.1.2 增加“热点”数目
Shin等[50]将小尺寸的Au NPs离心后涂覆在含有3-氨基丙基三乙氧基硅烷(APTES)涂层的玻璃板上,APTES可起到固定Au NPs作用,大量紧密排列的Au NPs之间形成了众多细小的间隙,每个间隙均可能成为增强信号的“热点”。 因此,该基底通过增加的“热点”数目,使得EM得到提升,得到明显且强烈的SERS检测信号。 机器深度学习法分析来自Au NPs增强基底检测的血浆中外泌体的SERS信号,从人群中成功鉴别出Ⅰ期肺癌的患者,为肺癌患者的早期诊断提供了一种新方法。
2.1.1.3 改变金属纳米颗粒的形状
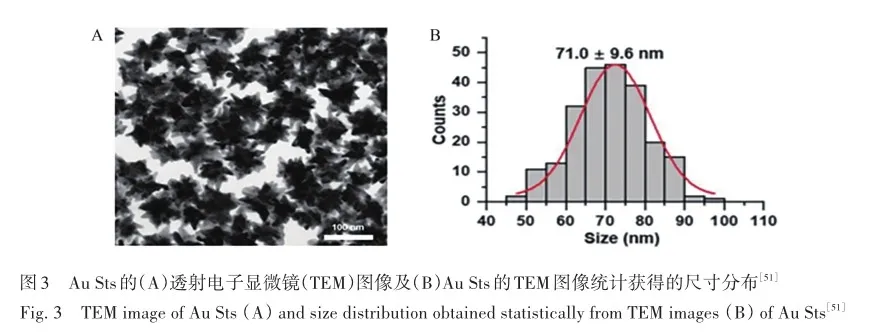
改变金属纳米颗粒的形状可使纳米颗粒的表面产生尖锐的尖端,可大幅提升“热点”的EM强度。Xie等[51]通过种子介导的生长方法合成了尖端大小约为(71. 0±9. 6) nm的金纳米星(Au St)(图3),尖锐的尖端产生近红外等离子体激元共振,“热点”的数目和EM强度均得到提高,从而大幅增强SRES信号强度,利用这一增强基底对目标人群的血清进行检测,通过主成分分析与线性判别分析(PCA-LDA)、偏最小二乘判别分析(PLS-DA)对得到的光谱信号进行分析,可以从中精准筛选乳腺癌患者,其准确率高达100%。 近年来,研究人员构建了各种形状的贵金属纳米结构,包括纳米颗粒[52]、纳米棒[53]、纳米花[54]、纳米格栅[55]和纳米丝[56],作为电磁场增强的“热点”源。 这些所谓的“热点”极大地增强了拉曼信号。
2. 1. 2 非贵金属材料应用的SERS基底
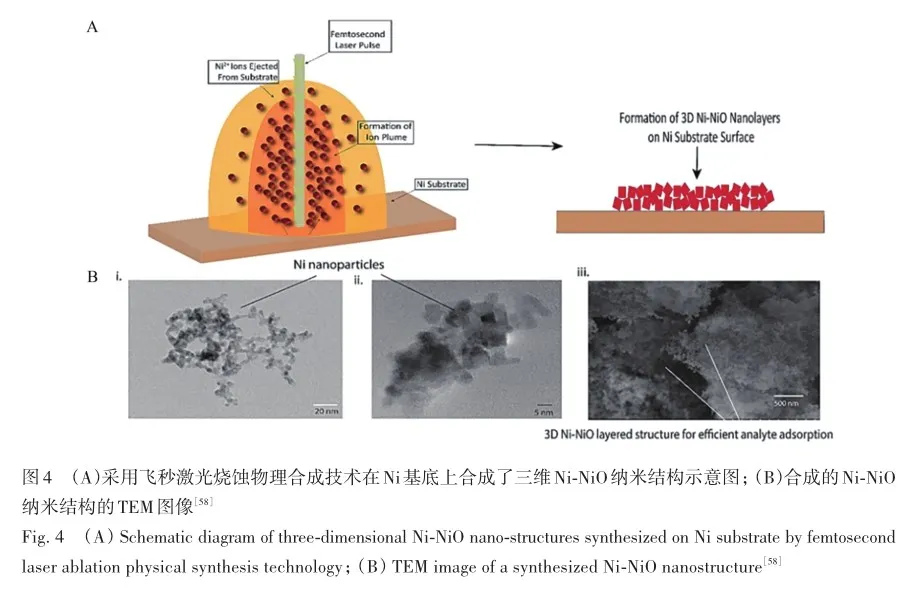
贵金属对拉曼光谱增强效果好,但其造价昂贵,用于制备贵金属纳米材料的合成工艺(物理沉积、氧化或化学还原)多繁琐复杂[57]。 随着制备工艺的不断进步,非贵金属材料SERS基底的设计得到了快速发展。 Premachandran等[58]采用飞秒激光烧蚀物理合成技术在镍(Ni)基底上合成了三维镍-镍氧化物(Ni-NiO)纳米结构(图4),该结构形成具有锋利边缘的纳米结构,产生的众多锋利边缘增加了“热点”数目,提高了EM强度,大幅提高拉曼光谱信号。 用该纳米结构对患者血清进行SERS检测,通过深度神经网络学习对SERS信号进行精准的分析,发现所制备的增强基底对脑肿瘤诊断的特异性和敏感性均达100%。光谱特征峰的相对标准偏差(RSD)小于10%,表明飞秒激光烧灼技术制作的非贵金属Ni-NiO基纳米基底具有稳定、准确和高效的疾病诊断能力,同时很好地克服了传统贵金属材料制备流程繁琐及所需耗材价格昂贵的弊端[59]。
尽管非贵金属的应用解决了材料昂贵、制备复杂的问题,但作为金属材料,许多情况下产生的局部“热点”会使血液样本中生物分子及蛋白质降解,导致检测信息不准确和样品重复差异较大的问题,同时金属在特定环境下的催化作用可能产生吸附剂副反应,对金属材料在血液检验中的应用发起了新的挑战[60]。
2. 1. 3 半导体材料应用的SERS基底
为了提高材料检测的稳定性,生物安全性,减少材料自身对待测物的影响,研究者们正尝试用硅基半导体作为一种新型增强基底材料来替代现有的金属材料[61]。 Keshavarz等[62]通过多光子电离硅(Si)芯片制备了二氧化硅(SiO2)量子探针(Si@SiO2 Q-probe),该探针外部的SiO2层可通过化学吸附生物分子来增强电荷转移,提高了CM强度,使其拉曼散射信号增强,加之其分布均匀、无细胞毒性等优点,成为可以维持细胞活性的细胞内探针。 Golubewa等[63]使用微核阵列在黑硅(bSi)表面形成了金字塔结构的蚀刻硅图案,随后在bSi上覆盖一层Au等离子体,在785 nm激发波长下,制备的bSi/Au基底的SERS增强因子高达了惊人的1×108。 Hu等[64]采用飞秒激光直写技术在大面积硅表面诱导嵌套纳米孔、纳米沟和纳米岛的复合纳米结构,作为控制Au纳米薄膜固态去湿的模板。 涂有Au纳米膜的图案化硅表面在高温下进行热润湿,从而形成分布在图案化硅表面上的致密Au-NPs,这为Au等离子体“热点”提供了更大的表面积作为载体,从而大大增强了局域电场强度,为拉曼信号增强提供了可能性。 目前,硅基材料在血液检测中常作为基底材料的表层涂层使用,发挥其良好的生物相容性和检测功能。 单纯使用硅基材料用作增强基底的设计目前尚处于空白状态,其原因可能与其拉曼信号EM效果不佳有关,同时也存在工艺复杂、制作器械门槛高等不足,目前仍处于探索阶段。
2. 1. 4 非金属材料应用的SERS基底
金属材料增强基底有良好的拉曼光谱信号增强能力,而生物安全性、生物毒性及制作成本不利于其在血液检测中应用,半导体及非金属材料因其具有良好的生物安全性,低生物毒性及化学惰性等适合在血液复杂的环境中使用而保持稳定,但其拉曼光谱信号的增强能力较低,限制了其发展。 对于非标签增强基底检测血液生物样品而言,任何一种金属、半导体和非金属材料的单独使用或许均不是最佳选择,应将二者巧妙的结合起来,以增强光谱信号同时提高生物相容性。
石墨烯材料由于具有理想的二维平面结构、芳香性、疏水性和化学惰性等性质而成为理想的非金属SERS基底材料[65]。 目前,常见的制备方法包括将石墨烯薄片转移到金属纳米颗粒表面或使用石墨烯包裹纳米颗粒,Li等[66]制备了一种稳定的石墨烯包裹的金银纳米合金(GAA),其金银核心被限制在多层石墨烯球壳中,作为细菌检测和治疗的多功能平台。 石墨烯的封装保证了金银核心良好的稳定性,从而进一步保证了其稳定的SERS信号和光热性能。 但石墨烯与金属纳米颗粒之间以物理结合为主,因此金属纳米颗粒和石墨烯之间很难形成紧密的结构。 石墨烯和金属纳米颗粒之间的空间、悬浮的石墨烯及皱褶的石墨烯结构均不可避免地导致EM增强效果的损失。 为此,Xu等[67]使用化学气相沉积方法在铜纳米颗粒(CuNPs)表面直接生长出了单层石墨烯,形成了单层石墨烯严密包裹的Cu纳米颗粒(G/CuNPs)增强基底。 石墨烯提供了原子级厚度、无缝包裹且具有化学惰性的网,防止Cu发生氧化的同时还具有富集和固定待测物分子的作用,提高CM增强信号的同时不影响Cu纳米颗粒的EM增强信号,实现了一举两得之效。 Xu等用G/CuNP增强基底成功从人血清中检测到极低浓度的腺苷分子信号(血清中腺苷的最低检测浓度低至5 nmol/L), 这种增强基底的巧妙设计为与腺苷相关疾病的早期诊断提供了借鉴。 相较于多层石墨烯,单层石墨烯展现出更好的基底金属颗粒吸附能力,并能够实现更强的信号因子增强效果[68-69]。 对此,Li等[70]研究表明,在传统SERS基底中通过化学气相沉积法添加高质量单层石墨烯可将罗丹明6G的检测限(LOD)提高到10-14 mol/L。 但石墨烯材料的具体应用仍需借助金属纳米颗粒来增强光谱信号,其自身信号增强能力仍有不足,制作成本及制作工艺仍较复杂,这均限制了其在血液检测中的实际应用。
2. 2 特殊构型材料应用的SERS基底
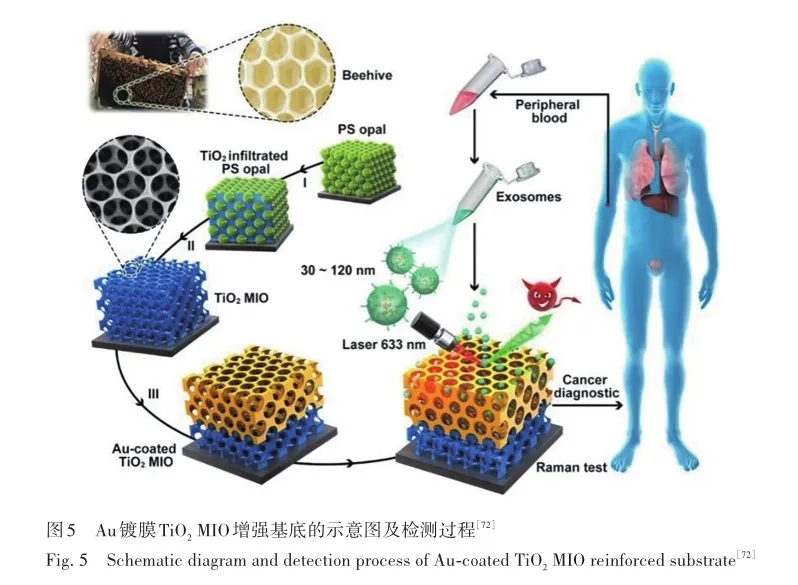
无标签SERS基底的设计逐渐的从传统贵金属材料向金属-非金属材料联合应用上过渡,随着创新性设计方案的不断涌现,SERS基底从平面化设计逐渐走向了立体3D设计,这特殊设计赋予基底更多可控的变化和更加精细的筛选,从而带来更加精准、高效的检测结果。 Xu等[71]提出的超薄热响应聚合物(N-异丙基丙烯酰胺)-石墨烯-Ag纳米颗粒混合基底,N-异丙基丙烯酰胺在温和升温至37 ℃过程中可诱导基底材料自折叠,石墨烯将N-异丙基丙烯酰胺与Ag纳米颗粒分开,以利于Ag纳米颗粒能提供更加清晰的SERS光谱信号。 该基底可以充分包裹柔软或不规则形状的3D生物样品,因此对于红细胞形态异常类疾病而言,如遗传性镰状红细胞贫血、珠蛋白生存障碍性贫血等,可通过该基底包裹红细胞后检测SERS信号来快速和选择性的绘制异常红细胞表面,为血液疾病的快速诊断提供了另一种思路。 除红细胞形态与疾病密切相关外,血液中外泌体也是很多疾病的特征性标志物,Dong等[72]设计了一种类似于天然蜂巢结构的镀Au-二氧化钛(TiO2)大孔蛋白石(MIO)基底(Au-coated TiO2 MIO)。 在硅片上制备由多层密排聚苯乙烯(PS)球组成的PS MIO模板。 随后,将TiO2的溶胶溶液渗透到PS模板的间隙中后退火即获得TiO2 MIO结构。 随后,将Au薄膜热蒸发到TiO2 MIO结构的顶层,获得蜂巢状六边形结构Au-coated TiO2 MIO基底(图5)。 其中,Au薄膜充分保证了EM强度,TiO2 MIO结构中相互连接的纳米级孔隙网络成为分离血液中外泌体的理想陷阱,可简单且有效的捕获外泌体以减少血液中其他复杂成分对光谱信号的干扰并提高CM强度。 TiO2 MIO特殊的六边形蜂巢结构具有可降低光速的“慢光效应”,这种效应使光子与待测物质充分作用,显著提高了SERS信号。 该基底的应用实现了可靠的肿瘤血液活检,对于体外癌症快速预筛选展现出巨大的临床应用潜力。 因此,对于特殊构型基底而言,其独特的孔径、结构等均可作为血液中不同成分的筛选器或捕获器,在增加SERS信号强度同时有效避免血液中复杂成分带来的信号干扰。
3 有标签SERS基底在血液检验中的设计及应用
3. 1 SERS基底特异性结合方式
血液检验中,相较于无标签基底,有标签基底在基底材料的选择及联合应用等方面均更加简单,但待测物与基底发生特异性结合是有标签基底的关键所在,目前在血液检测研究中,常见的待测物与基底发生特异性结合方式可归纳为以下3种。
3. 1. 1 抗原-抗体特异性结合
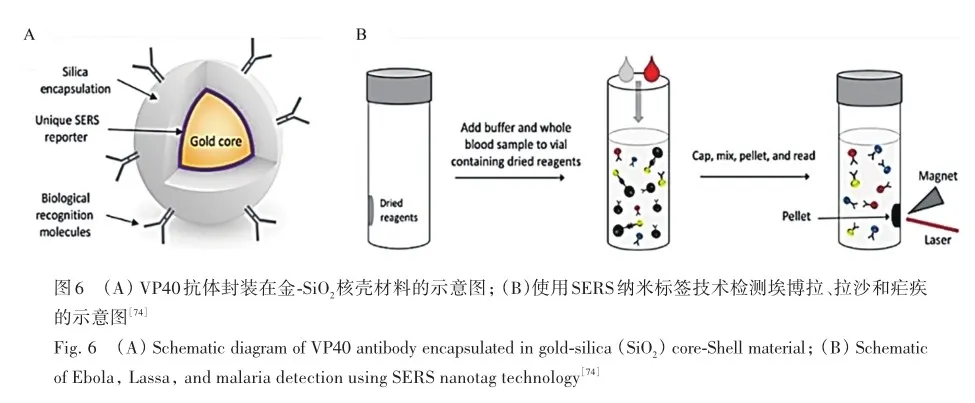
目前,鉴定传染源的主要技术仍是微生物培养,但需要24~72 h才能对常见感染做出最终诊断,临床快速诊断的需求无法满足。 为此,Pazos-Perez等[73]在球形Ag NP上使用羧酸官能团偶联细菌抗体,检测时血液中细菌能与抗体特异性结合并聚集在Ag NP上,将检测时间缩短至13 min,为菌血症的快速诊断提供了新的思路。 但当血液中细菌浓度过低时,发生特异性结合的Ag NP数量较少,且散在分布,检测限受到影响。 对此,Sebba等[74]充分利用了磁性吸附特性,将埃博拉病毒的特异性抗体VP40封装在金-SiO2核壳材料之间,同时加入封装VP40的磁性颗粒,埃博拉病毒可同时与该基底和磁性颗粒发生特异性结合,共同形成的磁性微粒结构,通过磁力作用在容器的侧壁发生富集(图6)。 对侧壁的磁体直接进行SERS检测,发现对埃博拉病毒检测的灵敏度为90. 0%,特异性为97. 9%,准确率为96. 6%。 该检测方法只需加入血液即可进行检测,这种创新的磁力富集设计,可以弥补抗原-抗体结合能力不足问题,也为传染性疾病的血液检测提供了更加安全且便捷的新思路。
3. 1. 2 化学键特异性结合
除抗原-抗体的特异性结合外,待测物与增强基底还可以通过化学键进行特异性结合。 Muhammad等[75]将有机氰化物分子(4-巯基苯甲腈,MBN)通过Ag—S化学键锚定在Ag NPs上。血红蛋白(Hb)中的血红素可与MBN中的—C≡≡N键相互作用,使得Hb聚集在基底表面,实现SERS信号增强。 该增强基底检测限为0. 46 μg/mL,可用来快速诊断贫血患者。 利用化学反应,将待测物与增强基底进行化学键结合,既可以简化基底制作过程又可保证SERS强度,从而实现对目标疾病的快速特异性响应。 但其对待测物本身的化学结构具有一定的要求,相似化学结构的物质会对结果产生影响,待测血液温度、pH值等外界因素均会影响最终结果。 如何提高稳定性,排除其他类似化学结构的影响是这类基底设计首要考虑的问题。
3. 1. 3 静电吸引特异性结合
Gao等[76]用带负电的Ag NPs和氧化石墨烯(GO)在正极电解质聚二烯丙基二甲基氯化铵(PDDA)的作用下静电相互作用结合,生成较强正电荷的GO/PDDA/Ag NPs并通过化学键合到微结构中空纤维(MHF)内特有的悬浮核上,以增强拉曼信号。 当待测血液样品流过MHF内部的通道时,正电荷较强的GO/PDDA/Ag NPs基底可以将胆红素分子从白蛋白中分离出来,并通过静电力与胆红素分子结合,以达到剥离和富集胆红素分子的目的。 结果表明,白蛋白中胆红素、人血液中胆红素的检测浓度范围均在2~100 μmol/L内,且均具有良好的线性响应, 检测限达到1×10-6 mol/L, 为临床上准确诊断黄疸及相关疾病提供了广阔的前景。
3. 2 有标签SERS基底的特殊结构
三明治结构在SERS有标签基底中应用广泛。 一般由3部分组成: 1)与增强底物连接的捕获探针;2)检测目标; 3)SERS信号报告器。 前二者与特异性结合的基底设计类似,其特点在于SERS信号报告器上,不仅可以放大信号,还可以在特殊区域产生信号,以克服血液中生物分子干扰,SERS信号报告器设计可分为以下2种。
3. 2. 1 信号增强的SERS信号报告器
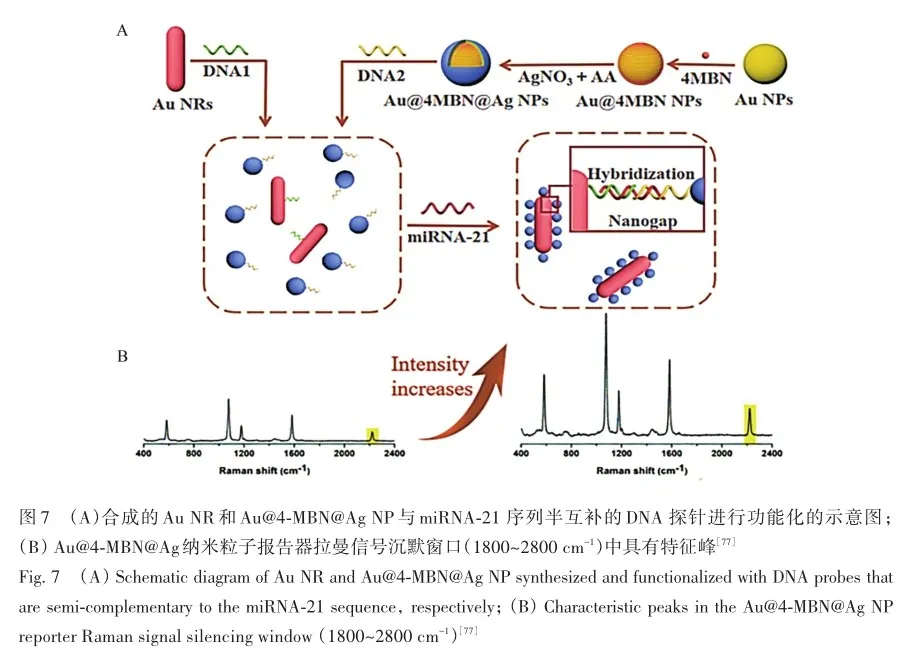
Chen等[77]在Au核表面利用以4-巯基苯甲腈(4-MBN)为锚点诱导Ag原子均匀沉积,合成了Au@4-MBN@Ag纳米粒子报告器。 该报告器不仅用4-MBN锚点极大地增强了SERS光谱信号,并且4-MBN在拉曼信号沉默窗口(1800~2800 cm?1)中具有特征峰,以克服血浆中非检测生物分子的信号干扰(图7)。 该增强基底对早期肺癌生物性标志物miRNA-21检测限低至0. 1 fmol/L,通过临床实验发现Ⅰ期和Ⅲ~Ⅳ期肺癌患者血浆中的miRNA-21水平显著高于健康人。 这种独特的SERS基底设计为检测血浆中微量miRNA提供了一种超灵敏的方法。
3. 2. 2 “信号关闭”的SERS信号报告器
研究者发现不仅可以利用拉曼光谱的“信号出现”来检测物质,还可以利用拉曼光谱的“信号关闭”对待测物实现定量检测。 亚甲基蓝(MB)作为一种有机染料,具有良好的可见光吸收性能。 Zhao等[78]将前列腺特异性抗原适配子(PSA Apt)固定在基底上。 MB作为一种新颖的SERS信号报告器特异性吸附于PSA Apt上,此时形成的三明治结构具有最强的SERS信号强度。 当血液中存在前列腺特异性抗原(PSA)时,PSA与PSA Apt发生特异性结合,致使 PSA Apt与MB从基底脱落,SERS中MB信号强度降低。 最终通过降低的信号强度来计算待测物中PSA的量。 该增强基底的设计具有较高的光谱重现性、选择性和灵敏度,并成功地测定了前列腺癌症患者血清样品中PSA的表达水平,显示出巨大的临床诊断潜力。 但该方法制备的增强基底中,SERS信号报告器最初的结合率和最终的脱离率会受到周围环境、检测手法及检测时间等各种因素影响,材料自身的差异性较大,检测结果的稳定性还有待评估。
4 结论与展望
SERS具有高灵敏、快速检测及水分子弱拉曼响应等优点,已在生物传感、药品鉴定、环境检测和文物勘测等领域广泛应用。 面对复杂多变且个体差异较大的血液环境时,SERS的基底制备成为关键。基底的材料、形貌、结构及吸附能力等均会对SERS增强效果产生影响。 本文主要对在血液检验中现有的增强基底进行归纳并分别阐述了不同类型增强基底的具体应用。 尽管各类基底种类繁多,但面对复杂的血液环境,研发出具有高稳定性、高重复性和高敏感性且生物相容性好的基底一直是热点问题。无标签基底中,更注重材料选择、工艺提升以及生物相容性等方面,并通过高效准确的光谱数据分析算法,从庞大繁杂的生物光谱数据中,发掘潜在的信号差异。 以达到快速准确的判断出疾病状态。 有标签基底使拉曼光谱分析从定性分析走向定量分析,可实现对疾病代表性标志物进行检测,提高检测的灵敏性及特异性。 因此,在有标签基底中,更注重特异性结合部分的设计以及已结合部分的充分富集,这也使得基底的制作过程更加复杂,基底存储和临床转化有更高的要求。
虽然目前表面增强拉曼光谱技术在众多领域已经有了长足发展,但在生物医学领域中更多停留在实验室阶段,基底设计作为拉曼光谱临床应用的短板,今后研究可将重点放在以下方面: 1)保证拉曼信号增强效果的同时寻找生物相容性更好、更稳定的新材料来替代毒性较大、价格昂贵的贵金属颗粒;2)发展光谱数据AI算法,虽然血液检测中SERS信号可能有几个明显尖峰,但其成分复杂,目前对细微信号差异性捕捉,直接分析波长强度和位移仍有困难,这需要利用AI技术建立血液相关疾病诊断模型,将SERS光谱信号可以立即转化为可读的临床标准; 3)降低有标签基底的制作难度及制作成本,明确血液检验中某一疾病的特异性标志物,在此基础上不断优化基底的特异性结合设计,达到降低成本且长期储存的目的; 4)扩大临床实验数据,在更大的临床实验中具体验证SERS基底的实用性能,联合基础医学、光谱学研究者和临床医生共同合作,为疾病诊断的可靠性提供支持。 随着技术的进步与发展,无标签基底应聚焦于非金属材料与金属材料联合应用,提高生物安全性同时保证光谱信号强度。 此外,提高基底制作技术如: 飞秒技术、慢光效应等来发展过渡金属及非金属基底也是值得探索的另一方向。有标签基底中,化学及静电结合可能是摆脱抗体基底易失活不易长期储存的新途径,同时,应注重已发生特异性结合产物的富集,保证SERS信号的最大化捕捉。
参考文献
[1]DAMIANI C, GAGLIO D, SACCO E, et al. Systems metabolomics: from metabolomic snapshots to design principles[J]. Curr Opin Biotech, 2020, 63: 190-199.
[2]DEAN L. Blood groups and red cell antigens[M]. USA, Maryland: NCBI, 2005.
[3]LAURENCE A M, ROBERT A H, GRAY S, et al. Principles of biochemistry[M]. USA, New York: Pearson, 2014.
[4]MARSHALL W J, LAPSLEY M, DAY A P, et al. Clinical biochemistry: metabolic and clinical aspects: third edition[M]. NL,Amsterdam:EHS, 2014.
[5]FREEDMAN D B. Clinical governance: implications for point-of-care testing. annals of clinical biochemistry[J]. Ann Clin Biochem, 2002, 39(5): 421-423.
[6]刘宇. 血常规检验在临床贫血患者诊断中的影响分析[J]. 中国现代医生, 2022, 60(11): 144-146. LIU Y. Analysis of the effect of blood routine examination in the diagnosis of patients with clinical anemia[J]. Modern Chin Doctor, 2022, 60(11): 144-146.
[7]YUAN H, CHIU P Y, CHEN C F. Paper-based analytical devices for point-of-care blood tests[J]. Biomicrofluidics, 2021,15(4): 041303.
[8]HIRATA K, WAKE M, TAKAHASHI T, et al. Clinical predictors for delayed or inappropriate initial diagnosis of type A acute aortic dissection in the emergency room[J]. Plos One, 2015, 10(11): e0141929.
[9]FLEISCHMANN M, HENDRA P J, MCQUILLAN A J. Raman spectra of pyridine adsorbed at a silver electrode[J]. Chem Phys Lett, 1974, 26(2): 163-166.
[10]MOSKOVITS M. Surface roughness and the enhanced intensity of Raman scattering by molecules adsorbed on metals[J]. J Chem Phys, 1978, 69(9): 4159-4161.
[11]SHIPP D W, SINJAB F, NOTINGHER I, et al. Raman spectroscopy: techniques and applications in the life sciences[J]. Adv Opt Photon, 2017, 9: 315-428.
[12]HAN X X, RODRIGUEZ R S, HAYNES C L, et al. Surface-enhanced Raman spectroscopy[J]. Nat Rev Methods Primers,2022, 1(1): 87.
[13]ZHANG Y W, REN L, WANG Q, et al. Raman spectroscopy: a potential diagnostic tool for oral diseases[J]. Front Cell Infect Mi, 2022, 12: 775236.
[14]ZONG C, XU M X, XU L J, et al. Surface-enhanced Raman spectroscopy for bioanalysis: reliability and challenges[J]. Chem Rev, 2018, 118(10): 4946-4980.
[15]赵堉文, 张泽帅, 朱晓英, 等. 表面增强拉曼光谱技术在多元病原菌同时检测中的应用策略[J]. 光谱学与光谱分析, 2023, 43(7): 2012-2018. ZHAO Y W, ZHANG Z S, ZHU X Y, et al. Application strategies of surface-enhanced Raman spectroscopy in simultaneous detection of multiple pathogens[J]. Spectrosc Spect Anal, 2023, 43(7): 2012-2018.
[16]DECKERT V, GEORGE M W, UMAPATHY S. Raman spectroscopy at the beginning of the twenty-first century Ⅱ[J]. J Raman Spectrosc, 2008, 39(11): 1508-1511.
[17]刘平, 齐晓彬, 刘毅恒, 等. 拉曼光谱技术在深空探测中的应用评述 [J]. 科学通报, 2023, 68(27): 3634-3653. LIU P, QI X L, LIU Y H, et al. Applications of Raman spectroscopy technology in deep space exploration: a review[J]. Chin Sci Bull, 2023, 68(27): 3634-3653.
[18]LU J T, XUE Q S, BAI H X, et al. Design of a confocal micro-Raman spectroscopy system and research on microplastics detection[J]. Appl Opt, 2021, 60(27): 8375-8383.
[19]LU Y, LIN L, YE J. Human metabolite detection by surface-enhanced Raman spectroscopy[J]. Mater Today Bio, 2022,13: 100205.
[20]SUN D, CAO F, TIAN Y, et al. Label-free detection of multiplexed metabolites at single-cell level via a SERS-microfluidic droplet platform[J]. Anal Chem, 2019, 91(24): 15484-15490.
[21]BARSHUTINA M, DOROSHINA N, BAIZHUMANOV A, et al. SERS substrates based on rose petal replicas for the oxidative stress detection[J]. Appl Surf Sci, 2023, 626: 157281.
[22]SU H S, CHANG X X, XU B J. Surface-enhanced vibrational spectroscopies in electrocatalysis: fundamentals, challenges,and perspectives[J]. Chin J Catal, 2022, 43(11): 2757-2771.
[23]CHANG K, ZHAO Y J, WANG M L, et al. Advances in metal-organic framework-plasmonic metal composites based SERS platforms: engineering strategies in chemical sensing, practical applications and future perspectives in food safety[J]. Chem Eng J, 2023, 459: 141539.
[24]FAN M, ANDRADE G F, BROLO A G. A review on the fabrication of substrates for surface enhanced Raman spectroscopy and their applications in analytical chemistry[J]. Anal Chim Acta, 2011, 693(1/2): 7-25.
[25]PITARKE J M, SILKIN V M, CHULKOV E V, et al. Theory of surface plasmons and surface-plasmon polaritons[J]. Prog Phys, 2007, 70(1): 1-87.
[26]BROWN R J C, WANG J, MILTON M J T. Electromagnetic modelling of Raman enhancement from nanoscale structures as a means to predict the efficacy of SERS substrates[J]. J Nanomater, 2007, 14: 1-10.
[27]POCKRAND I, OTTO A. Coverage dependence of Raman scattering from pyridine adsorbed to silver/vacuum interfaces[J]. Solid State Commun, 1980, 35(11): 861-865.
[28]LEE H K, LEE Y H, KOH C S L, et al. Designing surface-enhanced Raman scattering (SERS) platforms beyond hotspot engineering: emerging opportunities in analyte manipulations and hybrid materials[J]. Chem Soc Rev, 2019, 48(3):731-756.
[29]CAMDEN J P, DIERINGER J A, WANG Y, et al. Probing the structure of single-molecule surface-enhanced Raman scattering hot spots[J]. J Am Chem Soc, 2008, 130(38): 12616-12617.
[30]WU D Y, LIU X M, DUAN S, et al. Chemical enhancement effects in SERS spectra: a quantum chemical study of pyridine interacting with copper, silver, gold and platinum metals[J]. Phys Chem C, 2008, 112(11): 4195-4204.
[31]LIU Y P, LU Z W, ZHU H B, et al. Characterization of a chloride-activated surface complex and corresponding enhancement mechanism by SERS saturation effect[J]. Phys Chem C, 2007, 121(1): 950-957.
[32]陈韶云, 张行颖, 刘奔, 等. 表面增强拉曼光谱基底的种类及其应用进展[J]. 分析化学, 2024, 52(7): 910-924. CHEN S Y, ZHANG X Y, LIU B, et al. Classification and application of surface-enhanced Raman spectroscopy substrates[J]. Chin J Anal Chem, 2024, 52(7): 910-924.
[33]ADRIAN F J. Charge transfer effects in surface-enhanced Raman scatteringa[J]. JCP, 1982, 77(11): 5302-5314.
[34]王姝凡, 张雁玲, 王少军, 等. 表面增强拉曼光谱基底研究进展[J]. 当代化工, 2022(1): 051. WANG S F, ZHANG Y L, WANG S J, et al. Research progress in substrates of surface-enhanced Raman spectroscopy[J]. Contemp Chem Ind, 2022(1): 051.
[35]DELL′OLIO F, SU J, HUSER T, et al. Photonic technologies for liquid biopsies: recent advances and open research challenges[J]. Laser Photon Rev, 2021, 15(1): 1863-8880
[36]XIE W, SCHLüCKER S. Medical applications of surface-enhanced Raman scattering[J]. PCCP, 2013, 15(15): 5329-5344.
[37]王佳琪, 徐蔚青, 徐抒平. 表面增强拉曼光谱技术结合机器学习方法在生物医学领域应用的最新进展[J]. 光散射学报, 2024, 36(1): 1-15.WANG J Q, XU W Q, XU S P. Recent advances in surface-enhanced Raman spectroscopy(SERS) combined with machine learning algorithms in biomedical fields[J]. J Light Scatter, 2024, 36(1): 1-15.
[38]HU Q, ZHAO G C, GUO H M, et al. Preparation and SERS performance of gold nanoparticles-decorated patterned silicon substrate[J]. Appl Surf Sci, 2023, 638: 157966.
[39]FRASER J P, POSTNIKOV P, MILIUTINA E, et al. Application of a 2D molybdenum telluride in SERS detection of biorelevant molecules[J]. ACS Appl Mater, 2020, 12(42): 47774-47783.
[40]CAO Y, LIANG P, DONG Q, et al. Facile reduction method synthesis of defective MoO2-x nanospheres used for SERS detection with high chemical enhancement[J]. Anal Chem, 2019, 91(13): 8683-8690.
[41]HOSSAIN M I, NANDA S S, CHO S, et al. Gold nanorod density-dependent label-free bacteria sensing on a flake-like 3D graphene-based device by SERS[J]. Biosensors, 2023, 13(11): 962.
[42]LANE L A, QIAN X M, NIE S M. SERS nanoparticles in medicine: from label-free detection to spectroscopic tagging[J]. Chem Rev, 2015, 115(19): 10489-10529.
[43]ZHENG X S, JAHN I J, WEBER K, et al. Label-free SERS in biological and biomedical applications: recent progress,current challenges and opportunities[J]. Spectrochim Acta A, 2018, 197: 56-77.
[44]WANG Y Q, YAN B, CHEN L X. SERS tags: novel optical nanoprobes for bioanalysis[J]. Chem Rev, 2013, 113(3):1391-1428.
[45]TONG L M, XU H X, K?LL M. Nanogaps for SERS applications[J]. Mrs Bull, 2014, 39(2): 163-168.
[46]MULVIHILL M J, LING X Y, HENZIE J, et al. Anisotropic etching of silver nanoparticles for plasmonic structures capable of single-particle SERS[J]. J Am Chem Soc, 2010, 132(1): 268-274.
[47]杨序纲, 吴琪琳. 拉曼光谱的分析与应用[M]. 北京: 国防工业出版社, 2008. YANG X G, WU Q L. Raman spectroscopy analysis and application[M]. Being: National Defense Industry Press, 2008.
[48]STILES P L, DIERINGER J A, SHAH N C, et al. Surface-enhanced Raman spectroscopy[J]. Annu Rev Anal Chem,2008, 1: 601-626.
[49]ZHANG T, LI Y T, LV X M, et al. Ultra-sensitive and unlabeled SERS nanosheets for specific identification of glucose in body fluids[J]. Adv Funct, 2024, 34(17): 2315668.
[50]SHIN H, OH S, HONG S, et al. Early-stage lung cancer diagnosis by deep learning-based spectroscopic analysis of circulating exosomes[J]. ACS Nano, 2020, 14(5): 5435-5444.
[51]XIE Y C Z, SU X M, WEN Y, et al. Artificial intelligent label-free SERS profiling of serum exosomes for breast cancer diagnosis and postoperative assessment[J]. Nano Lett, 2022, 22(19): 7910-7918.
[52]WANG X J, ZHU X P, CHEN Y Q, et al. Sensitive surface-enhanced raman scattering detection using on-demand postassembled particle-on-film structure[J]. ACS Appl Mater, 2017, 9(36): 31102-31110.
[53]FU G, SUN D W, PU H, et al. Fabrication of gold nanorods for SERS detection of thiabendazole in apple[J]. Talanta,2019, 195: 841-849.
[54]PATEL A S, JUNEJA S, KANAUJIA P K, et al. Gold nanoflowers as efficient hosts for SERS based sensing and bio-imaging[J]. Nano-Struct Nano-Objects, 2018, 16: 329-336.
[55]DENG X G, BRAUN G B, LIU S, et al. Single-order, subwavelength resonant nanograting as a uniformly hot substrate for surface-enhanced Raman spectroscopy[J]. Nano Lett, 2010, 10(5): 1780-1786.
[56]HUANG L P, ZHU Y J, XU C S, et al. Noninvasive diagnosis of gastric cancer based on breath analysis with a tubular surface-enhanced Raman scattering sensor[J]. ACS Sens, 2022, 7(5): 1439-1450.
[57]CHOWDHURY A, TAN B, VENKATAKRISHNAN K. SERS-active 3D interconnected nanocarbon web toward nonplasmonic in vitro sensing of HeLa cells and fibroblasts[J]. ACS Appl Mater, 2018, 10(42): 35715-35733.
[58]PREMACHANDRAN S, HALDAVNEKAR R, DAS S, et al. DEEP surveillance of brain cancer using self- functionalized 3D nanoprobes for noninvasive liquid biopsy[J]. ACS Nano, 2022, 16(11): 17948-17964.
[59]雍佳乐, 吴东. 飞秒激光仿生调控材料表面浸润性: 当前进展与挑战(特邀)[J]. 中国激光, 2024, 51(1): 169-249. YONG J L, WU D. Bioinspired controlling the surface wettability of materials by femtosecond laser: current progress and challenges (invited)[J]. Chin J Lasers, 2024, 51(1): 169-249.
[60]ALESSANDRI I, LOMBARDI J R. Enhanced Raman scattering with dielectrics[J]. Chem Rev, 2016, 116(24): 14921-14981.
[61]KESHAVARZ M, TAN B, VENKATAKRISHNAN K. Cell selective apoptosis induced by polymorphic alteration of selfassembled silica nanowebs[J]. ACS Appl Mater Inter, 2017, 9(7): 6292-6305.
[62]KESHAVARZ M, TAN B, VENKATAKRISHNAN K. Label-free SERS quantum semiconductor probe for molecular-level and in vitro cellular detection: a noble-metal-free methodology[J]. ACS Appl Mater Inter, 2018, 10(41): 34886-34904.
[63]GOLUBEWA L, KARPICZ R, MATULAITIENE I, et al. Surface-enhanced Raman spectroscopy of organic molecules and living cells with gold-plated black silicon[J]. ACS Appl Mater Inter, 2020, 12(45): 50971-50984.
[64]HU Q, ZHAO G C, GUO H M, et al. Preparation and SERS performance of gold nanoparticles-decorated patterned silicon substrate[J]. Appl Surf Sci, 2023, 638: 157966.
[65]LIU X H, JIANG S, CHANG L, et al. Recent research progress of non-noble metal based surface-enhanced Raman scattering substrates[J]. Acta Phys Sin, 2020, 69(19): 190701.
[66]LI S K, LI Z Y, HAO Q, et al. Ultrastable graphene isolated AuAg nanoalloy for SERS biosensing and photothermal therapy of bacterial infection[J]. Chin Chem Lett, 2023, 35(3): 108636.
[67]XU S C, MAN B Y, JIANG S Z, et al. Graphene/Cu nanoparticle hybrids fabricated by chemical vapor deposition As surface-enhanced Raman scattering substrate for label-free detection of adenosine[J]. ACS Appl Mater, 2015, 7(20):10977-10987.
[68]ZHOU H Q, QIU C Y, LIU Z, et al. Thickness-dependent morphologies of gold on n-layer graphenes[J]. J Am Chem Soc, 2010, 132(3): 944-946.
[69]ZHOU H Q, QIU C, YU F, et al. Thickness-dependent morphologies and surface-enhanced Raman scattering of Ag deposited on n-layer graphenes[J]. J Phys Chem C, 2011, 115: 11348-11354.
[70]NALINI S, THOMAS S, ANJU K S, et al. Chemical vapour deposited graphene-mediated enhanced SERS performance in silver nanostructures[J]. Mater Sci Technol, 2022, 39(8): 933-940.
[71]XU W, PAIDI S K, QIN Z, et al. Self-folding hybrid graphene skin for 3D biosensing[J]. Nano Lett, 2019, 19(3):1409-1417.
[72]DONG S L, WANG Y H, LIU Z Q, et al. Beehive-inspired macroporous SERS probe for cancer detection through capturing and analyzing exosomes in plasma[J]. ACS Appl Mater, 2020, 12(4): 5136-5146.
[73]PAZOS-PEREZ N, PAZOS E, CATALA C, et al. Ultrasensitive multiplex optical quantification of bacteria in large samples of biofluids[J]. Sci Rep, 2016, 6: 29014.
[74]SEBBA D, LASTOVICH A G, KURODA M, et al. A point-of-care diagnostic for differentiating Ebola from endemic febrile diseases[J]. STM, 2018, 10(471): eaat0944.
[75]MUHAMMAD P, HANIF S, YAN J L, et al. SERS-based nanostrategy for rapid anemia diagnosis[J]. Nanoscale, 2020,12(3): 1948-1957.
[76]GAO D H, YANG X H, TENG P P, et al. On-line SERS detection of bilirubin based on the optofluidic in-fiber integrated GO/Ag NPs for rapid diagnosis of jaundice[J]. Talanta, 2021, 234: 122692.
[77]CHEN C R, WANG J, LU D C, et al. Early detection of lung cancer via biointerference-free, target microRNA-triggered core-satellite nanocomposites[J]. Nanoscale, 2022, 14(22): 8103-8111.
[78]ZHAO J Q, WANG J H, LIU Y W, et al. Detection of prostate cancer biomarkers via a SERS-based aptasensor[J]. Biosens Bioelectron, 2022, 216: 114660.
Substrate Design of Surface-Enhanced Raman Spectroscopy and Research Progress in the Detection of Body Fluids
CAI Yun-Fan1,2, XU Ke-Hui2, ZHAO Yao2, LI Zhi-Ting1,2, XIA Ling-Yun1, WANG Chen-Yu2,LUO Zhi-Xiao1*, NIU Li-Na2*
(1Department of Stomatology, Taihe Hospital, Hubei University of Medicine, Shiyan 442000, China) 2(Department of Prosthodontics, School of Stomatology, Air Force Medical University, Shaanxi Key Laboratory of Stomatology, National Clinical Research Center for Oral Diseases, State Key Laboratory of Oral Maxillofacial Reconstruction and Regeneration, Xi’an 710032, China)
Abstract Surface enhanced Raman spectroscopy (SERS) has been extensively studied in the field of medical testing due to its unique advantages of rapid detection, high sensitivity, low detection limits and non-destructive analysis. The successful construction of SERS substrates is essential for realizing these benefits. In this paper,the enhancement mechanism of SERS is introduced, the design of its enhanced substrate in blood detection is categorized and discussed. It is divided into two categories: label-free substrates and label substrates, and further subdivided according to different material applications and substrate design methods. A review of relevant literature on the application of SERS detection in blood testing in recent years, summarizes the design methods and application characteristics of different types of enhanced substrates in blood testing. Finally, the design of SERS-enhanced substrate in blood examination is summarized and prospected.
Keywords Surface-enhanced Raman spectroscopy; Enhancement mechanism; Label-free substrate; Label substrate; Blood testing
Received 2024?07?01; Accepted 2024?11?20
Supported by the Shaanxi Key Scientific and Technological Innovation Team (No. 2020TD-033) and the National Clinical Research Center for Oral Diseases (No. LCB202209)

