杏属植物组织培养技术的研究进展

摘要:" 植物组织培养技术是杏属植物工厂化育苗、定向育种、种质资源保存、遗传转化、功能基因验证以及推广示范的重要载体,对促进区域经济发展、生态环境修复、医学药品研发和文旅项目建设等方面发挥着积极的推动作用。本文系统性对杏属植物组织培养技术中启动培养、增殖培养、再生培养、生根培养和田间移栽等关键环节的研究成果进行了梳理和归纳,介绍适合各杏属植物离体培养的最佳方案,提出该技术中存在技术起步晚、外植体污染率高、外植体褐化、组培苗玻璃化以及组培苗根系长势弱等难点问题,并针对问题提出下一步研究思路,旨在为后续杏属植物组培技术体系优化、定向育种、遗传转化体系建立和技术推广等研究工作提供参考。
关键词:" 杏属植物;" 组织培养技术;" 研究进展
中图分类号:" "S 722. 37" " " " " " " "文献标识码:" "A" " " " " " " " 文章编号:1001 - 9499(2025)01 - 0024 - 06
Research Advance on Tissue Culture Technology of Armeniaca Mill.
YANG Yue
(Liaoning Forestry Development Service Center," Liaoning Shenyang 110034)
Abstract Plant tissue culture technology is an important carrier for factory seedling cultivation, targeted breeding, germplasm resource conservation, genetic transformation, functional gene verification and popularization demonstration of Armeniaca Mill. plants, and which plays a positive role in promoting regional economic development, ecological environment restoration, medical drug research and development and cultural tourism project construction. In this paper, the technical achievements of the key links in the tissue culture technology of Armeniaca Mill plants such as initiation culture, proliferation culture, regeneration culture, rooting culture and field transplanting were systematically reviewed and summarized, and the best program suitable for in vitro culture of each Armeniaca Mill. plants were introduced, and some difficult problems of this technology such as late start of technology, high explants pollution rate, explants Browning, tissue culture seedling glass and weak root growth of tissue culture seedlings were put forward in this paper, and the next step was proposed in order to provide reference for the subsequent research work of Armeniaca Mill. plants which include tissue culture technology system optimization, targeted breeding, genetic transformation system establishment and technology promotion.
Key words Armeniaca Mill.; tissue culture technology; research advance
植物组织培养技术(简称组培技术)又称植物离体培养技术,该技术由德国植物学家 Haber Land于1902年首次以细胞学理论提出,随后,1958年美国植物学家Steve Wood通过对培养基配方的改良,在野生胡萝卜根部组织上成功分化完整植株[ 1 ],就此组培技术得到了充分验证,并开启了植物学的“新世界”。自上个世纪60年代起,我国逐渐开展植物组培技术研究,分别在医药、糖料和园艺等植物上取得突破性研究成果[ 2 - 4 ],历经近60年的探索与研究,组培技术已具备和衍化出无菌苗快繁、优良性状筛选、玻璃苗脱毒、诱导基因突变以及功能基因验证等多项实用功能,在植物遗传育种、品种改良、工厂化育苗、珍稀物种种植资源库建设、基因编辑等前沿领域发挥着重要的作用,并广泛应用到我国农业、林草、生物、医药等关键产业,创造了显著的经济、生态和社会价值。
蔷薇科(Rosaceae)杏属(Armeniaca Mill.)植物包括紫杏(Armeniaca dasycarpa)、藏杏(Armeniaca holosericea)、洪平杏(Armeniaca hongpingensis)、东北杏(Armeniaca mandshurica)、梅(Armeniaca mume)、山杏(Armeniaca sibirica)和杏(Armeniaca vulgaris),均属于多年生落叶乔木或极稀灌木,主要分布于我国北方(内蒙古、辽宁、河北、吉林、黑龙江、山西、陕西、甘肃、新疆等)地区[ 5 - 6 ]。杏属植物作为林农业主栽树种之一,其具有根系发达、适生性强、耐贫瘠等生态树种共性优势,同时还兼顾果肉鲜甜、种仁香脆、油脂含量高、杏仁苷类物质丰富、固沙保墒等经济林树种特性优势[ 7 - 9 ],因此,杏属植物备受国内外鲜果贸易、城市绿化、生态建设和医药研究等多元化市场所青睐。高需求需要高产出和高供给体系作为保障,在当今倡导良种良法的背景下,优良性状、优质苗木和优势基因是良种选育、苗木繁育和基因改良研究长期待以突破的三大目标,植物组培技术的应用是有效解决以上重任的有力途径。从20世纪90年代至今,杏属植物组培技术的研究已从单一品种发展到多品种,从简单的体细胞胚培养完善到系统化组培苗的生产,这其中,研究人员已经通过不同杏属植物不同类型的外植体建立起启动、快繁、再生以及生根等关键体系,形成了一套完整、系统化的组培体系。在此研究成果的基础上,未来该技术可与化学和分子技术相融合,开展功能基因发掘、编辑与验证等研究,建立高效、稳定的转化体系,从而探究功能基因作用机理[ 10 - 12 ],最终实现加快育种进程、提高育种效率、丰富种质资源和提升种实品质的目的。本文对当今杏属植物主栽品种组培技术的启动、快繁、再生、生根和移栽等环节的研究成果进行梳理和归纳,系统化总结出研究现状,并从中分析出制约组培技术发展的瓶颈问题,针对问题提出下一步工作的研究方向和思路,旨在为杏属植物品种选育、优质育苗、资源保存和遗传转化等研究工作提供参考。
1 杏属植物组织培养技术的研究进展
1. 1 组培苗的启动培养
启动培养又称初代培养或建苗,是组织培养技术的起始环节,也是决定获得组培苗成败的重要环节,其关键因素分别为消毒处理方法、外植体选择和培养基配方的筛选。
1. 1. 1 外植体的选择
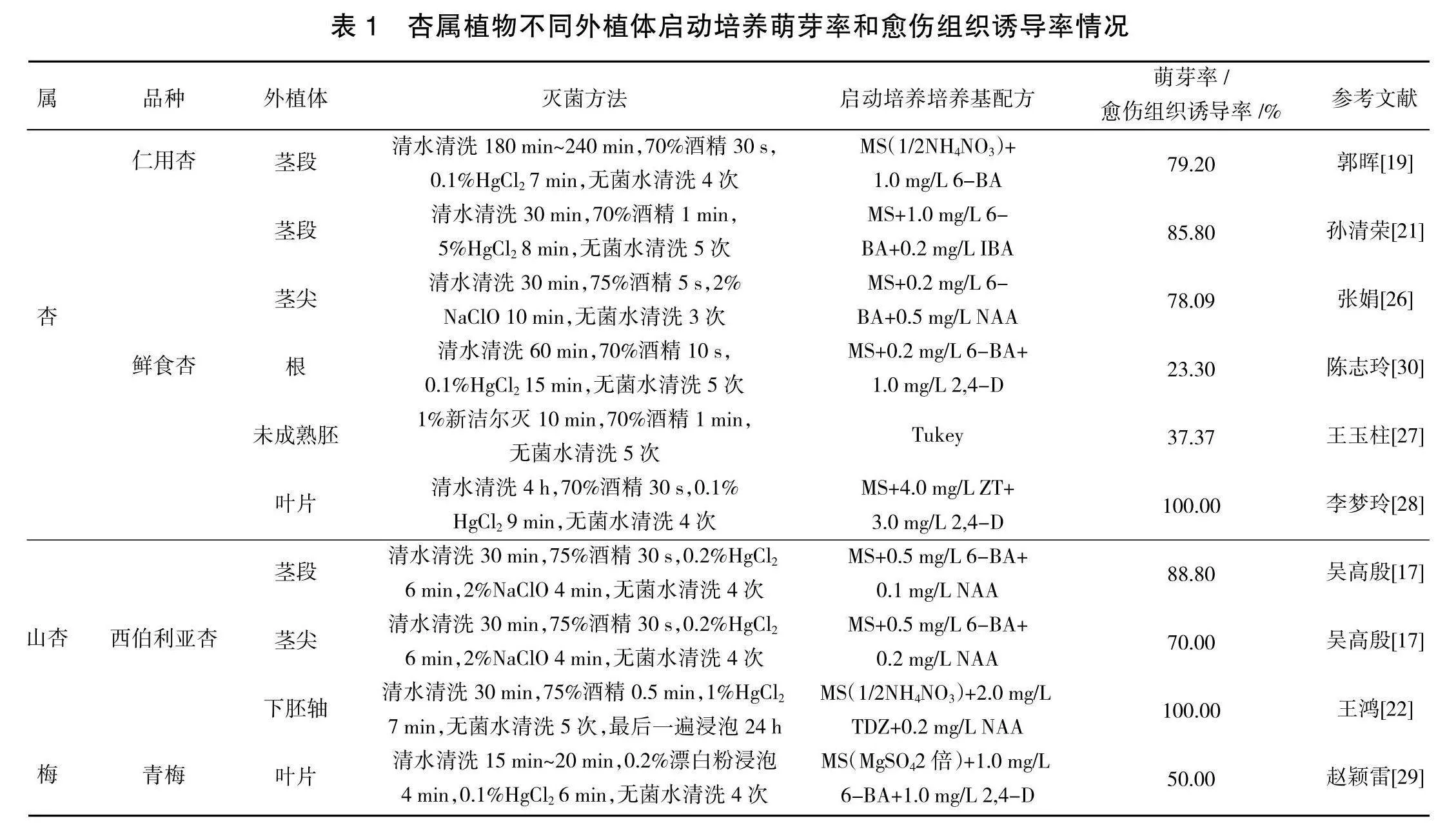
外植体是杏属植物离体培养的启动材料,不同外植体的分化能力和脱菌率不尽相同,最终获得组培苗的概率也存在很大差异。广义上讲杏属植物启动培养所用的外植体分为两大类,一类为植物的器官,包括植物的营养器官(茎段、茎尖、根尖、叶片等)和生殖器官(种子、成熟胚、下胚轴、花药等)[ 13 - 14 ];另一类为植物的细胞组织,通常指植物的愈伤组织和原生质[ 15 - 16 ]。研究表明,在众多不同类型的外植体当中,鲜嫩茎段以其具有已分化的基础芽点、培养周期短、操作简单、取材方便、耐逆性强等优势成为启动培养首选外植体,其萌发率可达60%~85%[ 17 - 21 ]。在无鲜嫩茎段或其表面附有大量绒毛的条件下,茎尖和种胚同样也是杏属植物优先选择的外植体,相比于茎段,茎尖和种胚脱菌效果较好,萌发率可达72%~97%[ 17 , 22 ],然而,该外植体存在直接分化不定芽数量相对较少、操作难度较大,培养周期长,取材不方便等问题。原生质可通过愈伤组织纯化而得,其与愈伤组织均可以作为启动培养的外植体[ 23 ]。1994年,陈崇顺便开展杏脆散型愈伤组织诱导和细胞悬浮培养研究,愈伤诱导率可达150 mg以上[ 24 ]。田毅通过对培养基配方的改良,成功实现愈伤组织诱导率达到93%[ 25 ]。相对而言,愈伤组织和原生质诱导分化不定芽从而获得组培苗,此方法属于再生体系范畴,存在费时、费力和细胞突变等不利、不确定因素,因此,该培养方式很少运用在组培苗的启动培养。根据表1可知,杏和山杏茎段萌芽率可达79.2%~88.8%[ 17 , 19 , 21 ];茎尖萌芽率可达70%~78.09%[ 26 , 17 ];胚愈伤诱导率可达37.37%~100%[ 27 , 22 ];杏和梅叶片的愈伤诱导率可达50.00%~100%[ 28 , 29 ];杏根部的愈伤诱导率可达23.03%[ 30 ]。
1. 1. 2 外植体的消毒处理
外植体消毒处理是实现田间植株向瓶装植株转变的唯一途径,植株的前期清洗、消毒试剂的种类、试剂的浓度、消毒的时长和消毒后的冲洗次数直接关系到外植体脱菌效果的好坏[ 31 ]。外植体前期的冲洗和时长需根据植物生长的环境和外植体种类而定,通常情况下,田间植株需要在含清洁剂的水中浸泡0.5 h后,清水冲洗30~240 min,而水培或棚内的植株则需要清水冲洗30~60 min即可。就试剂选择而言,多数以酒精和升汞为主,二者相比酒精灭菌效果好于升汞,但酒精对外植体的损害程度也高于升汞,易导致外植体的褐化甚至死亡。为了达到既充分灭菌又避免对外植体的过度伤害,多数研究采取二者组合的方式对外植体进行消毒处理,即短时间酒精加适当时间升汞(表1)。
茎段:杏和山杏幼嫩枝条清水冲洗30~240 min,切成带侧芽的茎段后70%酒精消毒30 s,0.1%升汞消毒6~7 min,2%次氯酸钠消毒4 min,无菌水清洗4次[ 19 , 21 , 17 ]。
茎尖:杏和山杏侧芽清水清洗30 min,75%酒精消毒5~30 s,0.2%升汞消毒6 min,2%次氯酸钠消毒4 min,无菌水清洗3~4次[ 26 , 17 ]。
胚:杏和山杏种子清水清洗30 min,75%酒精消毒30~60 s,1%升汞消毒7 min或1%新洁尔灭10 min,无菌水清洗5次[ 27, 22 ]。
叶片:杏和梅的叶片清水清洗20~240 min,70%酒精消毒30 s或0.2%漂白粉浸泡4 min,1%升汞消毒6~9 min,无菌水清洗4次[ 28 , 29 ]。
根:杏的根头部清水清洗240 min,70%酒精消毒10 s,0.1%升汞消毒15 min,无菌水清洗5次[ 30 ]。
1. 1. 3 基本培养基的选择和激素组合的筛选
培养基是供给组培苗营养生长所必需矿质元素、微量元素、碳元素和激素的营养源。启动培养环节中选用的培养基称作为启动培养基,也可以称作为初代培养基。在外界植株转变无菌苗过程中,能够维持其正常存活、生长和分化的生理过程,启动培养基的种类和激素组合起到关键性作用。具体杏属植物启动培养基配方由表1所示,除杏未成熟胚启动培养选用Tukey培养基外,多数杏属植物启动培养均选用MS培养基。激素组合基本由细胞分裂素和生长素组合而成。当外植体已有芽点的(茎段和茎尖)情况下,选用浓度为0.2~1.0 mg/L 6-BA和0.1~0.2 mg/L IBA或NAA激素组合最为适宜[ 19 , 21 , 26 , 17 ]。当外植体无芽点(胚、根、叶片)的情况下,为了保证外植体分化出大量愈伤组织或不定芽,应适当提高细胞分裂素的浓度,多数研究采用2.0 mg/L 6-BA或2.0 mg/L TDZ、4.0 mg/L ZT和1.0 mg/L~3.0 mg/L 2,4-D、0.2 mg/L NAA激素组合[22 , 27 - 30 ]。
1. 2 杏属植物组培苗增殖和再生培养
1. 2. 1 组培苗增殖培养
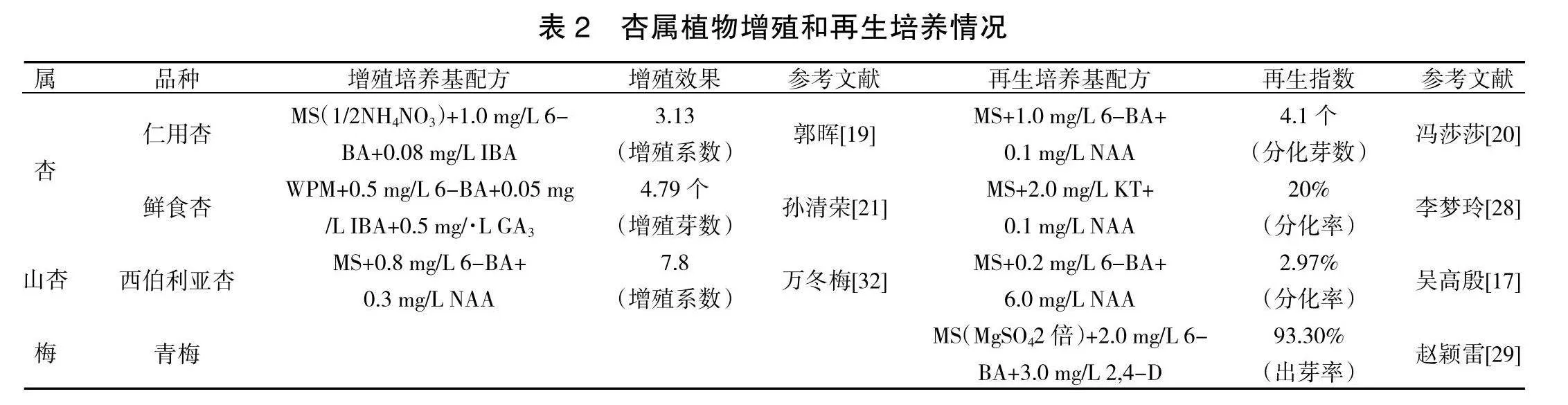
组培苗增殖培养又称继代培养和快繁,是将启动培养获得的组培苗和不定芽进行多次培养,使其不断分化出新的不定芽,进而实现组培苗大量增殖的培养过程。增殖培养是组培技术实现工厂化育苗的重要途径,也是该技术有别于其他育苗技术,可实现低成本、高数量、稳定性、统一性育苗的显著优势。增殖培养与启动培养主要差别集中在培养基中细胞分裂素和生长素浓度的高低。通常情况下,增殖培养的细胞分裂素浓度远低于启动培养。杏属植物增殖培养培养基配方见表2所示,在培养基种类方面,除孙清荣[ 2 ]在鲜食杏增殖培养研究中选用WPM培养基以外,仁用杏和山杏的组培苗增殖培养均选用MS培养基。在激素组合方面,仁用杏和鲜食杏选用0.5~1.0 mg/L 6-BA和0.05~0.08 mg/L IBA激素组合[ 19 , 21 ],山杏选用0.8 mg/L 6-BA和0.3 mg/L NAA激素组合[ 32 ],仁用杏增殖系数可达到3.13,鲜食杏平均增殖芽数达到4.79个,山杏增殖系数为7.8。
1. 2. 2 组培苗再生培养
再生培养是将无菌苗不同部位器官或组织作为再生材料,诱导其分化愈伤组织和不定芽的培养方法。此培养方法是诱变和定向育种的重要途径。为达到再生材料快速和大量分化愈伤组织和不定芽的目标,激素组合中细胞分裂素的浓度往往处于较高水平。根据表2所示,在培养基的选择方面,以MS或改良MS培养基为主,激素6-BA浓度控制在1.0~2.0 mg/L[ 20 , 28 , 17 , 29 ],仁用杏分化芽数可达到4.1个,鲜食杏分化率为20%,山杏分化率为2.97%,青梅出芽率为93.30%。
1. 3 杏属植物组培苗生根培养
组培苗生根培养是无菌苗向田间苗转变的前提条件,也是闭环式获得完整植株的关键因素,因此,为了提高无菌苗移栽的成活率,研究人员针对不同品种杏属植物,研发出与其品种相匹配的培养基配方和培养方式。由表3可知,生根培养的基本培养基主要以MS和1/2MS培养基为主,激素为0.2~2 mg/L IBA,组培苗生根率可达到70%~93.2%[ 17 , 20 - 23 ],并且,经一段时长的暗培养处理,有助于组培苗根源细胞的分化和根系的生长。
1. 4 杏属植物组培苗田间移栽
组培苗根系的发达程度、环境的温度和湿度、移栽基质的种类和配比是决定组培苗移栽成活率高低的关键因素。研究表明,应挑选生长旺盛、根系发达、无烂根的组培苗进行移栽,成活率更高。移栽前需将无菌苗转移至温室中锻炼3~5 d,移除封口膜炼苗2~3 d,每天向组培苗滴入适量无菌水,保持培养基湿润,炼苗结束后进行移栽[ 14 ]。移栽基质配方为蛭石∶沙壤土=1∶1或蛭石∶珍珠岩∶腐殖土=1∶1∶1的配方最佳,组培苗移栽成活率分别为90%和79.41%[ 33 - 34 ]。组培苗移栽到营养钵或营养盘后,要在高湿低光照的小拱棚中培养7~10 d,促进根系分化生长。后期将棚膜打开保证移栽苗间通风和光照,培养环境的温度控制在23~28℃,湿度控制在50%~70%,定期喷水。并且,根据移栽苗的状态,调控光照强度,如发现移栽苗萎蔫,应及时遮光补水,防止移栽苗因缺水和强光照而枯黄死亡,移栽30 d后调查移栽苗的成活率。
2 杏属植物组织培养技术存在的问题
2. 1 杏属植物组培技术起步晚
国内杏属植物组培技术起步于上世纪90年代,受多元化市场需求和农林科研不断深化发展的影响,推动此技术于本世纪初逐渐兴盛,然而相对于传统园艺类果树(苹果、梨等树种),杏属植物组培技术起步却相对较晚,多项研究成果需要不断量化和优化,此现状与杏传统育种和繁育技术的竞争脱不开关系。多年来杏的育种和繁育主要以杂交和嫁接方式为主,二者方法简单、成本低,备受干旱、半干旱地区从事传统杏属植物栽培工作者和生产单位所青睐。与之相比,技术起步较晚,技术含量相对较高、前期建设成本较高的组培技术而言,制约其发展的因素却相对较多。此外,组培技术是产业发展和高尖端科研的基础,一旦成熟,其经济价值不可限量,因此,杏属植物的组培技术需要更广泛的推广和更多领域人群的关注。
2. 2 组培苗启动培养污染率高
萌芽率和成活率是决定外植体启动培养成败的关键指标,高污染率和低萌芽率是启动培养难点问题,研究表明,在杏属植物启动培养环节中,多数外植体经过灭菌后,萌芽率很少能达到80%以上,对于追求高效率工厂化标准育种和育苗的组培技术而言,无形当中损耗和浪费掉大量材料、人力和时间成本。具体体现在生产操作中,消毒试剂消杀时间短,灭菌效果差,虽然消毒试剂对外植体损伤较小,但外植体污染率高导致其成活率低,组培苗启动培养不理想;消毒试剂消杀时间长,消毒效果好,外植体污染率低,然而,因外植体受消毒试剂长时间消杀,细胞结构遭到破坏,外植体成活率仍然较低,组培苗启动培养结果仍不理想。因此,既要低污染率,又要高萌芽率,是未来不同杏属植物组培技术重点攻克的难题之一。
2. 3 外植体的褐化和组培苗的玻璃化
外植体的褐化是经过消毒试剂(酒精、升汞等)杀菌后,外植体的器官或组织由绿色逐渐转变为褐色,组织停止分化,芽点停止萌发,直至整个外植体衰竭死亡的现象。褐化现象常常出现在启动培养的环节中,是外植体细胞结构遭受消毒试剂渗透压破坏的结果,极大破坏了外植体的再生能力。与其他乔木类的经济林树种相同,相比于灌木或藤本类树种,乔木类外植体(茎段、叶片和种胚)的再生能力相对较弱,外植体更容易褐化。
组培苗玻璃化是植株体内含水量高,干物质、叶绿素、纤维素含量低,栅栏组织发育不全,植株生长缓慢,器官组织脆弱易脱落的现象,玻璃化植株很难作为增殖、再生和生根培养的材料。导致杏属植物组培苗玻璃化的原因主要以外源激素使用不当和pH值失常有关,极大影响组培苗的产出。
2. 4 组培苗根系长势弱
相较于藤本、草本和灌木类植物,乔木类杏属植物组培苗根原基的分化相对较弱,虽然有相关研究报道个别品种生根率可达70%以上,但生根稳定性和根系强生长势需要不断对生根培养体系的优化。组培苗根系细弱易断是杏属树种的共性问题,一定程度影响组培苗移栽成活率,从而影响整个杏属植物的产业发展。
3 杏属植物组织培养技术研究建议
杏属植物是林农业重要成员,其集食用、加工、药用、造林、观赏和水土保持等多功能于一身,是名副其实的“全能”树种,承担着我国生态文明建设和乡村振兴战略等国策的重要使命。组培技术是推动杏属植物闭环式产业链建设和发展的有力推手,对提高杏属植物种植技术的水平、激发抗逆功能基因的发掘和提升种实类加工产品的质量具有持续性深远影响。
目前,杏属植物组培技术基础性研究已经成型,多类型外植体启动培养、原生质体和愈伤组织再生培养、组培苗快繁培养、生根培养等关键体系已建立成功。未来,珍贵杏属品种基因库建设、关键功能基因验证体系建立、市场化杏属品种组培技术体系优化以及组培技术成果工厂化转化将成为杏属植物组培技术乃至整个产业研究和关注的焦点。因此,为了更明确未来杏属植物组培技术研究思路,依据当前发展现状,提出若干点建议:①提高市场化组培苗的竞争力。市场化竞争力就是品种的竞争力,应着重研发和利用经济性、优异性和特异性强的基因型杏属品种。在组培苗稳定产出的基础上,引种特异性强、开发潜能高的品种,形成持续性产品更迭,从而提高市场竞争力;②优化组培技术水平,减少外植体褐化和组培苗玻璃化。在启动培养环节,适当减少强消毒试剂(酒精)和长消毒时间的运用,改用单一温和消毒试剂(升汞、次氯酸钠、次氯酸钙、奥克泰士等)多次消毒+长时段消毒模式或多种温和消毒试剂相互组合的模式,以免造成外植体组织和器官的过度损伤,防治褐化。在组培苗快繁和再生培养环节中,应减少高浓度和强分化的细胞分裂素(TDZ)的运用,适当选用(6-BA、KT等)较温和的细胞分裂素,以免造成细胞过度分化,出现玻璃苗现象;③建立杏属植物高效遗传转化体系。遗传转化体系源于组织培养技术,是功能基因验证和编辑的重要途径。高效的再生培养体系是遗传转化体系的基础,因此,要实现杏属植物有效的基因编辑和发掘,再生培养环节中技术的参数和培养基的配方应阶段性的优化和完善,为获得高转化率提供基础性保障;④提高组培苗移栽成活率。在组培苗的生根率达到基本标准的基础上,组培苗移栽后可适在基质中添加低浓度的营养液(1/2MS或1/2Turkey),以便促进组培苗在田间环境下根系的分化和生长,提高移栽成活率;⑤杏属植物组织培养技术成果的推广。多数杏属植物组培技术仍停留在实验室阶段,很少运用到农林业生产之中。从实验室向工厂化转变是质的飞跃,因此,应加强杏属植物组培技术的普及、宣传、培训和指导,联合地方企业和农林生产大户形成产-学-联新模式,促进区域性传统树种产业生产技术向高尖端生产技术升级,真正实现市场化成果转化,科技创造财富。
参考文献
[1] 王蒂." 植物组织培养[M]." 北京:" 中国农业出版社," 2010. 18 - 19.
[2] 罗士韦," 黄文徽," 曹国仪," 等." 人参组织培养[J]." 植物生理学通讯, 1964, 2(5): 26 - 27.
[3] 广东省农业科学院水稻生态研究室." 甘蔗茎叶组织培养研究初报[J]. 植物学报, 1977, 19(4): 12 - 13.
[4] 中国科学院北京植物研究所六室分化组." 苹果矮化砧木的组织培养[J]. 植物杂志, 1977(5): 37, 41-42.
[5] 中国科学院中国植物志编辑委员会." 中国植物志:" 第38卷[M].北京: 科学出版社, 1986, 24.
[6] 邹盼红," 邵征绩," 向成丽," 等." 杏属植物的生长发育与 DNA 分子标记的研究进[J]. 现代园艺, 2020(17): 14 - 16.
[7] 海利力·库尔班," 王蕾," 阿卜杜许库尔·牙合甫," 等." 持续干旱下天山野生杏幼苗渗透调节物质的累积特性[J]. 干旱区研究," 2011, 28(1): 126 - 132.
[8] DEINEKA V I, GABRUK N G, DEINEKA L A, et al. Triglyceride composition of oil from stones of nine rosaceae plants[J]. Chemistry of Natural Compounds, 2002, 38(5): 410-412.
[9] TODERICH K, TSUKATANI T, SHOAIB I, et al. Extent of salt affected land in central Asia: biosaline agriculture and utilization of the salt-affected resources[J]. KIER Working Papers, 2008, 13(2): 57 - 72.
[10] CAMARA MACHADO M L, CAMARA MACHADO A, HANZER V, et al. Regeneration of transgenic plants of Prunus armeniaca containing the coat protein gene of plum pox virus[J]. Plant Cell Rep, 1992(11): 25 - 29.
[11] PETRI C, ALBURQUERQUE N, GARCA -CASTILLO S, et al. Factors affecting gene transfer efficiency to apricot leaves during early Agrobacterium-mediated transformation steps[J]. J Hortic Sci Biotechy, 2004, 79(5): 704-712.
[12] PETRI C, WANG H, ALBURQUERQUE N, et al. Agrobacterium-
mediated transformation of apricot (Prunus armeniaca L.) leaf explants[J]. Plant Cell Rep, 2008, 27: 1317 - 1324.
[13] 吴高殷." 山杏不同外植体愈伤组织的诱导及其体细胞胚胎发生[D]. 呼和浩特: 内蒙古农业大学, 2018.
[14] 郭俊云," 徐卫红." 早熟杏成熟胚组织培养影响因素的研究[J]. 陕西农业科学, 2007(2): 56 - 58.
[15] 宛淑艳," 张常钟," 陆静梅," 等." 大豆组织培养和原生质培养研究的进展[J]. 长春师范学院学报, 2002, 21(1): 57 - 60.
[16] 唐靖雯," 钱晶晶," 王宁," 等." 水稻愈伤组织诱导及不定芽分化培养体系建立[J]. 安徽科技学院学报, 2024, 38(1):" 47 - 51.
[17] 吴高殷," 田有亮," 何炎红," 等." 山杏茎尖和茎段组织培养体系的建立[J]. 经济林研究, 2017, 35(2): 151 - 156.
[18] 代金玲," 张胜利," 乌日罕," 等." 山杏育苗技术研究进展[J]. 中国果树, 2019(6): 17 - 21.
[19] 郭晖." 大扁杏离体组织茎芽分化诱导试验[J].平原大学学报, 2007, 24(4): 122 - 125.
[20] 冯莎莎, 姚太梅, 郑志新, 等. 大扁杏品种‘优一’组织培养再生体系建立的初步研究[J]. 河北北方学院学报(自然科学版), 2018, 34(5): 41 - 46.
[21] 孙清荣," 王金政," 薛晓敏, 等." ‘金凯特’杏的组织培养与快繁[J]. 山东农业科学, 2016, 48(12): 25 - 28.
[22] 王鸿," 马锋旺," 郝燕." 山杏下胚轴再生植株的研究[J]." 西北农林科技大学学报(自然科学版), 2005, 33(5): 127 - 129.
[23] 杨越." 文冠果组织培养技术的研究进展[J]. 辽宁林业科技, 2018(5): 53 - 57.
[24] 陈崇顺." 杏茎脆散愈伤组织的获取及细胞悬浮培养的建立[J].植物资源与环境, 1994, 3(3): 22 - 26.
[25] 田毅," 王艳," 赵宇瑛." 凯特杏愈伤组织的诱导[J]. 现代农业科技, 2006(9): 10 - 13.
[26] 张娟," 王新建," 闫福军." 库车小白杏的组织培养及玻璃化法超低温保存试验初探[J]. 新疆农科科学, 2011, 48(12): 2255 - 2260.
[27] 王玉柱," 张大鹏," 杨丽," 等." 未成熟杏离体胚培养技术的研究[J]. 农业生物技术学报, 2000, 8(4): 389 - 391.
[28] 李梦玲," 李嘉瑞," 陶正平," 等." 杏叶片离体繁殖研究[J]. 中国农学通报, 2001, 17(2): 8 - 10.
[29] 赵颖雷," 蔡冲," 程璐," 等." 青梅快速繁殖体系的建立[J]. 浙江农业科学, 2009(5): 888 - 891.
[30] 陈志玲," 长成合," 吕增仁," 等." 桃杏根愈伤组织培养初报[J].园艺学进展, 1998(2): 150 - 153.
[31] 陈翠红," 苗春泽," 田年军," 等." 植物组织培养中常见污染类型及污染防控措施[J]. 现代园艺, 2023(24): 155 - 156, 159.
[32] 万冬梅." 粉花山杏选育及无性繁殖技术的研究[D]. 沈阳: 沈阳农业大学, 2016.
[33] 刘小蕾," 刘艳萌," 张学英," 等." 西伯利亚杏的组织培养[J]. 植物生理学通讯, 2008, 44(3): 524 - 526.
[34] 刘晓光," 单梅华," 苏帅," 等." 山杏组培苗生根培养基优化及移栽[J]. 分子植物育种, 2020, 18(6): 1999 - 2005.

