新型抗凝药Ⅺ因子抑制剂监测方法及逆转策略研究进展
【摘要】 Ⅺ因子(FⅪ)在血栓形成中扮演关键角色,而在止血过程中的作用较为有限。这种作用差异为预防和治疗血栓性疾病开辟了新的途径,即靶向FⅪ可能是一种更为安全的抗凝策略。目前,越来越多的FⅪ抑制剂进入Ⅲ期临床试验,尽管这些抑制剂展现出巨大的临床潜力,但其监测和逆转策略尚未明确,这给实验室监测和临床实践带来了新的挑战。本文在FⅪ的生理功能和FⅪ抑制剂在研药物的基础上,系统地探讨了FⅪ抑制剂的实验室检测抗凝活性证据,结合遗传性Ⅺ因子缺乏患者的治疗方案总结了FⅪ抑制剂的逆转方法,为制订临床治疗方案及逆转策略提供一定的参考。
【关键词】 抗凝药;因子Ⅺ;血栓性疾病;抗凝治疗;药物监测;逆转
【中图分类号】 R 973.2 【文献标识码】 A DOI:10.12114/j.issn.1007-9572.2024.0046
Advances in Monitoring and Reversal Strategies for the Novel Anticoagulants Factor Ⅺ Inhibitors
CHEN Yuexiu1,YAO Yuanyuan1,SUN Dawei1,WANG Ying1,WU Chaomin1,ZHAO Linqian1,TANG Zhifeng2,ZHANG Fengjiang1*
1.Department of Anesthesiology,2nd Affiliated Hospital,School of Medicine,Zhejiang University,Hangzhou 310009,China
2.College of Biomedical Engineering and Instrument Science,Zhejiang University,Hangzhou 310030,China
*Corresponding author:ZHANG Fengjiang,Chief physician;E-mail:zrzfj@zju.edu.cn
【Abstract】 Factor Ⅺ(FⅪ) plays a major role in thrombus amplification and an ancillary role in hemostasis. This differential contribution is expected to provide new ideas for the prevention and treatment of thrombotic diseases by targeting FⅪ as a potentially safer anticoagulation strategy. Currently,an increasing number of FⅪ inhibitors are entering phaseⅢ clinical trials,and although these inhibitors showed promising clinical potential,the strategies for monitoring and reversing the effects of these inhibitors remain unclear,which poses new challenges for laboratory monitoring and clinical practice. This review,based on the physiological function of FⅪ and FⅪ inhibitors under study,systematically explored the laboratory evidence of coagulation activity linked to these inhibitors,summarized potential methods of reversal in combination with the treatment protocols of inherited FⅪ deficiency,which provided certain references for the development of clinical treatment protocols and reversal strategies.
【Key words】 Anticoagulants;Factor Ⅺ;Thrombosis;Anticoagulants;Drug monitoring;Reversal
动脉栓塞和静脉栓塞是造成全球疾病负担的重要因素之一,严重威胁人类健康并成为导致死亡的重要原因[1-2],抗凝疗法可有效预防和治疗血栓性疾病。自1990年以来,新的抗凝剂不断问世,直接口服抗凝剂(DOACs)如阿哌沙班、利伐沙班、达比加群酯等是第一类进入临床实践的靶向抗凝药物[3]。尽管DOACs在预防和治疗方面取得了显著进展,但其使用仍然伴随着一定的出血风险,甚至可能导致危及生命的并发症,如颅内出血和消化道出血等[4]。
鉴于潜在的出血风险,临床迫切需要更安全的抗凝药物。抗凝治疗的核心目标是在减少血栓形成的同时,最大限度地减少对正常生理止血的干扰。近年来,为了克服现有抗凝剂的局限性,研究人员开始转向对新型抗凝剂的研究[5]。Ⅺ因子(FⅪ)在病理性血栓的形成中扮演着关键角色,而在常规生理止血过程中的作用相对较小[6-7]。因此,以FⅪ为靶点的治疗策略受到广泛关注,这些策略在不干扰生理性止血机制的前提下,显示出有效阻止病理性血栓形成的可能性[8]。而在使用FⅪ抑制剂的同时,了解其抗凝监测方法及逆转策略也尤为重要。本综述主要介绍了当前研究中的FⅪ抑制剂,并深入探讨与这些药物相关的实验室检测抗凝活性的证据以及逆转策略。
1 FⅪ抑制剂概览
1.1 FⅪ生理功能
FⅪ参与凝血级联反应中内源性凝血途径的一部分,由肝脏合成并分泌至血液中,可被Ⅻa因子或凝血酶激活,继而将Ⅸ因子水解为Ⅸa因子,放大下游共同途径,产生凝血酶和最终产物纤维蛋白[9]。凝血过程可分为3个相互重叠的阶段,即启动、放大和扩增,启动阶段对于生理性止血和病理性血栓形成很重要,这一阶段主要依赖于组织因子与活化Ⅶ因子(即外源性途径)的相互作用,会生成早期、少量的凝血酶。随后在放大和扩增阶段,凝血酶激活血小板和其他凝血因子(包括FⅪ),进一步产生足量凝血酶[10]。FⅪ相对于独立于凝血过程的启动阶段,启动阶段生成的少量凝血酶以及纤维蛋白即可形成有效的止血血栓,随后FⅪ被凝血酶激活并级联放大凝血酶的生成。因此FⅪ在生理性止血过程中并非必不可少,相反,FⅪ正反馈放大凝血酶的生成可能是病理血栓形成中的一个重要因素[11-13]。动物模型和流行病学研究均进一步证实了这一点,显示FⅪ主要影响病理性血栓形成,对正常止血的影响较小。例如,FⅪ缺乏的小鼠模型显示了对血栓形成的抵抗力,同时并未出现明显的止血异常[14]。人类遗传性Ⅺ因子缺乏(血友病C)患者同样表现出较低的心血管事件风险,尤其是静脉血栓栓塞,但没有增加危及生命出血的发生风险[9,15]。此外,FⅪ水平升高与血栓性心血管事件风险增加有关,如静脉血栓形成和缺血性脑卒
中[5,9]。
1.2 FⅪ抑制剂分类
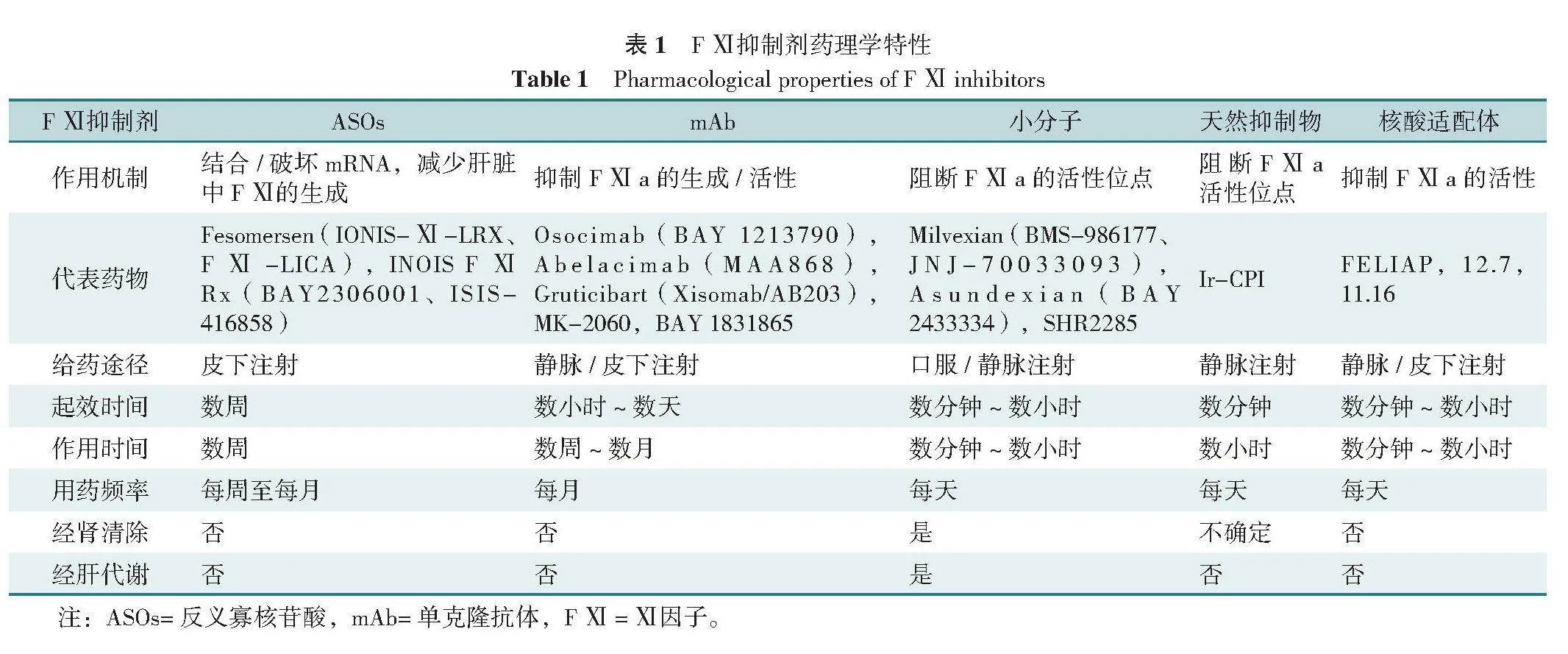
近年来,多种FⅪ抑制剂被研发出来,以期在不影响正常止血的前提下阻止病理性血栓的形成。目前研究的FⅪ抑制剂可分为5大类,包括反义寡核苷酸(ASOs)、单克隆抗体(mAb)、小分子、天然抑制剂和核酸适配体(表1)[3]。其中ASOs、mAb、小分子已进入临床试验阶段,而靶向FⅪ的核酸适配体和天然抑制物尚处于更早期阶段[3,16-17]。
2 FⅪ抑制剂抗凝活性评估
虽然目前的研究结果表明,相较于DOACs和肝素,FⅪ抑制剂的出血风险减少[16-17],可能无需定期常规监测,但对于接受手术/有创操作的患者,仍会有出血的风险,需监测凝血功能。目前FⅪ抑制剂仍处于临床研发阶段,尚无指南建议采用何种凝血监测,下面将根据现有临床试验总结FⅪ抑制剂对凝血检查的影响。
2.1 活化部分凝血活酶时间(APTT)
APTT通过接触活化来评估Ⅻ因子、Ⅺ因子、Ⅸ因子、Ⅷ因子、Ⅹ因子、Ⅴ因子、凝血酶原和纤维蛋白原水平(内源性途径和共同途径)[18]。FⅪ抑制剂在体内[19-21]和体外[22-23]研究中普遍表现为剂量依赖性的APTT延长。其剂量-反应关系呈曲线形,高浓度下曲线趋于平缓,这使得在较高浓度时难以对药物进行定量评估。尤其是接近APTT平台期时,这可能是因为FⅪ抑制剂已经达到最大可能的药物效应[24]。尽管使用相同种类的FⅪ抑制剂,但不同实验室采用的APTT试剂对药物的敏感性存在差异。在评估小分子型FⅪ抑制剂(Milvexian)在混合人血浆中的抗凝活性时,WONG等[25]使用不同的APTT试剂,发现APTT增加至基线的1.5倍和2.0倍时所对应的Milvexian血浆浓度分别为0.16~0.43 µM和0.44~2.10 µM。这一发现表明,虽然APTT能够反映药物效应的存在,但无法进行定量评估。因此,每个实验室均应明确其使用的APTT试剂种类,并确定该试剂对FⅪ抑制剂的敏感性,以制订APTT监测FⅪ抑制剂的安全治疗范围。
2.2 凝血酶原时间(PT)和国际标准化比值(INR)
PT基于凝血块的测定,将凝血活酶(组织因子、磷脂)和钙添加到枸橼酸抗凝的乏血小板血浆中,用于评估Ⅶ因子、Ⅹ因子、Ⅴ因子、凝血酶原和纤维蛋白原水平,主要涵盖外源性和共同途径[26]。由于存在多种凝血酶原试剂,因此引入了INR以实现不同实验室之间的标准化[20]。相较于APTT,FⅪ抑制剂对PT和INR没有显著影响[19-28]。FⅪ主要影响内源性途径[3],而PT主要反映外源性和共同途径的凝血,因此研究者们主要聚焦于APTT。以上研究结果表明,对于使用FⅪ抑制剂的患者,若PT延长提示患者可能出现了与该药物无关的凝血障碍。
2.3 FⅪ活性检测
与APTT一样,FⅪ活性在许多FⅪ抑制剂的Ⅰ期和Ⅱ期临床试验中被用作药效学生物标志物。FⅪ活性的测定一般基于APTT原理,即将待测血浆与耗尽FⅪ活性的人血浆混合,将测得的APTT时间与标准品的APTT时间比较,根据标准曲线获得FⅪ活性[29]。
XU等[30]研究显示,血浆内未结合的SHR2285及其主要代谢物SHR164471的总和浓度与FⅪ抑制率呈非线性关系,在较低浓度范围内呈线性、浓度依赖关系,高浓度时相关性较弱。BÜLLER等[24]发现在预防患者全膝关节置换术后静脉血栓形成方面,200 mg ISIS41685的方案不劣于依诺肝素,而300 mg ISIS416858的方案优于依诺肝素,这两种剂量可以使FⅪ活性降低约70%和80%,且三组之间出血风险无统计学差异。VERHAMM等[17]比较了术后单次注射Abelacimab与每日1次皮下注射依诺肝素在预防全膝关节置换术后患者静脉血栓的作用,发现30 mg Abelacimab方案组的疗效不劣于依诺肝素,75 mg和150 mg Abelacimab方案组的疗效优于依诺肝素,且出血风险均较低,服用150 mg Abelacimab可使FⅪ活性降低率≥80%,可持续4周以上(用药后第2~29天)[31]。WEITZ等[19]在Osocimab(BAY1213790)的Ⅱ期试验中发现术后单次给予Osocimab 0.6、1.2和1.8 mg/kg,在预防膝关节置换术患者术后深静脉血栓方面,与依诺肝素相比符合非劣效性标准,术前1.8 mg/kg剂量的Osocimab优于依诺肝素,服用0.60和1.25 mg/kg剂量的FⅪ活性最大可降至40%~60%[32]。WEITZ等[33]研究显示,对于全膝关节置换术的患者,每日服用剂量为100、200、400 mg
Milvexian(BMS-986177/JNJ-70033093)的患者术后深静脉血栓发生率显著低于依诺肝素,健康志愿者每日应用Milvexian 70、200、500 mg,FⅪ活性最多可被抑制约40%、65%和80%[27]。
综上,FⅪ抑制剂的应用会导致FⅪ活性呈剂量依赖性降低[34],从而在血栓栓塞事件的预防上展现出临床效益,并可能优于肝素。然而,确切的FⅪ活性降低程度,以实现最优血栓预防效果并最小化出血风险仍有待确定。特别是在进行大型手术时,如何控制FⅪ活性以保证疗效和安全,需要进一步研究来明确。
2.4 粘弹性检测
粘弹性检测是指对全血样本中凝块形成的物理特性进行实时评估的一组凝血检测方法,包括血栓弹力图(TEG)、旋转式血栓弹力仪(ROTEM)以及通过共振超声波弹性估计法(Quantra)[35]。因其无需分离血浆、检测时间短、易用等优势,在手术室和急诊中有很大的应用前景[36]。然而,粘弹性检测关于FⅪ抑制剂的研究目前相对较少。服用FⅪ抑制剂(如Asundexian、BAY 1831865和BAY 12313790)可以使ROTEM CT(凝血时间)剂量依赖性增加[25,32,34]。由此可见,粘弹性检测或许可以用于监测FⅪ抑制剂。
2.5 其他实验室评估
目前小分子FⅪ抑制剂可经肝肾代谢[3],对于使用该类抑制剂特别是患有影响肝肾功能疾病的患者,建议定期监测肝肾功能。尽管轻中度肝功能受损患者在单次服用60 mg Milvexian后耐受性良好[29],但该研究仅基于小样本观察,且主要涉及轻中度肝功能受损患者,需要进行更大规模的研究来全面了解Milvexian在临床应用中的安全性。且许多凝血因子由肝脏合成,严重肝功能损伤可能缺乏多种凝血因子,对凝血的影响不仅局限于对药物代谢的影响。PERERA等[37]发现较于肾功能正常患者,中重度肾功能不全的患者单次口服60 mg Milvexian的t1/2延长。此外,终末期肾病患者同时具备血栓形成和出血的高风险,FⅪ抑制剂在该类患者中的安全性仍待研究[9]。总体而言,需要更广泛的临床数据完善肝肾功能不全患者的药物剂量策略,以实现个体化治疗。
3 逆转策略
尽管前期临床试验提示FⅪ抑制剂的出血风险可能很低[38],但部分抑制剂如mAb疗程超过30 d[23],若出现紧急情况时这些长效抑制剂可能带来一些问题。即使是短效抑制剂,当患者需要接受紧急手术或已出现严重急性出血时,也可能面临生命危险。在处理这类紧急情况时,深刻理解这些抑制剂的出血处理和逆转策略变得至关重要[39-40]。由于FⅪ抑制剂目前仍处于临床试验阶段,尚无体内研究证明相关有效的逆转策略,因此,将从遗传性Ⅺ因子缺乏患者的出血预防和治疗中汲取经验,用于管理使用FⅪ抑制剂的患者。
抗纤溶药物(如氨甲环酸或ε-氨基己酸)单用或与FⅪ补充治疗联用已广泛应用于遗传性Ⅺ因子缺乏患者,这些药物可有效降低出血风险和治疗出血[41],尤其是对高纤溶活性部位的出血,如口腔、鼻腔和泌尿生殖道。遗传性Ⅺ因子缺乏患者严重急性出血时应接受FⅪ补充治疗,包括新鲜冰冻血浆(FFP)和FⅪ浓缩物,联用或不联用抗纤溶药物[41]。大多数外科手术不需要预防性补充FⅪ,尤其是在不涉及纤溶区域时[42-43]。FⅪ浓缩物中的微量FⅪa可能会导致血栓风险,即使目前的制剂中加入肝素和抗凝血酶,但仍有血栓形成的风险[41,44]。而FFP的主要安全问题则是可能导致容量超负荷,给予15~20 ml/kg剂量才足以使FⅪ水平维持在30%~45%[45],因此在使用前要充分评估液体过剩风险。部分遗传性Ⅺ因子缺乏患者在暴露于外源性FⅪ后会产生抑制物(FⅪ同种抗体),危险因素尚不完全明确,对于产生了FⅪ抑制物(同种抗体)的重度FⅪ缺乏患者,使用FⅪ补充制品可能无法提高血浆FⅪ水平,需要使用重组活化因子Ⅶ(rFⅦa)或联合氨甲环酸[46-47]。
根据上述治疗遗传性Ⅺ因子缺乏症患者的经验,对于接受FⅪ抑制剂的患者在接受低风险手术(如阑尾切除术、白内障摘除术、皮肤活检等)时无需预防性补充FⅪ,若术后出现非危及生命的出血,可使用局部措施止血或者抗纤溶治疗(如氨甲环酸和ε-氨基乙酸)。若患者需要接受紧急的高风险手术或严重急性出血(如创伤后)时,可根据抑制剂作用原理选择应用FⅪ补充治疗或rFⅦa。ASOs抑制肝脏生成FⅪ[26,48],导致血浆中真正缺乏FⅪ,因此服用ASOs的患者或许可以使用FFP或FⅪ浓缩物逆转药物作用。部分mAb(如AB203和Abecimab)通过结合FⅪ以抑制FⅪ活化来达到抗凝的作用[23,49],FFP和FⅪ浓缩物可中和与FⅪ结合的抗FⅪ抗体,如果FⅪ抗体与FⅪ补充制品达到饱和状态,则超出部分的FⅪ可用于凝血。而针对FⅪa活性位点的抑制剂(如小分子Milvexian和mAb Osocimab)的药物作用无法被FⅪ补充制品逆转[21,33],因为这类患者体内的FⅪ浓度并不低,对于该类患者,可能需要设计针对药物的特异性逆转剂或使用rFⅦa。此外,在对以上治疗缺乏反应时,使用rFⅦa配合抗纤溶治疗可能是有效的。但请注意,以上均为基于遗传性Ⅺ因子缺乏患者的凝血管理,关于使用FⅪ抑制剂的患者的临床数据尚不充分,未来仍需进一步的研究和临床实践经验的积累,以完善相关逆转策略。
4 前景
FⅪ不参与血栓启动,而主要通过凝血酶对其的激活从而正反馈地形成稳定的血栓[10]。FⅪ抑制剂通过靶向FⅪ实现抗血栓目的[15],相较于目前的药物可能成为更为安全的抗凝血剂。虽然已有多个FⅪ抑制剂完成或正在进行Ⅱ期临床试验,并正在进入更为广泛的Ⅲ期临床试验[50],但在这些药物成为标准治疗的一部分之前,仍需要更广泛的临床数据以支持其疗效。
大量已发表的临床研究评估了凝血试验与FⅪ抑制剂水平之间的关系,能监测到药物治疗范围的试验可以帮助临床医生更好地调整用药方案,减少血栓复发的风险,同时减少出血风险。但是,目前仍缺乏足够临床证据,不论是关于何种凝血检查更适合指导FⅪ抑制剂治疗,还是将凝血指标控制在何种范围以产生不劣于目前临床药物的抗血栓效应且不增加出血风险。医护人员需要对这些新兴治疗方式有充分的了解,以便优化治疗策略,降低血栓复发和出血风险。本文在FⅪ的生理作用和FⅪ抑制剂作用机制的基础上总结了与FⅪ抑制剂相关的凝血监测的研究进展。同时,结合遗传性Ⅺ因子缺乏患者的治疗策略提出了应用FⅪ抑制剂患者遇到紧急情况时的逆转策略。然而,需要更进一步的研究来明确药物水平、凝血检测结果和临床结果之间的关系以及上述逆转策略的有效性和安全性。
作者贡献:陈越秀负责文章的构思与设计、研究资料的收集与整理、绘制表格、论文撰写;姚媛媛、孙大伟、唐志峰负责论文修订;王颖、吴超敏、赵麟茜负责研究资料的收集与整理;张冯江负责文章的构思与设计、论文修订、文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
张冯江https://orcid.org/0009-0002-4913-5865
参考文献
WENDELBOE A M,RASKOB G E. Global burden of thrombosis:epidemiologic aspects[J]. Circ Res,2016,118(9):1340-1347. DOI:10.1161/CIRCRESAHA.115.306841.
KHAN F,TRITSCHLER T,KAHN S R,et al. Venous thromboembolism[J]. Lancet,2021,398(10294):64-77. DOI:10.1016/S0140-6736(20)32658-1.
DE CATERINA R,PRISCO D,EIKELBOOM J W. FactorⅪ inhibitors:cardiovascular perspectives[J]. Eur Heart J,2023,
44(4):280-292. DOI:10.1093/eurheartj/ehac464.
RUFF C T,GIUGLIANO R P,BRAUNWALD E,et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation:a meta-analysis of randomised trials[J]. Lancet,2014,383(9921):955-962. DOI:10.1016/S0140-6736(13)62343-0.
AL-HORANI R A. FactorⅪ(a) inhibitors for thrombosis:an updated patent review (2016-present)[J]. Expert Opin Ther Pat,2020,30(1):39-55. DOI:10.1080/13543776.2020.1705783.
LAKSHMANAN H H S,ESTONILO A,REITSMA S E,et al. Revised model of the tissue factor pathway of thrombin generation:role of the feedback activation of FⅪ[J]. J Thromb Haemost,2022,20(6):1350-1363. DOI:10.1111/jth.15716.
WHEELER A P,GAILANI D. The intrinsic pathway of coagulation as a target for antithrombotic therapy[J]. Hematol Oncol Clin North Am,2016,30(5):1099-1114. DOI:10.1016/j.hoc.2016.05.007.
XIE Z L,MENG Z W,YANG X X,et al. FactorⅪa inhibitors in anticoagulation therapy:recent advances and perspectives[J]. J Med Chem,2023,66(8):5332-5363. DOI:10.1021/acs.jmedchem.2c02130.
GIGANTE B,TEN CATE H. FactorⅪ inhibitors in patients with cardiovascular disease and a high risk of bleeding:a cautionary tale[J]. Nat Rev Cardiol,2023,20(8):511-512. DOI:10.1038/s41569-023-00872-4.
HOFFMAN M,MONROE D M 3rd. A cell-based model of hemostasis[J]. Thromb Haemost,2001,85(6):958-965.
GRECO A,LAUDANI C,SPAGNOLO M,et al. Pharmacology and clinical development of factorⅪ inhibitors[J]. Circulation,2023,147(11):897-913. DOI:10.1161/CIRCULATIONAHA.122.062353.
HARRINGTON J,PICCINI J P,ALEXANDER J H,et al. Clinical evaluation of factor Ⅺa inhibitor drugs:JACC review topic of the week[J]. J Am Coll Cardiol,2023,81(8):771-779. DOI:10.1016/j.jacc.2022.11.057.
FREDENBURGH J C,WEITZ J I. News atⅪ:moving beyond factor Ⅹa inhibitors[J].Journal of Thrombosis and Haemostasis,2023,21(7):1692-1702. DOI:10.1016/j.jtha.2023.04.021.
TILLMAN B F,GRUBER A,MCCARTY O J T,et al. Plasma contact factors as therapeutic targets[J]. Blood Rev,2018,
32(6):433-448. DOI:10.1016/j.blre.2018.04.001.
KOULAS I,SPYROPOULOS A C. A review of FⅪa inhibition as a novel target for anticoagulation[J]. Hamostaseologie,2023,
43(1):28-36. DOI:10.1055/a-1984-7021.
PICCINI J P,CASO V,CONNOLLY S J,et al. Safety of the oral factorⅪa inhibitor asundexian compared with apixaban in patients with atrial fibrillation(PACIFIC-AF):a multicentre,randomised,double-blind,double-dummy,dose-finding phase 2 study[J]. Lancet,2022,399(10333):1383-1390. DOI:10.1016/S0140-6736(22)00456-1.
VERHAMME P,YI B A,SEGERS A,et al. Abelacimab for prevention of venous thromboembolism[J]. N Engl J Med,2021,385(7):609-617. DOI:10.1056/NEJMoa2105872.
LOIZOU E,MAYHEW D J,MARTLEW V,et al. Implications of deranged activated partial thromboplastin time for anaesthesia and surgery[J]. Anaesthesia,2018,73(12):1557-1563. DOI:10.1111/anae.14344.
WEITZ J I,BAUERSACHS R,BECKER B,et al. Effect of osocimab in preventing venous thromboembolism among patients undergoing knee arthroplasty:the FOXTROT randomized clinical trial[J]. JAMA,2020,323(2):130-139. DOI:10.1001/jama.2019.20687.
KAR S,BANKSTON P,AFOSAH D K,et al. Lignosulfonic acid sodium is a noncompetitive inhibitor of human factorⅪa[J]. Pharmaceuticals,2021,14(9):886. DOI:10.3390/ph14090886.
YI B A,FREEDHOLM D,WIDENER N,et al. Pharmacokinetics and pharmacodynamics of Abelacimab (MAA868),a novel dual inhibitor of FactorⅪ and Factor Ⅺa[J]. J Thromb Haemost,2022,20(2):307-315. DOI:10.1111/jth.15577.
KUBITZA D,HECKMANN M,DISTLER J,et al. Pharmacokinetics,pharmacodynamics and safety of BAY 2433334,a novel activated factorⅪ inhibitor,in healthy volunteers:a randomized phase 1 multiple-dose study[J]. Br J Clin Pharmacol,2022,88(7):3447-3462. DOI:10.1111/bcp.15230.
NOWOTNY B,THOMAS D,SCHWERS S,et al. First randomized evaluation of safety,pharmacodynamics,and pharmacokinetics of BAY 1831865,an antibody targeting coagulation factorⅪ and factor Ⅺa,in healthy men[J]. J Thromb Haemost,2022,
20(7):1684-1695. DOI:10.1111/jth.15744.
BÜLLER H R,BETHUNE C,BHANOT S,et al. Factor Ⅺantisense oligonucleotide for prevention of venous thrombosis[J]. N Engl J Med,2015,372(3):232-240. DOI:10.1056/NEJMoa1405760.
WONG P C,CRAIN E J,BOZARTH J M,et al. Milvexian,an orally bioavailable,small-molecule,reversible,direct inhibitor of factor Ⅺa:in vitro studies and in vivo evaluation in experimental thrombosis in rabbits[J]. J Thromb Haemost,2022,20(2):399-408. DOI:10.1111/jth.15588.
MAIER C L,SNIECINSKI R M. Anticoagulation monitoring for perioperative physicians[J]. Anesthesiology,2021,135(4):738-748. DOI:10.1097/ALN.0000000000003903.
PERERA V,WANG Z Q,LUETTGEN J,et al. First-in-human study of milvexian,an oral,direct,small molecule factorⅪa inhibitor[J]. Clin Transl Sci,2022,15(2):330-342. DOI:10.1111/cts.13148.
BEALE D,DENNISON J,BOYCE M,et al. ONO-7684 a novel oral FⅪa inhibitor:safety,tolerability,pharmacokinetics and pharmacodynamics in a first-in-human study[J]. Br J Clin Pharmacol,2021,87(8):3177-3189. DOI:10.1111/bcp.14732.
PERERA V,ABELIAN G,LI D S,et al. Single-dose pharmacokinetics of milvexian in participants with mild or moderate hepatic impairment compared with healthy participants[J]. Clin Pharmacokinet,2022,61(6):857-867. DOI:10.1007/s40262-022-01110-9.
XU J Y,ZHAO N,HUANG J,et al. The safety,pharmacokinetics,and pharmacodynamics of SHR2285,an oral small molecule factorⅪa inhibitor,in healthy Chinese volunteers[J]. Clin Drug Investig,2023,43(6):435-445. DOI:10.1007/s40261-023-01281-8.
KOCH A W,SCHIERING N,MELKKO S,et al. MAA868,a novel FⅪ antibody with a unique binding mode,shows durable effects on markers of anticoagulation in humans[J]. Blood,2019,133(13):1507-1516. DOI:10.1182/blood-2018-10-880849.
THOMAS D,THELEN K,KRAFF S,et al. BAY 1213790,a fully human IgG1 antibody targeting coagulation factor Ⅺa:first evaluation of safety,pharmacodynamics,and pharmacokinetics[J]. Res Pract Thromb Haemost,2019,3(2):242-253. DOI:10.1002/rth2.12186.
WEITZ J I,STRONY J,AGENO W,et al. Milvexian for the prevention of venous thromboembolism[J]. N Engl J Med,2021,385(23):2161-2172. DOI:10.1056/NEJMoa2113194.
THOMAS D,KANEFENDT F,SCHWERS S,et al. First evaluation of the safety,pharmacokinetics,and pharmacodynamics of BAY 2433334,a small molecule targeting coagulation factor Ⅺa[J]. J Thromb Haemost,2021,19(10):2407-2416. DOI:10.1111/jth.15439.
FARAONI D,DINARDO J A. Viscoelastic hemostatic assays:update on technology and clinical applications[J]. Am J Hematol,2021,96(10):1331-1337. DOI:10.1002/ajh.26285.
BAREILLE M,LECOMPTE T,MULLIER F,et al. Are viscoelastometric assays of old generation ready for disposal? comment on volod et al. viscoelastic hemostatic assays:a primer on legacy and new generation devices. J. clin. med. 2022,11,860[J]. J Clin Med,2023,12(2):477. DOI:10.3390/jcm12020477.
PERERA V,ABELIAN G,LI D S,et al. Single-dose pharmacokinetics of milvexian in participants with normal renal function and participants with moderate or severe renal impairment[J]. Clin Pharmacokinet,2022,61(10):1405-1416. DOI:10.1007/s40262-022-01150-1.
GALLI M,LABORANTE R,ORTEGA-PAZ L,et al. FactorⅪ inhibitors in early clinical trials:a meta-analysis[J]. Thromb Haemost,2023,123(6):576-584. DOI:10.1055/a-2043-0346.
VAN ES N,DE CATERINA R,WEITZ J I. Reversal agents for current and forthcoming direct oral anticoagulants[J]. Eur Heart J,2023,44(20):1795-1806. DOI:10.1093/eurheartj/ehad123.
SALOMON O,GAILANI D. A proposal for managing bleeding in patients on therapeutic factorⅪ(a) inhibitors[J]. J Thromb Haemost,2022,20(1):32-38. DOI:10.1111/jth.15579.
JAMES P,SALOMON O,MIKOVIC D,et al. Rare bleeding disorders - bleeding assessment tools,laboratory aspects and phenotype and therapy of FⅪ deficiency[J]. Haemophilia,2014,20 Suppl 4(4):71-75. DOI:10.1111/hae.12402.
FABIAN I D,SACHS D,MOISSEIEV J,et al. Cataract extraction without prophylactic treatment in patients with severe factor Ⅺdeficiency[J]. Am J Ophthalmol,2009,148(6):920-924.e1. DOI:10.1016/j.ajo.2009.07.013.
SALOMON O,STEINBERG D M,SELIGSHON U. Variable bleeding manifestations characterize different types of surgery in patients with severe factor Ⅺ deficiency enabling parsimonious use of replacement therapy[J]. Haemophilia,2006,12(5):490-493. DOI:10.1111/j.1365-2516.2006.01304.x.
DUGA S,SALOMON O. Congenital factorⅪ deficiency:an update[J]. Semin Thromb Hemost,2013,39(6):621-631. DOI:10.1055/s-0033-1353420.
GUO W J,CHEN W Y,YU X R,et al. Intraoperative thromboelastography-guided transfusion in a patient with factor Ⅺdeficiency:a case report[J]. World J Clin Cases,2022,
10(1):242-248. DOI:10.12998/wjcc.v10.i1.242.
LIVNAT T,TAMARIN I,MOR Y,et al. Recombinant activated factorⅦ and tranexamic acid are haemostatically effective during major surgery in factorⅪ-deficient patients with inhibitor antibodies[J]. Thromb Haemost,2009,102(3):487-492. DOI:10.1160/TH09-03-0172.
SALOMON O,BUDNIK I,AVISHAI E,et al. Single Low Dose of rFⅦa Combined with antifibrinolytic agent is a simple and safe treatment for factorⅪ-deficient patients undergoing surgery[J]. Thromb Haemost,2019,119(12):1927-1932. DOI:10.1055/s-0039-1696685.
LIU Q,BETHUNE C,DESSOUKI E,et al. ISIS-FXIRx,a novel and specific antisense inhibitor of factorⅪ,caused significant reduction in FⅪantigen and activity and increased aPTT without causing bleeding in healthy volunteers[J]. Blood,2011,118:209. DOI:10.1182/BLOOD.V118.21.209.209.
LORENTZ C U,TUCKER E I,VERBOUT N G,et al. The contact activation inhibitor AB023 in heparin-free hemodialysis:results of a randomized phase 2 clinical trial[J]. Blood,2021,138(22):2173-2184. DOI:10.1182/blood.2021011725.
VEDOVATI M C,BECATTINI C,AGNELLI G. A new strategy for anticoagulation:the factorⅪ inhibitors[J]. Eur J Intern Med,2023,116:8-15. DOI:10.1016/j.ejim.2023.08.001.
(收稿日期:2024-01-10;修回日期:2024-03-25)
(本文编辑:赵跃翠)
基金项目:浙江省自然科学基金资助项目(LY23H090015)
引用本文:陈越秀,姚媛媛,孙大伟,等.新型抗凝药Ⅺ因子抑制剂监测方法及逆转策略研究进展[J]. 中国全科医学,2025,28(3):379-384. DOI:10.12114/j.issn.1007-9572.2024.0046.[www.chinagp.net]
CHEN Y X,YAO Y Y,SUN D W,et al. Advances in monitoring and reversal strategies for the novel anticoagulants factorⅪ inhibitors[J].Chinese General Practice,2025,28(3):379-384.
© Editorial Office of Chinese General Practice. This is an open access article under the CC BY-NC-ND 4.0 license.

