GB/T 19634—2021和GB/T 19634—2005版本变化解读
摘 要:本文对GB/T 19634《体外诊断检验系统 自测用血糖监测系统通用技术条件》2021年版本和2005年版本差异进行解析,旨在阐述两个版本之间的主要变动,包括适用范围、定义、修改血糖仪和血糖试条系统准确度、红细胞压积要求、血糖仪安全要求、血糖仪电磁兼容要求、血糖仪和血糖试条系统准确度试验血糖样品要求、红细胞压积试验方法、血糖仪安全试验方法、电磁兼容试验方法等。对以上多个方面的变化进行解读,有助于对血糖仪相关检测技术进行更深入的了解及应用。
关键词:糖尿病,体外诊断检验系统,自测用血糖监测系统
DOI编码:10.3969/j.issn.1002-5944.2024.19.031
0 引 言
糖尿病是临床最为常见的慢性疾病,且现在糖尿病逐渐趋向于年轻化,当糖尿病患者的血糖水平持续性地无法得到有效控制,长期保持在较高浓度水平时,将会引起严重的并发症,包括视网膜病变、肾功能损伤、血管病变、神经损伤、高血压以及心脏病等。因此,使用自测用血糖仪来测定患者的血糖浓度水平,根据检测数据及时采取相应的治疗措施,对于患者保持血糖水平稳定,防止并发症的发生极其重要[1]。
GB/T 19634—2021《体外诊断检验系统 自测用血糖监测系统通用技术条件》(以下简称“新标准”)已于2023年5月1日起开始正式执行,与GB/ T19634—2005相比,新标准在内容上进行了一些调整,增加、修改了部分条款,同时还对某些术语给出了新的定义;与ISO 15197: 2013相比,新版标准进行技术性差异的调整,以便适应我国国情。
1 标准内容的主要变化
1.1 适用范围
新标准新增了适用范围里不适用情形:
——以诊断糖尿病为目的的血糖浓度测定;
——具有等级测定值的测定程序(如可视性半定量测定程序)、无创性血糖监测系统、连续血糖监测系统[2]。
目的是将自测用血糖监测系统与大型全自动生化分析仪等可实现血糖浓度测定的检测系统区别开,也说明标准中提到的自测用血糖监测系统不同于可视性半定量测定程序、无创性血糖监测系统及连续血糖监测系统(CGM)。
1.2 规范性引用文件
新标准“规范性引用文件”更改为GB/ T 191《包装储运图示标志》,GB/ T 14710《医用电器环境要求及试验方法》,GB / T 18 2 6 8 .1和GB / T18268.26《测量、控制和实验室用的电设备 电磁兼容性要求 第26部分:特殊要求 体外诊断(IVD)医疗设备》,以及GB/T 29791.4《体外诊断医疗器械 制造商提供的信息(标示)第4部分:自测用体外诊断试剂》及GB/T 29791.5《体外诊断医疗器械制造商提供的信息(标示)第5部分:自测用体外诊断仪器》。
1.3 术语和定义
新标准在“术语和定义”中新增了“自测”的定义,明确说明了自测是指由非专业人员进行的用于评估个体健康状况的检验,并修改了“准确度”“精密度”“重复性”“批”“标签”的定义,做了更准确的解释。
1.4 血糖仪和血糖试条系统准确度
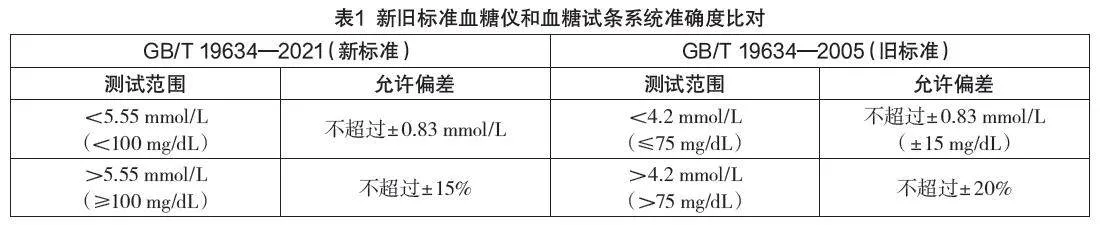
新标准对于“血糖仪和血糖试条系统准确度”要求做了修改,主要针对测试范围和允许偏差的内容做了较大更改,如表1所示。
从表1可以看出,新标准分界点的血糖浓度水平由旧标准的4.2 mmol/L改为5.55 mmol/L,<5.55mmol/L的范围允许绝对偏差与原来的4.2 mmol/L保持一致,≥5.55 mmol/L的范围允许相对偏差更为严格,提高至±15%[3]。新标准血糖仪和血糖试条系统准确度与血糖仪和血糖试条测量重复性测试范围保持一致。将血糖浓度分界点提高,说明从标准层面对血糖浓度测定的准确度要求更为严格,尤其是低值部分,更精确的葡萄糖检测结果能提升测试的可靠性,进而使糖尿病患者通过做出明智的治疗选择,更好地掌控他们的疾病管理[4]。
1.5 红细胞压积的要求
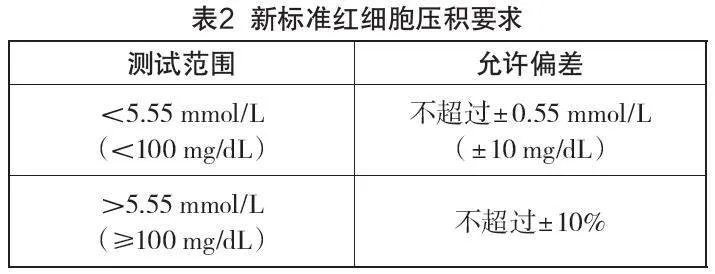
新标准增加了红细胞压积的要求,如表2所示。
新标准中对于红细胞压积的试验样品、实验程序、样本准备、评价程序、数据分析和结果呈现都做了详细说明,新增这个指标的目的是确定红细胞压积对于血糖监测系统测量值的影响,一般正常健康男性的红细胞压积在40%~50%,健康女性在35%~45%。红细胞压积范围与血糖仪的关系就在于,一些同时患有糖尿病和贫血、慢性心肺疾病的患者以及孕妇,其红细胞压积会出现增多或减少的情况,而市面上大部分血糖仪的红细胞压积范围仅能覆盖正常值。上述患者若使用常规血糖仪,其检测结果可能会出现一定偏差,上述患者对血糖浓度检测的依赖性远高于正常人。为了覆盖到这部分人,使得这部分人的血糖浓度的测定准确,新版标准增加了红细胞压积指标,以验证不同红细胞压积情况对血糖仪血糖浓度检测值的影响。
红细胞压积(HCT)是指血液经过抗凝处理并离心后,红细胞在全部血液中所占的体积比例。不同群体的血细胞比容(HCT)数值存在差异,一般情况下,男性的HCT正常范围会高于女性的正常范围,新生儿的HCT水平会高于一般人群的正常值。使用全血在末梢毛细血管进行的血糖检测中,红细胞里的葡萄糖比血浆里同等体积的少。这可能导致由于HCT的不同,使得血糖检测系统得到的结果有误差。为确保血糖监测系统测试精度,血液样本中HCT值必须在产品说明书指定的范围内。
(1)其中试验样品应符合的要求
a)静脉血,样本可以是1个或多个供者提供;
b)样本需在23℃±5℃温度下平衡,在评价过程中,温度变化不超过±3℃;
c)血糖监测系统和参考分析方法测量应在样本收集24 h内进行。
(2)试验流程
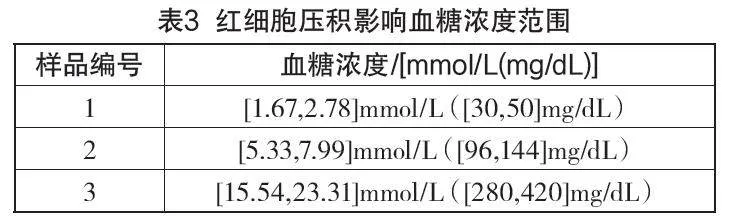
a)评价红细胞压积影响效应,至少需要满足5个压积水平和3个血糖浓度的样本。血糖浓度划分间隔见表3。评价试验也可以扩展包括其他血糖浓度和红细胞压积。
b)多因素设计(红细胞压积×血糖浓度)优先考虑。其他试验设计有统计学依据的也可以接受。
c)选择精密度和正确度符合要求的参考测量方法和/或参考仪器(一般选择已经上市的同种类产品作为参考仪器),用来测量血糖和压积的参考值。
(3)样本准备
a)将血液进行血浆、血细胞分离,然后通过调整血浆、血细胞混合比例来得到所需红细胞压积样本。
b)最高和最低红细胞压积应当覆盖血糖监测系统所标称的红细胞压积范围。样本中间压积值应为42%±2%。
(4)具体操作步骤
a)调节血糖浓度以得到所需血糖值样本;
b)将混合血液样本平均分成5等份;
c)离心每份血;
d)搜集血浆;
e)重新将血细胞加入不同体积血浆以得到一系列样本,包括最高和最低红细胞压积水平;
f)将每一压积样本用参考测量方法和/或参考仪器进行测量;
g)将每一压积样本平均分成3等份。
(5)评价程序
在进行测量之前,每个样本都需要温和且充分的混合。以下是具体的执行步骤:
a)参考测量方法测量2次,计算平均值;
b)计算血糖监测系统的10次测量结果的平均值;
c)仪器测量结束后,用参考测量方法测试2次;
d)对比步骤a)和c)中的测量结果,以确认血液样本在评估期间是否保持稳定,目的是排除样本本身不稳定的因素。如果结果超出预先规定的要求[第一次结果和最后一次结果之间的差异在血糖浓度≤5.55 mmol/L(100 mg/dL)时gt;0.22 mmol/L(4mg/dL)或在血糖浓度gt;5.55 mmol/L(100 mg/dL)时gt;4%],那么这个样本的测量值将不被采用,需要使用另一样本重新进行测量评估,这里对测量值的要求是如果在规定血糖浓度范围内,绝对偏差或相对偏差超过固定值要求时,所测得血糖浓度的结果若产生异常偏差,无法判定是血糖样本稳定性造成的还是不同红细胞压积造成的,所以要遵循单一变量原则,首先要保证血液样本的稳定性,再去评估不同红细胞压积对血糖浓度测定值的影响。
(6)数据分析和结果呈现
分析每个血糖浓度和红细胞压积所得测量数据,按照下列要求进行分析。具体操作步骤如下:
a)对于每一样本,计算血糖监测系统测量的血糖值的平均值及参考测量方法测量值的平均值;
b)对于每一样本,计算血糖监测系统测量值(指血糖监测系统测量的血糖值的平均值)与参考值(指参考测量方法测量值的平均值)的绝对偏差和相对偏差,必须满足新标准表格2中血糖和血糖试条系统的精确度规定;
c)计算每个样本血糖偏倚平均值与中间水平血糖偏倚平均值的偏差,以确定红细胞压积对于血糖监测系统测量值的影响。
1.6 血糖仪环境试验
旧标准环境试验要求规定了具体年份,引用的是GB/T 14710—1993,新标准未指定具体年代号,未做特殊说明则可在引用时直接引用最新适用版本。
1.7 安全要求
旧标准安全要求引用的是GB 9706.1—1995和/或GB 4793.1—1995,新标准更改为GB 4793.1、YY 0648〔体外诊断(IVD)医用设备的专用要求〕、GB 9706.1中的适用规定。新标准未指定具体年代号,未做特殊说明则可在引用时可直接引用最新适用版本。
1.8 电磁兼容
关于电磁兼容,旧标准未做任何要求,新标准新增血糖仪电磁兼容要求,需要遵循的标准包含GB/T 18268.1、GB/T 18268.26以及YY 0505等三个标准。
1.9 血糖仪和血糖试条系统准确度血糖样品要求
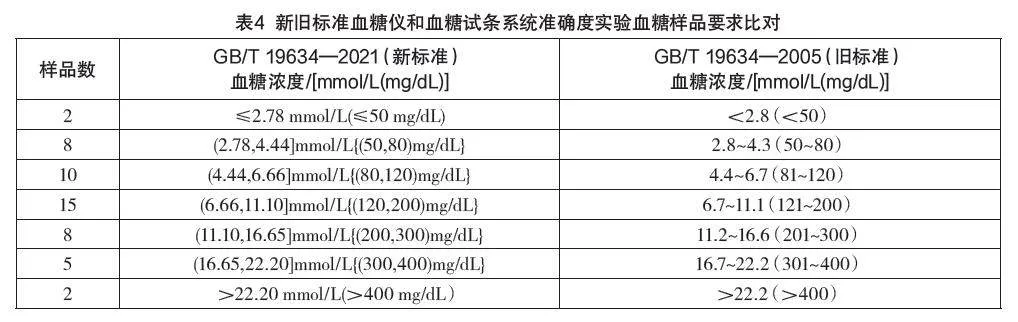
新标准血糖仪和血糖试条系统准确度实验中血糖样品要求更加具体,与旧版相比如表4所示。
由表4可以看出新标准对于浓度范围的分割更加清晰,且数据都精确到了小数点后两位,对样品要求更加明确细致。
2 其他变化
除以上描述的变化以外,新标准还有一些细节变化。例如将旧标准5.1条款中的“d)”进行了删除,不再需要具有溯源性的血糖参考物质;
新标准5.3条款中获得低浓度血样品的试验方法不止放置过夜,新增了可“使用制造商定义的孵育条件”进行获取,适用性更强;
血糖仪和血糖试条系统准确度的试验方法中删除了“回收试验”;
血糖试条批间差所使用的血糖试条由旧标准的“2个不同批号”改为了“3个不同批号”。
以上细节的变化都使得新标准在实际应用过程中更加清晰合理。
3 结 语
综上所述,新版标准在旧版标准的基础上结合国际标准ISO 15197[5]的内容,根据国内医疗器械发展情况,在内容上进行了优化修改,新增了部分旧标准未加入的性能测试指标,在样本要求方面更加明确清晰,有助于自测用血糖监测系统技术条件和国际标准的统一,加强了自测用血糖监测系统性能评估试验方法的适用性,使得血糖监测系统的性能评估更加全面和安全有效,有助于提高用户血糖自测准确率,同时也有利于自测用血糖监测系统在检测技术方面的发展。
参考文献
[1]杨青.无创及微创血糖仪研究进展[J].中国医疗器械信息,2019,25(12):23-24.
[2]体外诊断检验系统 自测用血糖监测系统通用技术条件:GB/T 19634—2021[S].2021.
[3]体外诊断检验系统 自测用血糖监测系统通用技术条件:GB/T 19634—2005[S].2005.
[4]In Vitro diagnostic test system—Requirements for bloodglucose monitoring systems for self-testing in managing diabetes mellitus: ISO 15197: 2013[S].2013.
[5]王煜非.解读I SO 1519 7: 2 013标准[J ].中国糖尿病杂志,2014,22(12):1149-1152.
作者简介
阮仕环,本科,工程师,主要从事医疗器械产品检测及法规研究工作。
余良清,本科,高级工程师,主要从事医疗器械产品检测及法规研究工作。
(责任编辑:张瑞洋)

