高效液相色谱-串联质谱法检测动物源性食品中泰地罗新残留
摘要" 为建立适用于动物源性食品中泰地罗新残留量检测的高效液相色谱-串联质谱法(HPLC-MS/MS),本研究对色谱、质谱、净化条件和定溶液等进行检测条件优化,建立了测定动物源性食品中泰地罗新残留量的检测方法,验证其线性范围、检出限,并以猪、牛、羊肉及其内脏等动物源性食品为试验样品,测定其回收率及精密度。结果表明,色谱条件以Aglient ZORBAX SB C18为色谱柱,乙腈-0.1%甲酸水为流动相;质谱条件以734.4 m/z为母离子,98.2和174.4 m/z为子离子;净化条件以HLB(150"mg,6"mL)固相萃取柱为净化柱,5"mL 50%甲醇水溶液为上样溶液,5"mL 5%氨水乙腈为洗脱溶剂;定容液为0.1%甲酸水-乙腈(v/v,9/1)。该方法在5~50"μg/L范围内线性良好,线性相关系数为0.999 7,检出限为5"μg/kg,动物源性食品的泰地罗新回收率81.8%~110.6%,相对标准偏差在1.38%~7.14%。本方法准确度较高,适用于动物源食品中泰地罗新残留量检测。
关键词" 动物源性食品;泰地罗新;高效液相色谱-串联质谱;检测条件优化
中图分类号" S859.84"""""" 文献标识码" A"""""" 文章编号" 1007-7731(2024)21-0082-06
DOI号" 10.16377/j.cnki.issn1007-7731.2024.21.017
作者简介 沈宏林(1965—),男,安徽寿县人,高级工程师,从事食品安全检验检测工作。
收稿日期 2024-08-26
Determination of Tildipirosin in animal-origin foodstuffs by HPLC-MS/MS
SHEN Honglin
(Anhui Provincial Food and Drug Inspection Institute, Hefei 230051, China)
Abstract" To establish a high performance liquid chromatography-mass spectrometry (HPLC-MS/MS) method suitable for the detection of residues of Tildipirosin in animal-origin foodstuffs. Chromatography, mass spectrometry, purification conditions and solution were optimized to establish a method for the determination of residues of Tildipirosin in animal-origin foodstuffs. The recovery and precision of animal derived food such as pig, cow, mutton and offal were measured. The results showed that The chromatographic conditions were Aglient ZORBAX SB C18 column and acetonitrile-0.1% formic acid water as mobile phase. The mass spectrum conditions were 734.4 m/z as parent ion, 98.2 m/z and 174.4 m/z as daughter ion. The purification condition were HLB (150 mg, 6 mL) solid phase extraction column as the purification column, 5 mL 50% methanol aqueous solution was used as the sample solution, and 5 mL 5% aminoacetonitrile was used as the elution solvent. The constant volume solution was 0.1% formic acid water-acetonitrile(v/v,9/1). The linear correlation coefficient was 0.999 7, the detection limit was 5"μg/kg, the recovery rate of Tildipirosin in animal-origin foodstuffs was 81.8%-110.6%, and the relative standard deviation was 1.38%-7.14%. The method had high accuracy and was suitable for the detection of residues of Tildipirosin in animal-origin foodstuffs.
Keywords" animal-origin foodstuffs; Tildipirosin; HPLC-MS/MS; detection condition optimization
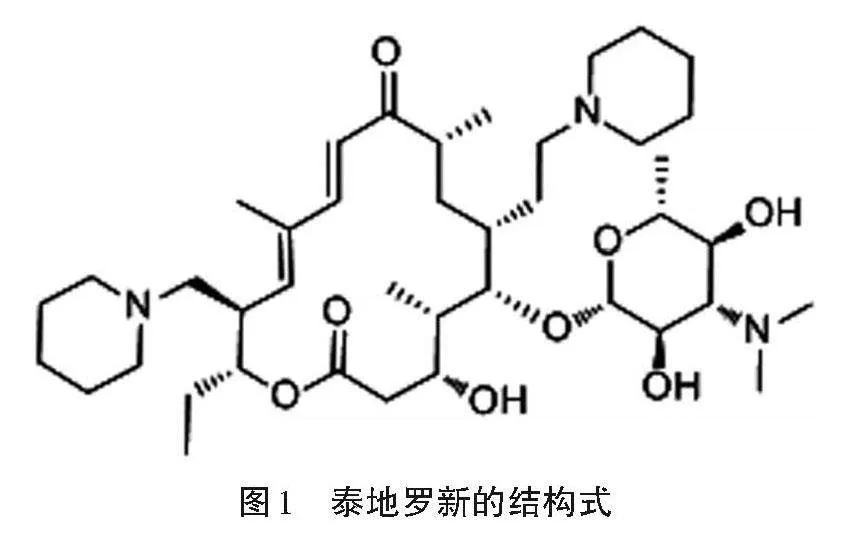
泰地罗新(Tildipirosin),CAS号为328898-40-4,分子式C41H71N3O8,分子量734.02,结构式如图1所示。属于新一代大环内酯类半合成抗菌药物,微溶于水,易溶于甲醇、丙酮和乙腈等极性有机溶剂。其分子结构中具有3种氨基基团,为大环内酯环C5上存在的一个碳霉胺糖基,以及C20和C23上分别存在一个哌啶基,是一种具有一定碱性的大环内酯类药物。其3种氨基基团的特殊性,使该药物能够具有特殊的亲水平衡性质,从而起到有效的抑菌、杀菌作用。袁园园等[1]研究表明,其具有较强的抑制革兰氏阳性菌及某些其他革兰氏阴性菌的特效作用。
该化合物发挥作用的主要药理机制是通过结合核蛋白体的50S亚基,以抑制、阻止核蛋白肽链的延长及合成,从而起到阻止细菌蛋白质的合成作用,使其具有抑菌和杀菌效果。由于泰地罗新具有一定的碱性,因此在酸性环境下药物的抑菌活性会降低,在碱性条件下的抑菌活性较高。其作为广谱抗菌药物,对猪、牛和羊等动物的呼吸道疾病的病原菌具有较强的抗菌活性。猪、牛和羊具有较高的的呼吸道疾病发病率,严重时可能导致动物生长缓慢、甚至死亡等,在一定程度上影响养殖业的经济效益[2-3]。
泰地罗新作为一种动物专用抗菌药被批准使用,并规定了猪、牛和羊的肌肉、肝脏和肾脏中的最高残留限量[4]。王文湘等[5]建立适用于猪组织中泰地罗新残留检测的高效液相色谱-串联质谱法,其灵敏度高且特异性强。吴剑平等[6]通过分散固相萃取结合液相色谱-串联质谱法检测牛可食性组织中泰地罗新残留量,其具有较好的准确度与精密度。建立动物源性食品中泰地罗新残留量检测方法,有利于保障动物源性食品品质[7]。基于此,本文以猪、牛和羊肉及其内脏为代表的动物源性食品为试验样品,建立一种高效液相色谱-串联质谱法(HPLC-MS/MS)测定动物源性食品中泰地罗新残留量,为相关动物体内该物质残留量检测提供参考。
1 材料与方法
1.1 仪器与试剂
HPLC-MS/MS(6460,美国Agilent公司);离子水发生器(Milli-Q型,美国Millipore公司);乙腈、甲醇、甲酸(色谱纯,TEDIA,USA);氨水、氯化钠(分析纯,国药);HLB萃取柱(150"mg,6"mL),使用前用5"mL甲醇、5"mL水进行活化;微孔过滤膜(有机型,孔径0.22 μm)。
标准储备液:称取泰地罗新标准品(S08018110,天津阿尔塔科技有限公司)10"mg,用乙腈溶于10"mL容量瓶中,配制成浓度1"mg/mL的泰地罗新储备液。-18"℃冰箱中保存,有效期180"d。根据实际需要用流动相将标准储备液稀释成适合浓度的标准工作溶液,现配现用。
1.2 样品前处理
称取约2"g动物源性食品试样,置于50"mL离心管中,加入20"μL泰地罗新-D10标准溶液(1"μg/mL),2"g氯化钠,再加入10"mL 5%氨水乙腈溶液,均质1"min,超声15"min,8 000 r/min离心5"min,取上清液转移至另一离心管中,样品残渣再加入5"mL 5%氨水乙腈溶液,重复提取一次,合并两次上清液作为提取液,于45"℃水浴中旋转蒸发至近干。用5"mL 50%甲醇水溶液溶解,待净化。
HLB萃取柱(150"mg,6"mL)用5"mL甲醇、5"mL水活化,取全部待净化液过柱,控制流速,依次用5"mL水、5"mL10%甲醇水溶液淋洗,再用5"mL 5%氨化乙腈溶液洗脱,收集洗脱液,在40"℃水浴中氮吹至近干,加入1"mL定容液溶解残渣,涡旋,10 000 r/min离心2"min,取下层清液过0.22 μm滤膜,上机测定。
1.3 试验方法
1.3.1 色谱谱条件的优化 选择Aglient ZORBAX SB C18(50"mm×2.1"mm,1.8 µm)和Acquity BEH C18(50"mm×2.1"mm,1.7 µm)进行分离比较,确定最优色谱柱。在流动相条件中设置梯度洗脱条件,比较乙腈-水、甲醇-水、乙腈-0.1%甲酸水溶液和甲醇-0.1%甲酸水溶液作为流动相的检出结果。1.3.2 质谱条件的优化 利用1"mg/L的泰地罗新及泰地罗新-D10标准溶液,采用直接进样模式,进样量1"µL,优化泰地罗新和D10-泰地罗新的质谱条件,优化的参数包括离子源温度、毛细管温度、加热气流速、干燥气流速、氮气流速、特征离子对和碰撞能量等质谱分析条件,通过设置不同条件下仪器参数,确定仪器最优检测条件,使泰地罗新和泰地罗新-D10质谱响应值达到最高。
1.3.3 净化条件的选择 参考文献[8-11],比较C18、HLB和中性氧化铝固相萃取柱的净化效果;比较5"mL的20%甲醇、50%甲醇和80%甲醇水溶液上样溶剂的净化效果;比较不同氨水浓度(0、1%、2%、5%和8%)的洗脱效果;比较1、2、3、5和8"mL洗脱体积条件下泰地罗新的回收率。
1.3.4 定容液的选择 分别选用乙腈、乙腈和水混合液(v/v,1/9)、含0.1%甲酸水和乙腈混合液(v/v,9/1)配制5 ng/mL的泰地罗新标准溶液进行分析。
1.4 测定指标和方法
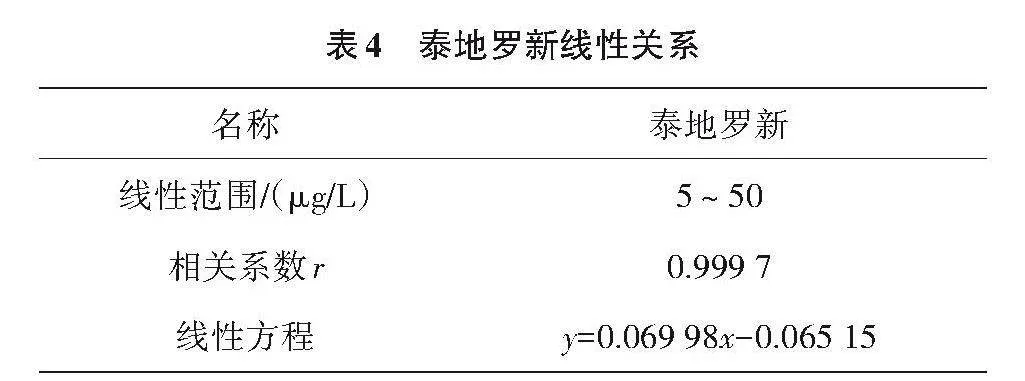
1.4.1 线性范围与检出限 分别配制浓度为5、10、20、50和100"μg/L的标准溶液,5个标准内标浓度10"μg/L,采用HPLC-MS/MS测定。以泰地罗新峰面积与内标峰面积比为纵坐标,被测组分浓度为横坐标作线性回归曲线。
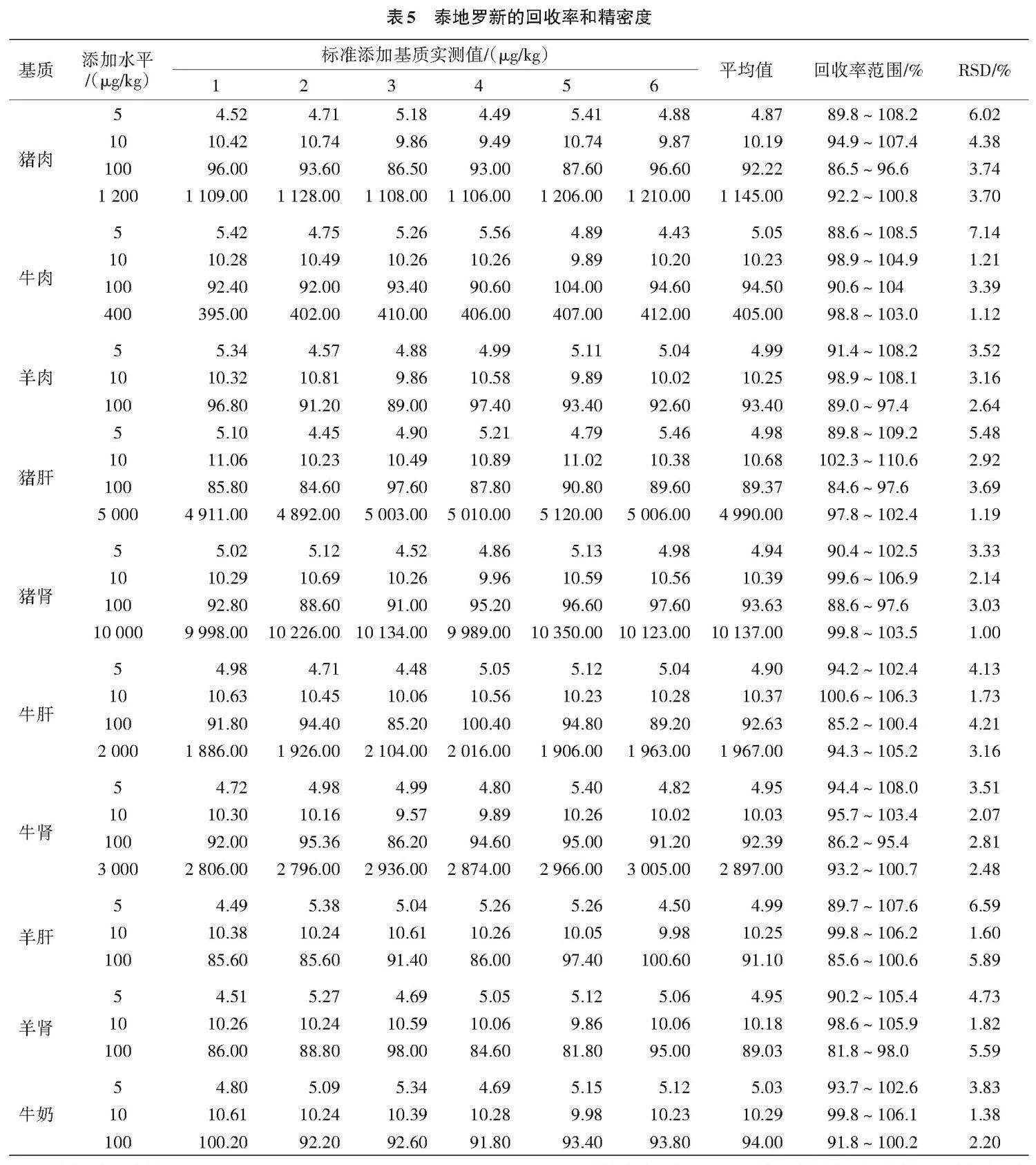
1.4.2 回收率与精密度 称取经测定不含有泰地罗新的猪肉、牛肉、羊肉、猪肝、猪肾、牛肝、牛肾、羊肝、羊肾和牛奶样品为空白样品基质,根据各基质限量要求,分别添加高、中和低浓度水平的泰地罗新,充分混匀,每个水平重复6次。计算其回收率和精密度。
1.5 色谱、质谱参数
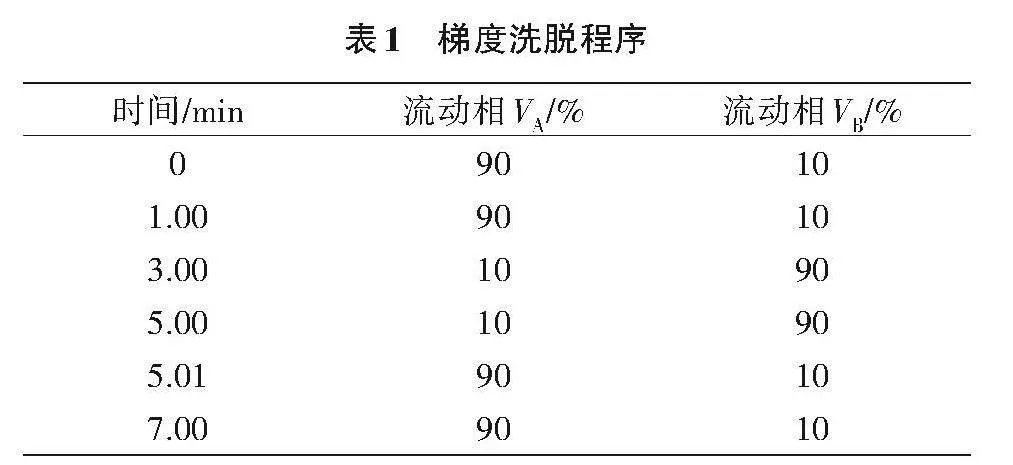
1.5.1 色谱参数 液相色谱柱:C18色谱柱,50"mm × 2.1"mm(内径),1.8 μm,或性能相当者;流动相:A为0.1%甲酸溶液,B为乙腈;梯度洗脱程序见表1。柱温30"℃,进样量10.0"µL,流速0.3"mL/min。
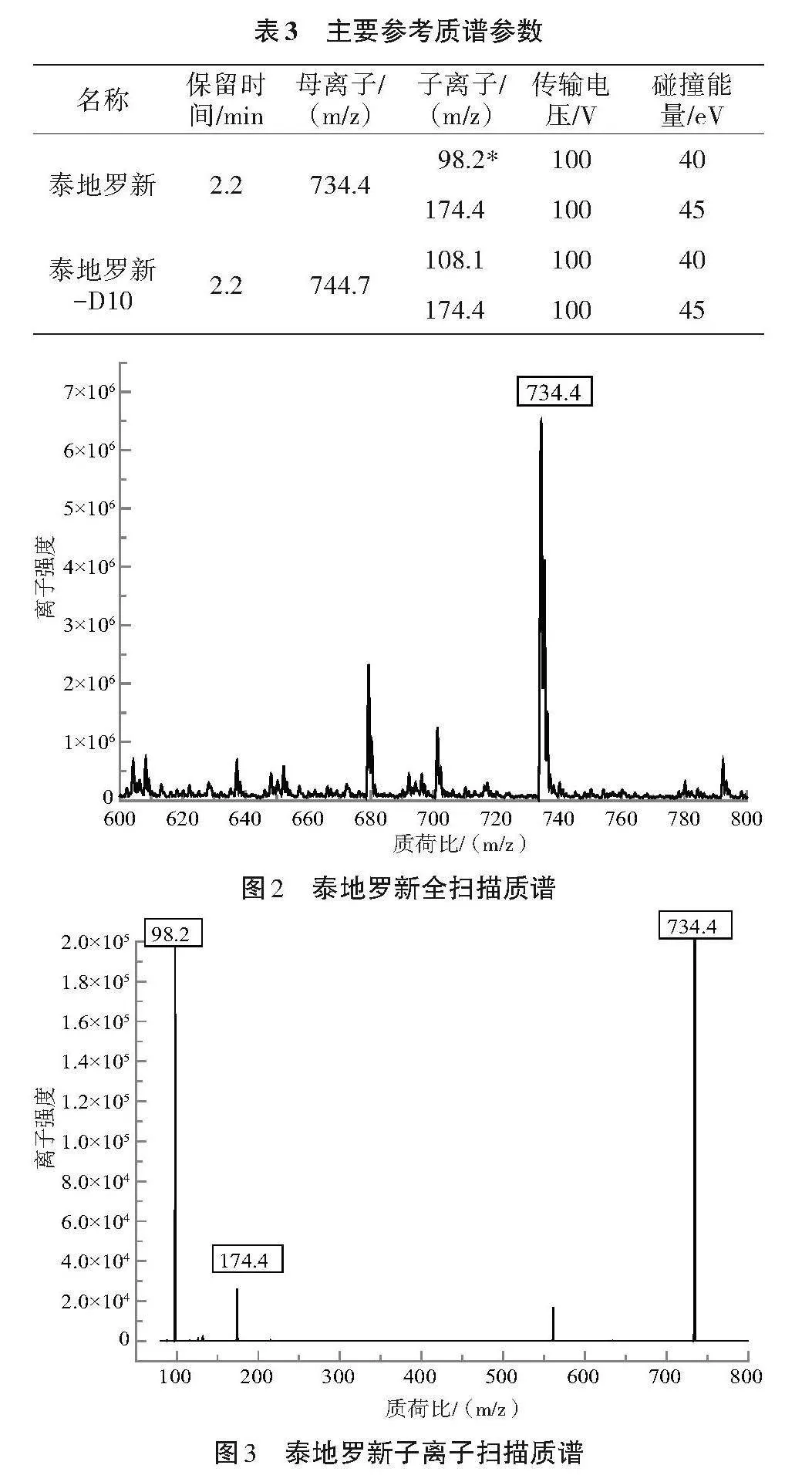
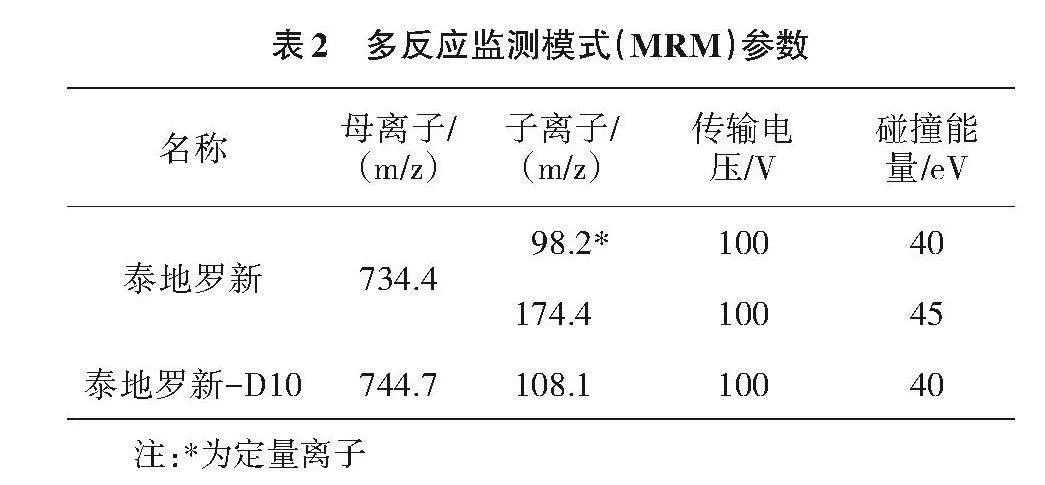
1.5.2 质谱参数 离子源,电喷雾离子源(ESI);扫描方式,正离子扫描;离子源温度,350"℃;脱溶剂,380"℃;脱溶剂气流速,10"L/min;细管电压,3.0"kV。泰地罗新和泰地罗新-D10定量离子对、定性离子对以及对应传输电压、碰撞能量等参数值见表2。
2 结果与分析
2.1 仪器条件的选择
2.1.1 色谱条件的优化 通过不同色谱柱的分离比较试验,发现Aglient ZORBAX SB C18(50"mm×2.1"mm,1.8 µm)分析柱灵敏度更高且色谱峰形最优,能够满足试验要求。
选用Aglient ZORBAX SB C18(50"mm×2.1"mm,1.8 µm),流速0.3"mL/min,进样量10"µL,比较了不同流动相条件下基质色谱分离情况,结果表明,梯度洗脱条件及流动相中没有甲酸存在时,两者的电离效果较差,出现峰拖尾、峰形对称性差和灵敏度下降等情况。甲醇-0.1%甲酸水溶液作为流动相时灵敏度下降,乙腈-0.1%甲酸水溶液为流动相后情况得到了改善,且峰形和灵敏度均能满足要求。因此确定乙腈-0.1%甲酸水溶液梯度洗脱作为流动相。
2.1.2 质谱条件的优化 主要参考质谱参数见表3。根据泰地罗新结构性质,正离子模式相应值高于负离子模式。泰地罗新的母离子(一级)全扫描质谱见图2,其母离子峰734.4响应值最高,因此选择其为母离子;在此基础上优化子离子的质谱条件,其子离子的全扫质谱图见图3,其中98.2和174.4响应值最高,在此基础上优化其碰撞能量,使其响应值达到最高。通过优化母离子和子离子的质谱参数,最终确定泰地罗新及泰地罗新-D10的多反应监测离子对。
2.2 净化条件的选择
比较了C18、HLB和中性氧化铝固相萃取柱的净化效果。结果表明,C18回收率最低,中性氧化铝净化效果较HLB差,HLB固相萃取柱的回收率和净化效果最好。由于C18固相萃取柱主要适用于非极性物质,且其pH耐受性在2~8,而HLB固相萃取柱适用于非极性到极性物质,pH的耐受性较强,在1~14。因此最终选择HLB(150"mg,6"mL)固相萃取柱作为净化柱。
比较了5"mL的20%甲醇、50%甲醇和80%甲醇水溶液上样溶剂,其中含有泰地罗新100"μg,收集其过柱溶液。结果表明,20%甲醇、50%甲醇的过柱溶液中均未检测出泰地罗新,80%甲醇过柱溶液中含有泰地罗新,综合考虑泰地罗新的溶解特性,选择5"mL 50%甲醇水溶液作为上样溶液。
采用浓度为50"μg/L含有不同基质标准溶液经过HLB固相萃取柱,基质溶液的上样体积为5"mL,根据泰地罗新的化学性质,比较不同氨水浓度(0、1%、2%、5%和8%)的洗脱效果。结果表明,当洗脱溶剂中氨水浓度不断增加,泰地罗新的回收率不断升高,但是当氨水的浓度超过5%后,洗脱下来的溶剂中杂质的含量也不断增加,影响泰地罗新含量的检测。因此最终选择5%的氨水乙腈作为洗脱溶剂。
在5%氨水乙腈作为洗脱溶剂的基础上,比较了1、2、3、5和8"mL洗脱条件下泰地罗新的回收率。结果表明,随着洗脱体积的增加泰地罗新的回收率不断增加,当洗脱溶剂的体积为5"mL时,泰地罗新的回收率达到95%左右;体积为8"mL时,回收率是95%,表明当洗脱体积为5"mL时已能够完全洗脱吸附在HLB固相萃取上的泰地罗新,继续增加洗脱体积不会增加回收率,而且还可能会洗脱更多的杂质,因此最终选择的洗脱溶剂体积为5"mL。
2.3 定容液的选择
分别选用乙腈、乙腈和水混合液(v/v,1/9)、以及含0.1%甲酸水和乙腈混合液(v/v,9/1)配制5 ng/mL的泰地罗新标准溶液进行分析。结果发现,仅选用甲醇作为定容液时,泰地罗新峰形有严重分叉,考虑到溶剂效应的影响后,改用乙腈和水混合液(v/v,1/9)作定容液,此时峰形良好;向定容液中添加甲酸后,目标物的响应值增加,改变酸度,结果发现使用初始流动相比例0.1%甲酸水-乙腈(v/v,9/1)作定容液,泰地罗新的峰形最好,灵敏度最高。因此,最终选用0.1%甲酸水-乙腈(v/v,9/1)作为定容液,该条件下泰地罗新的流动性、兼容性好,可有效避免溶剂效应产生。
2.4 线性范围与检出限
不同浓度的标准品测定结果表明,泰地罗新在5~100"μg/L浓度范围内具有良好的线性关系(表4)。以空白基质添加法确定HPLC-MS/MS对泰地罗新定量限5"μg/kg。
2.5 回收率与精密度
按照本试验方法进行不同组织样品的测定,
其回收率和相对标准偏差见表5。由表5可知,该方法下回收率在81.8%~110.6%,相对标准偏差(RSD)在1.00%~7.14%。说明该方法可以较好地检测泰地罗新残留量。
3 结论与讨论
动物源性食品种类多且基质较复杂,主要含有蛋白质、脂肪和矿物质等成分。如果不采取净化方法,可能会导致离子化效率降低,造成泰地罗新的响应值较低,而且易对色谱柱及质谱系统造成污染[12-13]。泰罗地新含有碱性叔胺基团,会与硅胶表面未被键合的硅醇基反应,导致其在硅胶基固定相中发生拖尾现象,影响分离效果,同时样品定容液可能对泰地罗新的峰形及灵敏度产生影响[14]。在流动相条件中设置梯度洗脱条件可有效分离以及有效减少基质干扰,使目标物和杂质有效分离,能够保障检测结果的准确性[15]。
综上,本试验建立了HPLC-MS/MS测定动物源性食品中泰地罗新残留量的方法,通过对各项参数的试验,研究出最佳净化方法,使仪器检测灵敏度达到最佳。具体检测条件:以Aglient ZORBAX SB C18为色谱柱,乙腈-0.1%甲酸水为流动相,HLB(150"mg,6"mL)固相萃取柱为净化柱,5"mL 50%甲醇水溶液为上样溶液,5"mL 5%氨水乙腈为洗脱溶剂,0.1%甲酸水-乙腈为定容液。该方法下动物源性食品中泰地罗新的回收率和精密度较高,能够准确测定其残留量,为动物源性食品中泰地罗新残留量检测提供参考。
参考文献
[1] 袁园园,耿雅丽,杨琳,等. 泰地罗新的研究进展[J]. 中国动物保健,2022,24(4):115-116.
[2] 李龙飞,孔梅,郑莉,等. 泰地罗新注射液治疗猪呼吸道疾病临床疗效试验[J]. 现代畜牧兽医,2021(1):46-50.
[3] 杨昆,孙志良,隆雪明. 动物专用抗生素泰地罗新[J]. 动物医学进展,2018,39(3):110-114.
[4] 杨佳颖,张新瑞. 2019年上半年共审批新兽药注册50个[J]. 中国动物保健,2019,21(8):17-20.
[5] 王文湘,闫超群,华成云,等. 高效液相色谱-串联质谱法测定猪组织中泰地罗新残留[J]. 华南农业大学学报,2018,39(6):32-38.
[6] 吴剑平,张婧,贡松松,等. 分散固相萃取结合液相色谱串联质谱法检测牛可食性组织中泰地罗新残留量[J]. 中国兽药杂志,2019,53(3):37-46.
[7] 薛莉君,刘碧林,杨洋,等. 超高效液相色谱-串联质谱法测定4种禽畜肉中泰地罗新残留量[J]. 理化检验-化学分册,2020,56(6):676-681.
[8] 魏欣欣,刘宝如,郄俊青,等. 液相色谱-串联质谱法测定动物源性食品中克伦丙罗残留量[J]. 中国口岸科学技术,2023,5(12):61-66.
[9] 徐彦辉,刘燕,丁磊. 液相色谱串联质谱仪测定液体乳中雌二醇含量[J]. 现代农业科技,2016(17):256-257,259.
[10] ROSE M,MENGE M,BOHLAND C,et al. Pharmacokinetics of tildipirosin in porcine plasma,lung tissue,and bronchial fluid and effects of test conditions on in vitro activity against reference strains and field isolates of Actinobacillus pleuropneumoniae[J]. Journal of veterinary pharmacology and therapeutics,2013,36(2):140-153.
[11] LI X M,WEN K,CHEN Y Q,et al. Multiplex immunogold chromatographic assay for simultaneous determination of macrolide antibiotics in raw milk[J]. Food analytical methods,2015,8(9):2368-2375.
[12] 汤文利,郭玉秋,李有志,等. 超高效液相色谱法测定原料药中泰地罗新的含量[J]. 中国兽药杂志,2023,57(7):25-32.
[13] 严凤,周哲,黄家莺,等. 超高效液相色谱-四级杆-静电场轨道阱高分辨液质联用解析泰地罗新注射液中的有关物质[J]. 中国抗生素杂志,2018,43(1):73-79.
[14] 冯光. UPLC-MS/MS法测定猪组织中泰地罗新残留量[J]. 黑龙江畜牧兽医,2020(4):47-51.
[15] 阚育洵,郝卫强,徐瑾,等. 液相色谱中线性溶剂强度模型的快速建立[J]. 现代仪器与医疗,2024,30(2):29-33.
(责任编辑:胡立萍)

